马鞭草中总黄酮的超声波辅助提取及其抗氧化活性研究
2013-05-16卞杰松冯纪南谭巧燕邓斌
卞杰松,冯纪南,谭巧燕,邓斌*
(1.湘南学院 化学与生命科学系,湖南 郴州423000;2.湘南学院 财务处,湖南 郴州423000)
0 引言
马鞭草(Verbena Officinalis L.)又叫铁马鞭、自马鞭、疟马鞭,皆以穗类鞭鞘而得名.为马鞭草科(Verbenaceae)多年生草本植物马鞭草的全草或根.常生于河岸、草地、荒地、路边、田边及草坡等处,全国各地均有分布[1].马鞭草在我国作为一种传统的中药,具有清热解毒、利尿消肿、活血通经等功效,广泛用于治疗伤风感冒、水肿、痢疾、黄疸等疾病,被医学专家誉为21世纪最具前途的绿色中草药物之一,全草含有黄酮类、甾醇、氨基酸、内酯或酯类和酚性成分[2,3].鉴于黄酮类物质具有抗心脑血管病、抗氧化、抗病毒、抗肿瘤、抗衰老、抗过敏、免疫调节等作用,马鞭草黄酮类化合物的研究日益引起了人们的重视[4,5].黄酮类化合物常用提取方法为有机溶剂回流提取等,但存在提取时间长等缺点.而超声辅助提取作为一种优良的提取方法,具有操作简便快捷、提取时间短及提出率高等特点,目前己广泛应用在生物活性物质的提取方面[6,7].为进一步研究马鞭草黄酮类化合物的功效,充分利用马鞭草资源,本实验以马鞭草中总黄酮提取率为考察指标,采用单因素试验和正交试验的方法对超声波辅助提取马鞭草总黄酮的工艺条件进行探讨,确定其最佳提取工艺,并对马鞭草黄酮类化合物物的抗氧化性进行测定,以期为马鞭草功能性成分的研究开发提供依据.
1 材料与方法
1.1 材料与试剂
马鞭草购于郴州市老百姓大药房,置于烘箱中80℃烘干,粉碎、过60目筛后置于干燥器中备用.无水乙醇、NaNO2、Al(NO3)3、NaOH、硫酸亚铁、水杨酸、双氧水、邻苯三酚、Tris、盐酸(以上试剂均为分析纯);芦丁标准品(批号10080-200306),中国药品生物研究所.
1.2 仪器与设备
UV-7502PC型紫外-可见分光光度计,上海欣茂仪器有限公司;DHG-9143BS-III型数显电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;FA2104N型电子分析天平,上海精密科学仪器有限公司;KQ-500BE型超声波清洗器,昆山市超声仪器有限公司;SHB-IV双A型循环水式多用真空泵,郑州长城科工贸有限公司;SENCO R201L型旋转蒸发器,上海申生科技有限公司;DS-1型高速组织捣碎机,上海标本模型厂.
1.3 方法
1.3.1 标准曲线的绘制
精密称取干燥至质量恒定的芦丁标准品10 mg,用无水乙醇溶解并定容于50 mL容量瓶中,得到0.2 mg/mL芦丁标准液.分别精密吸取 0、0.4、0.8、1.2、1.6、2.0 mL 芦丁标准液于 10 mL 比色管中,加无水乙醇至 5.0 mL,加入质量浓度 5g/100 mL NaNO2溶液0.3 mL,摇匀放置6 min,再加入质量浓度10 g/100mL Al(NO3)3溶液0.3 mL,摇匀放置6 min,最后加1 mol/L NaOH溶液4 mL,用无水乙醇溶液补至刻度,摇匀放置10 min后,以无水乙醇为空白对比,在510 nm处测定其吸光度,吸光度(A)与溶液质量浓度(C)进行线性回归,得回归方程 A=10.993C+0.0011,R=0.9997.
1.3.2 马鞭草中总黄酮的提取及含量测定
称取处理好的马鞭草粉末2.000 g于锥形瓶中,在不同条件下进行超声波辅助提取,提取液经抽滤后用相同体积分数的乙醇溶液定容至一定体积,准确吸取一定体积的提取液,加0.05 g/mL亚硝酸钠溶液0.2 mL,摇匀后放置6 min,加0.1 g/mL硝酸铝溶液0.2 mL,摇匀后放置6 min,加1.0 mol/L氢氧化钠溶液2.0 mL,再加乙醇定容至10 mL,摇匀,放置15 min,510 nm波长处测定其吸光度,根据回归方程由吸光度求出各处理一定体积的提取液中黄酮的含量,并按照(1)计算出黄酮类化合物提取率.在单因素试验的基础上,选取4因素3水平进4行L9(34)正交试验,确定最佳提取工艺.

1.3.3 马鞭草中黄酮类化合物对羟基自由基的清除率测定
参照文献[8]的方法.取5 支具塞试管依次向其中各加入 2.0 mmol/L FeSO42.0 mL、1.0 mmol/L H2O22.0 mL,振荡,摇匀.再加入6.0 mmol/L水杨酸3.0 mL,摇匀,于37℃水浴加热15 min.加热完毕于510 nm波长处分别测定吸光度A0.之后分别向 5 支试管中加入待试样品(马鞭草的乙醇提取物,黄酮含量为 0.4312 mg/mL)0.2、0.4、0.6、0.8、1.0 mL,接着再分别添加超纯水 0.8、0.6、0.4、0.2、0.0 mL,摇匀,继续水浴加热 15 min,待加热完毕后再次分别测其吸光度 Ax.对照实验:用 2.0 mL 蒸馏水取代H2O2溶液,严格重复上述过程,测吸光度Ax0,则样品对羟自由基的清除率计算见式(2).
1.3.4 马鞭草中黄酮类化合物对超氧阴离子自由基的抗氧化作用
1.3.4.1 对超氧阴离子自由基清除率的测定
参照文献[9,10]的方法.取6 支试管,分别编号为 0、1、2、3、4、5,各加入4.5 mL pH8.2 的50 mmol/LTris-HC1 缓冲液,再分别加入质量浓度为 0.4335 mg/mL 的黄酮提取液 0.0、0.2、0.4、0.6、0.8、1.0 mL,然后依次加蒸馏水 1.0、0.8、0.6、0.4、0.2、0.0 mL,混匀后在25℃恒温水浴中保温20 min,取出后立即加入在25℃预热过的3.0 mmol/L邻苯三酚溶液0.3 mL(以10.0 mmol/LHCl溶液配制)启动反应.5 min后加4滴10.0 mol/L盐酸终止反应.同时另取 6支试管,分别编号为 0’、1’、2’、3’、4’、5’,按上述步骤依次加入 Tris-HCl缓冲液、黄酮类化合物提取液和蒸馏水,然后分别加10.0 mmol/L盐酸0.3 mL,5 min后加4滴10.0 mol/L盐酸终止反应.在325 nm 处用管0调零,测管0’的吸光度,为A对照;用管1调零,测管1’的吸光度,为A加药1,再依次用管 2、3、4、5 调零测管 2’、3’、4’、5’的吸光度,得 A加药2、A加药3、A加药4、A加药5.按照式(3)计算各质量浓度黄酮类化合物提取液对超氧阴离子自由基的清除率.

1.3.4.2 对超氧阴离子自由基生成速度的抑制率测定
按照上述(黄酮类化合物提取液对超氧阴离子自由基清除率的测定)的反应体系,反应启动后,每30 s测一相应的A值,至5 min止.将所得的A值与时间进行回归分析,其斜率为超氧阴离子自由基的生成速度V.然后按公式(4)计算出各质量浓度黄酮类化合物提取液对超氧阴离子自由基生成速度的抑制率.
2 结果与讨论
2.1 单因素试验
2.1.1 乙醇体积分数对马鞭草总黄酮提取效果的影响
在超声提取温度为60℃、超声提取时间20 min、超声波功率400 W、固液比1∶30(g/mL)的条件下,分别考察体积分数为40%、50%、60%、70%、80% 的乙醇溶液对马鞭草总黄酮提取效果的影响,结果如图1所示.
从图1可以看出,提取率随着乙醇体积分数的增大而提高,当乙醇浓度上升至70%以后,总黄酮的提取率提高幅度趋于平稳,虽然在实验范围内,用80%乙醇作为提取剂时,得到的提取率最高,但实验发现此时提取出的非黄酮类干扰物质也越多,同时考虑到经济效益、提取成本等问题,选择乙醇体积分数在60% ~70%范围内是适宜的.
2.1.2 超声提取时间对马鞭草总黄酮提取效果的影响
在超声提取温度为60℃、超声波功率400 W、乙醇体积分数70%、固液比1∶30(g/mL)条件下,分别考察超声提取时间为5 min、10 min、15 min、20 min、25 min条件下,超声辅助提取对马鞭草中总黄酮提取效果的影响,结果如图2所示.
从图2可以看出,超声提取时间在5~20 min之间提取率变化较大,在20 min达到最大值,然后提取率随着时间的延长开始下降,这可能是时间过长,黄酮类物质易于分解,且时间过长,温度容易偏高,使细胞内蛋白凝固,黄酮类物质不易溶出.因此超声提取时间控制在20 min左右较佳,有鉴于此,在以下的正交实验中提取时间不再作为一个主要因素予以考察.
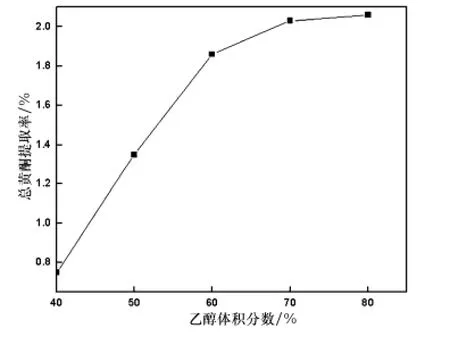
图1 乙醇体积分数对马鞭草中总黄酮提取率的影响
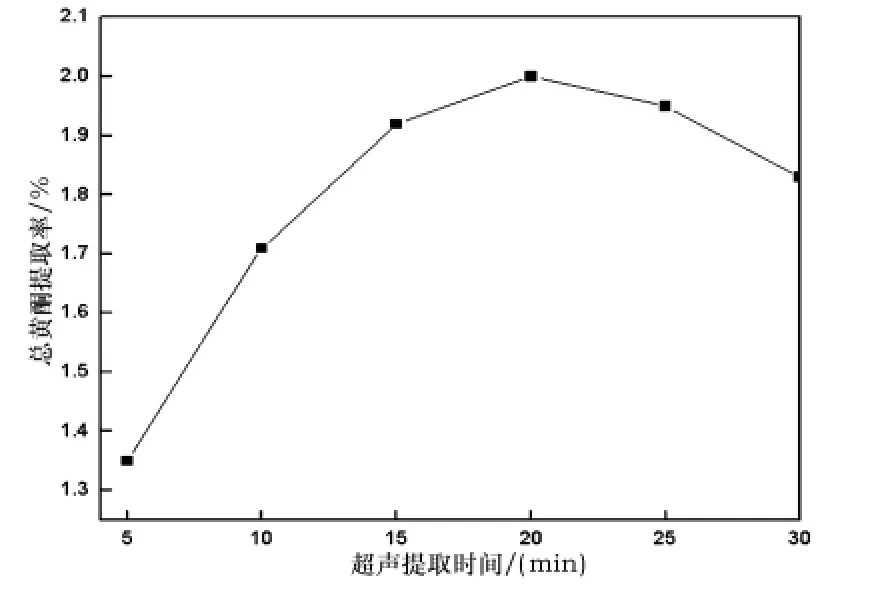
图2 超声提取时间对马鞭草中总黄酮提取率的影响
2.1.3 超声波功率对马鞭草总黄酮提取效果的影响
在超声温度60℃、超声时间20 min、乙醇体积分数70%、固液比1∶30(g/mL)的条件下,分别考察超声功率为300 W、400 W、500 W、600 W、700 W时,提取工艺对马鞭草总黄酮提取效果的影响,结果如图3所示.
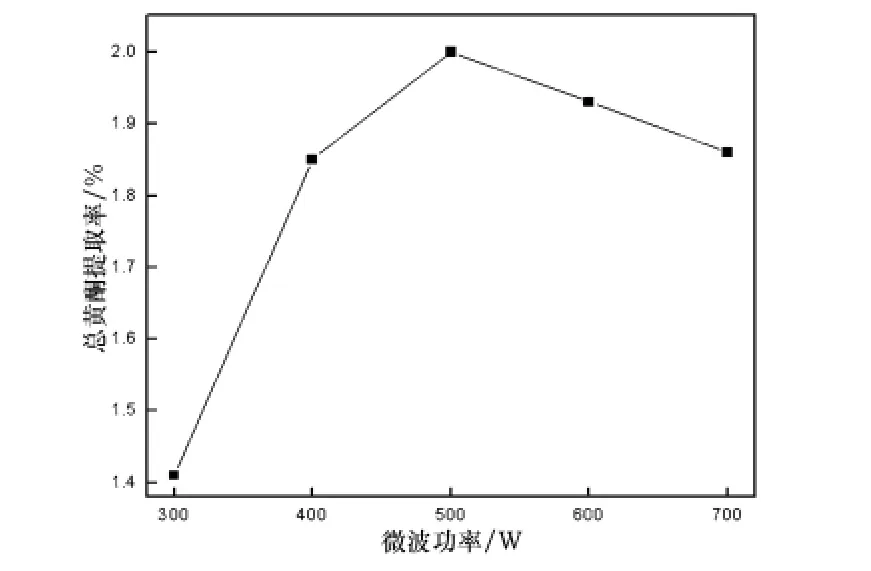
图3 超声波功率对马鞭草中总黄酮提取率的影响
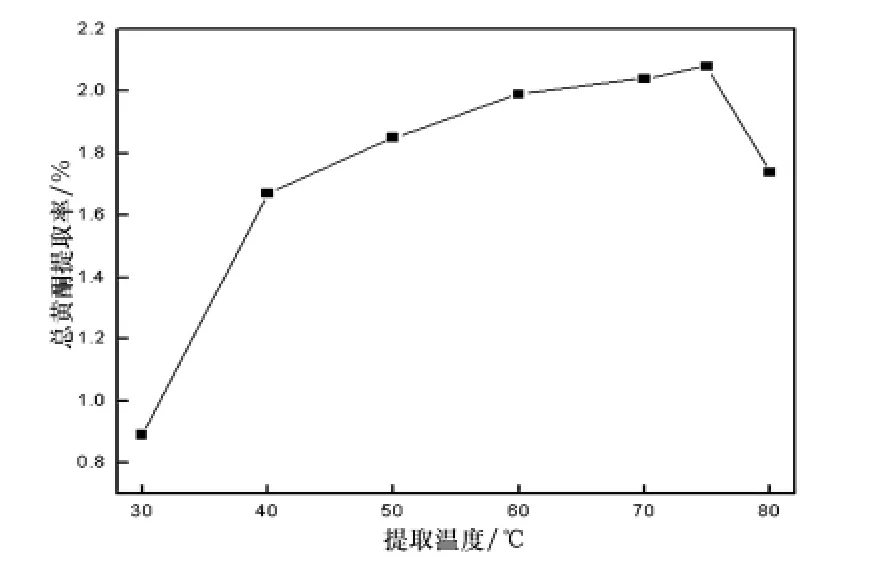
图4 超声提取温度对马鞭草中总黄酮提取率的影响
由图3可知,随着超声功率的提高,总黄酮的提取率逐渐增加,在超声功率为500 W时达到最大,之后反而降低,因此选择500 W功率为适宜超声功率.
2.1.4 超声提取温度对马鞭草总黄酮提取效果的影响
在超声功率400 W、超声时间20 min、乙醇体积分数70%、固液比1∶30(g/mL)条件下,分别考察超声提取温度为30℃、40℃、50℃、60℃、70℃、80℃时对马鞭草总黄酮提取效果的影响,结果如图4所示.
从图4可以看出,随着提取温度的升高,总黄酮的提取率也随之升高,当温度达到60~70℃时总黄酮提取率处于较高值,当温度高于75℃以后,总黄酮的提取率随着温度升高而开始降低,这是因为温度过高时,乙醇(沸点78℃)对提取物质间的氢键的缔合力降低,溶解度减小,故总黄酮的提取率减小,提取效果降低.因此,可将超声辅助提取温度控制在70℃附近为宜.
2.1.5 固液比对马鞭草黄酮类化合物提取效果的影响
在超声功率400 W、超声时间20 min、乙醇体积分数70%、超声温度60 ℃条件下,分别考察固液比为 1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)时对马鞭草黄酮类化合物提取效果的影响,结果如图5所示.
由图5可知,随着固液比的增大,总黄酮提取率逐步升高,当固液比达到1∶40后,进一步提高固液比,提取率增加趋于缓慢,考虑提取效益、溶剂成本及回收问题,选取固液比为1∶40(g/mL)是适宜的.
2.2 正交试验设计及结果
综合单因素试验的结果,利用极差法确定出乙醇体积分数、超声提取时间、固液比、超声提取温度为影响马鞭草中总黄酮提取效果的主要因素,对上述4个因素以总黄酮提取率为评判指标,选用L9(34)正交表进行试验优选方案设计,其因素水平设置见表1,试验结果如表2所示.

图5 固液比对马鞭草中总黄酮提取率的影响

表1 因素水平设计表

表2 L9(34)正交试验设计及结果
由表2结果可知,影响马鞭草中总黄酮提取率4个主要因素的主次顺序为:D>B>A>C,即固液比>超声波功率>提取温度>乙醇体积分数.通过极差分析,结果表明,正交试验得到的最佳提取工艺为:A3B2C3D3,即在提取时间20 min,选用固液比为1∶40(g/mL),乙醇体积分数为70%,超声辅助提取温度为70℃,超声波功率为500 W.采用上述最佳提取工艺条件进行3次重复实验,得到的马鞭草中黄酮类化合物提取率分别为2.88%、2.87%、2.86%,进而得出黄酮类化合物提取率的平均值为2.87%,相对标准偏差(RSD)为0.121%.由此可见,经过正交实验筛选出来的马鞭草中总黄酮提取工艺条件是最优的组合,实验结果稳定可靠,具有良好的可操作性和重现性.
2.3 鞭草中黄酮类化合物对羟自由基的抗氧化性
近来大量研究成果表明,黄酮类化合物一方面通过其清除自由基的作用,直接抑制癌细胞的生长、从而提高机体免疫力而实现抗癌、防癌的作用,另一方面,该类化合物还能有效地阻止脂质过氧化引起的细胞破坏,起到天然抗氧化剂的功效[11].由图6可以看出,马鞭草中黄酮类化合物对羟自由基有很高的清除率,在一定范围内随着黄酮质量浓度的增大,清除率逐渐增大,最高可达90%以上,也即清除率与黄酮的用量存在着一定的量效关系.

图6 马鞭草黄酮质量浓度对羟基自由基清除率的影响

图7 马鞭草黄酮质量浓度对超氧阴离子自由基清除率和抑制率的影响
2.4 马鞭草中黄酮类化合物对超氧阴离子自由基的抗氧化性
由图7可以看出,在所选质量浓度范围内,马鞭草黄酮对邻苯三酚自氧化体系所产生的超氧阴离子自由基同样具有良好的消除和抑制作用,且马鞭草黄酮清除和抑制超氧阴离子自由基的能力随着黄酮加入量的增加而明显上升,即清除和抑制率与黄酮的用量存在着一定的量效关系.
3 结论
(1)超声波提取方法具有操作简便、无需加热、提取率高、速度快、效果好、提取物结构不被破坏等优点,该研究通过超声波辅助提取马鞭草中总黄酮的单因素和正交试验确定了总黄酮提取的最优条件:乙醇溶液体积分数70%、固液比1∶40(g/mL)、超声功率500 W、超声温度70℃条件下提取20 min,在此条件下提取率可达2.87%.
(2)抗氧化性实验表明,马鞭草中黄酮类化合物具有良好的清除羟自由基、超氧阴离子自由基的能力,在实验浓度范围内呈现出良好的量效关系,可作为食品功能因子,在医药和保健食品工业中有着很好的应用前景.
[1]张立卫,罗玉梅.马鞭草临床应用近况[J].现代医药卫生,2007,23(03):351-353.
[2]陈改敏,张建业,洪广峰,等.马鞭草中总黄酮的含量测定[J].中国现代应用药学杂志,2006,23(8):798-799.
[3]肖培根.新编中药志(第三卷)[M].北京:化学工业出版社,2002.32.
[4]孟良玉,兰桃芳,卢佳琨,等.败酱草中黄酮类化合物的提取及其抗氧化活性[J].食品科学,2010,31(24):214-217.
[5]卞杰松,邓斌,王存嫦,等.超声波提取马鞭草中黄酮类化合物的工艺研究[J].时珍国医国药,2009,20(6):1420-1421.
[6]严伟,李淑芬,田松江.超声波协助提取技术[J].化工进展,2002,21(9):469-651.
[7]赵兵,王玉春,欧阳潘,等.超声波在植物提取中的应用[J].中草药,1999,30(9):1-3.
[8]曹晓霞,李翠芹,王喆之.翅茎香青中黄酮类物质的提取及其抗氧化性研究[J].现代生物医学进展,2008,8(4):692-694.
[9]秦小明,林华娟,宁恩创,等.金花茶叶水提物的抗氧化活性研究[J].食品科技,2008(2):189-191.
[10]章爱华,邓斌,蒋刚彪,等.马齿苋黄酮提取液抗氧化活性的初步研究[J].食品科技,2008(8):140-145.
[11]乌兰格日乐,白海泉,翁慧.黄酮抗氧化活性研究进展[J].内蒙古民族大学学报,2008,23(3):277-280.
