超声内镜在诊断消化系统神经内分泌肿瘤中的作用▲
2013-05-16张湘莲覃山羽姜海行唐国都黄杰安陈志敏广西医科大学第一附属医院消化内科南宁市530021
张湘莲 覃山羽 姜海行 唐国都 黄杰安 陈志敏(广西医科大学第一附属医院消化内科,南宁市 530021)
胃肠胰腺神经内分泌肿瘤(gastroentero-pancreatic neuroendocrine tumors,GEP-NETs)是涉及神经系统和内分泌系统的一类特殊消化系统肿瘤,常见的发生部位为胰腺、直肠,其临床表现因肿瘤的发生部位、生长速度及所分泌的激素不同而表现各异。此类疾病因发病率低,临床表现无特异性,瘤体体积大多较小,较易误诊、漏诊。胰腺内分泌肿瘤因胰腺位于腹膜后、周边结构比较复杂,传统的影像学检查难以清晰地显示胰腺的结构,发生病变时临床也难以获得胰腺的活检组织;胃肠道内分泌肿瘤也即类癌,内镜下常表现为黏膜下隆起,有时难以与息肉或间质瘤区分。超声内镜(EUS)由于同时结合了内镜及超声探查的双重优点,可近距离清楚显示胃肠壁、胰腺及毗邻结构的病变。通过超声内镜引导下细针穿刺(EUS-FNA)可直接获取病灶组织细胞,为临床诊断提供病理依据,能进一步提高消化系神经内分泌瘤的诊断率。
1 资料与方法
1.1 临床资料 观察研究对象为2002年12月至2012年12月在我院住院治疗的16例患者,其中男性4例,女性12例,男女比为1∶3,年龄22~68岁,平均年龄47.2岁。术前常规行B超(16例)、螺旋CT(9例)、EUS检查(16例)。术前6例拟诊胰岛细胞瘤,1例拟诊血管活性肠肽瘤,8例拟诊为类癌,1例拟诊肾上腺占位性质待查。10例行外科手术治疗,6例经内镜下治疗。
1.2 仪器与设备 EUS采用Olympus EM-30型和OLYMPUSGF-UM230超声内镜及GF-UMQ240超声胃镜。微超声探头采用Olympus UM-2 R型导管式超声探头,有效长度2 050mm,插入部最大外径2.5 mm,探头频率12~20MHz,采用双孔道胃镜/肠镜。应用水囊直接接触法或(和)水囊法加脱气水充盈法。穿刺针为Wilson-COOK 22G穿刺针。
1.3 方法
1.3.1 术前准备 术前行上消化道检查。患者需空腹8 h以上,行下消化道超声内镜检查的患者应做好肠道清洁工作,行FNA的患者术前还应备有近三天的凝血功能、血常规、电解质等的检查结果。FNA检查前需准备好用于病理检查的必备物品,如载玻片、酒精灯、染色剂、显微镜等。
1.3.2 检查方法 对于胃肠道的病变,先在镜下直接观察病灶情况,然后在EUS下观察病灶管壁的层次结构,判断病灶的起源及有无浸润。对胰腺等邻近部位的病变,采用退镜法观察,首先进镜至十二指肠降部,抽吸肠腔气体后采用水囊或脱气水充盈法,逐步探查整个胰腺及毗邻结构,观察病灶大小、形态、位置、内部回声、与周边血管的关系等。FNA时需与多普勒图像结合,选择与病变最贴近并避开血管的最佳穿刺路径进行穿刺,每例穿刺1~3次。
1.4 统计学方法 将EUS检查结果与体表B超、螺旋CT检查结果进行比较,以术中所见病灶大体表现和术后组织病理结果为标准,用SPSS13.0进行确切概率法计算,P<0.05视为有统计学意义。
2 结 果
2.1 诊断结果16例均经病理证实为神经内分泌肿瘤,其中6例(37.5%,6/16)为胰岛细胞瘤,1例(6.25%,1/16)为血管活性肠肽瘤,6例(37.5%,6/16)为直肠类癌,1例(6.25%,1/16)为胃类癌,1例(6.25%,1/16)为胃神经内分泌癌(低分化型),1例(6.25%,1/16)为肾上腺嗜铬细胞瘤。
2.2 EUS特点16例神经内分泌瘤中,胰腺占位病变7例(43.7%,7/16),均为实性占位,胰头部2例(28.5%,2/7),胰体部2例(28.5%,2/7),胰尾部2例(28.5%,2/7),胰腺头部-体部交界处1例(14.5%,1/7);瘤体平均直径为1.37cm(0.4~2.3cm)。肿块表现为圆形或类圆形,特点是内部回声为均匀、边界清楚的低回声或中低回声团块,部分肿块周边可见晕影。其中1例EUS(图1)示:胰头见一稍低密度圆形影,周边有晕影,边界清,有包膜,大小约2.3cm×2.1cm,与门静脉和下腔静脉紧密相连。其FNA术过程顺利,术后经细胞块和免疫组化诊断为血管活性肠肽瘤(图2)。胃部病变2例(12.5%,2/16),平均直径为1.45cm(1.4~1.5cm),病变表现为起源于黏膜或黏膜下层,回声均匀或不均匀的肿物(图3)。直肠病变6例(37.5%,6/16),平均直径0.76cm(0.2~1.5cm),病灶表现为起源于黏膜或黏膜下层,回声均匀的低或弱低回声肿物(图4)。肾上腺病变1例(图5),肿物大小约6.6cm×6.6cm,肿物表现为:左肾上腺有一回声影,内见分隔带,壁厚,回声较高;为明确肿物性质,对该病例行FNA术,穿刺过程中,该患者血压波动较大(从90/60mmHg至200/120mmHg),高度疑为肾上腺嗜铬细胞瘤,术后病理回报为嗜铬细胞瘤(图6),EUS-FNA术后患者无不适反应。
2.3 EUS与 B超、CT对病灶敏感性的比较本组16例病例,与术后病灶大体对比,EUS发现病灶16例,诊断正确15例(93.7%,15/16),腹部病变共10例,9例均行体表B超、腹部CT和EUS检查,B超定位诊断正确3例(30%,3/10),腹部CT诊断正确5例(50%,5/10),EUS诊断正确10例(100%,10/10)。经统计学检验后,结果显示腹部病变EUS和B超诊断正确率的比较差异有统计学意义(P<0.05),EUS和CT诊断正确率的比较差异有统计学意义(P<0.05)。
2.4 病理16例均获得病理组织学检查,病理标本除行常规染色外,并行免疫组织化学检查。FNA获得的组织作常规细胞学涂片、液基细胞学涂片与细胞块检查。常规细胞学涂片:将FNA获得的一部分组织放于载玻片上,经在场的病理医师现场直接涂片2张,迅速用95%乙醇固定、常规染色、封片,在显微镜下观察做初步细胞学诊断。剩余的部分组织将其置于装有细胞保存液的液基瓶中,作液基细胞学及细胞块检查。液基细胞学涂片:取部分液基瓶中的标本,经高精密度滤过膜过滤、分离标本中的杂质,使细胞薄层均匀地分布在载玻片上,经固定后常规染色,在显微镜下观察做细胞学诊断。细胞块检查:将液基瓶中的剩余标本离心,弃上清液;加入10%中性甲醛,震荡后再离心弃上清;常规进行脱水、透明、浸蜡后包埋,最后切片行HE染色及免疫组化染色,在镜下做细胞块诊断。本组2例行FNA检查:1例胰腺头部占位,细胞块方法诊断为胰血管活性肠肽瘤(图7~图9),而传统的细胞学涂片结果仅能证明细胞为良性;1例肾上腺占位,细胞块方法诊断为嗜铬细胞瘤,而传统的细胞学涂片结果仅能证明细胞为良性。主要免疫组化指标为CgA、Syn、Ki-67等。全部病例的免疫组织化学染色结果:突触素(synaptophysin,Syn)阳性率93.7%(15/16),嗜铬蛋白A(chromogranin A,CgA)阳性率87.5%(14/16);Ki-67指数作为分级标准近几年才开展,所以本组只有3位患者被测,其中1例Ki-67为1%,为高级别G3;1例Ki-67约2%,为中低级别G1、G2;1例Ki-67<5%,为中级别G2。
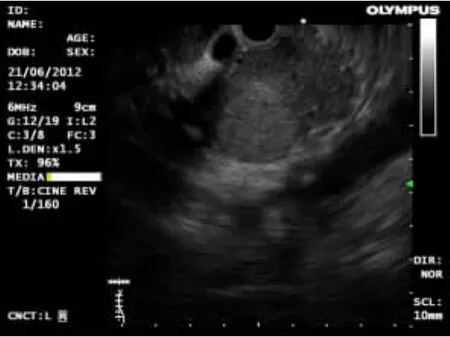
图1 胰腺头部可见一低回声肿物,大小约 2.3cm×2.1 cm
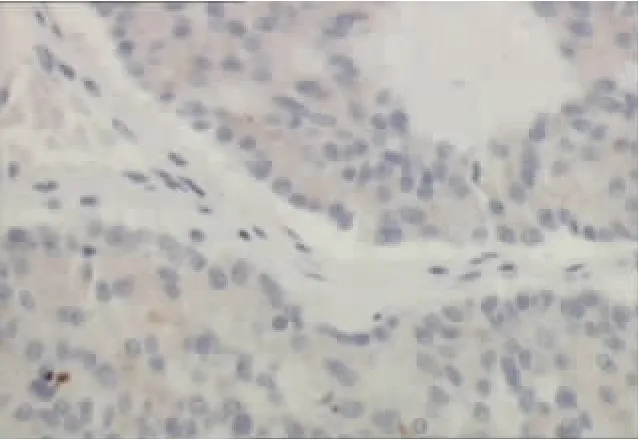
图2 胰腺EUS-FNA免疫组化检测细胞切片内CgA的表达边界清,周围有晕影
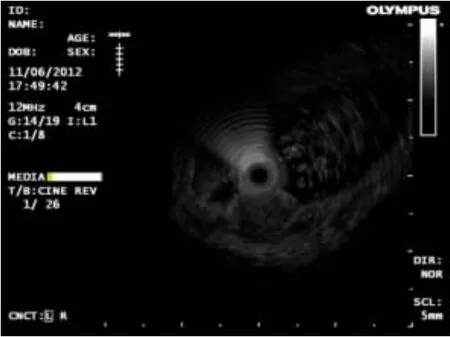
图3 胃窦见一肿物起源于黏膜下层,低回声,内部回声不均匀
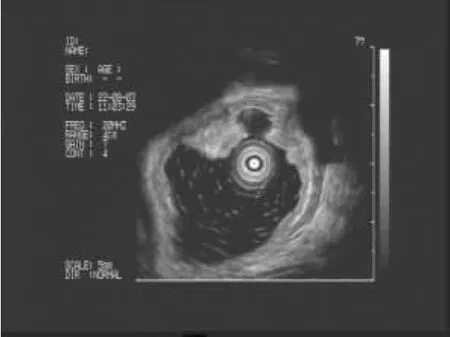
图4 直肠见一黏膜隆起病变,起源于黏膜下层,低回声,回声均匀
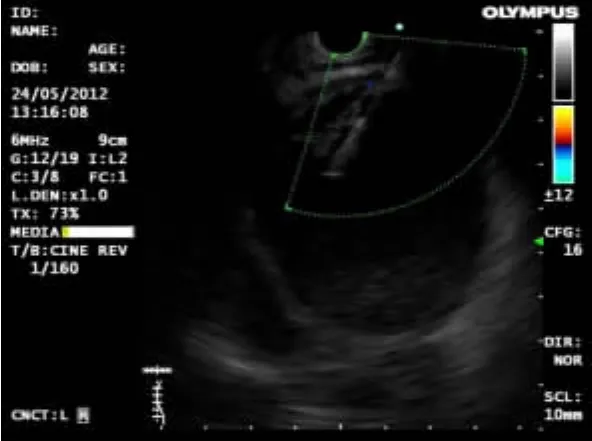
图5 左肾上腺见一无回声影,内见分隔带,壁厚,回声较高
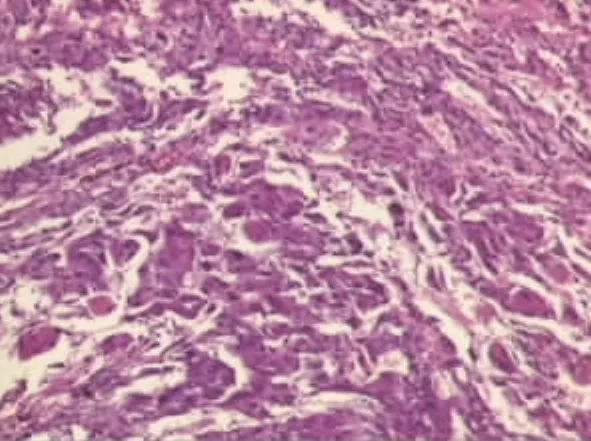
图6 肾上腺瘤体组织(HE×200)
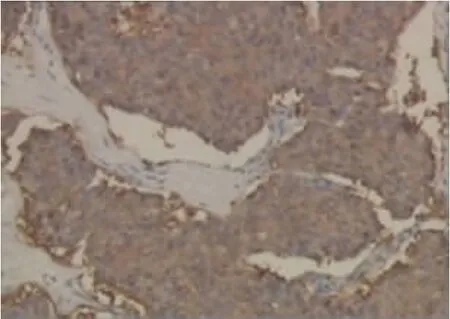
图7 细胞块组织切片免疫细胞组化SYN阳性表达

图9 细胞块组织切片免疫细胞组化ck8-18阳性表达
3 讨 论
消化系统神经内分泌肿瘤(Neuroendocrine tumor,NET)是一组罕见的异质性肿瘤,发病率约占所有胃肠道恶性肿瘤的2%,估计全球年发病率为2.5~5例/10万,女性较男性略多[1]。通常将发生在胃、肠、胰腺的NET统称为胃肠胰腺神经内分泌肿瘤(gastroentero-pancreatic neuroendocrine tumors,GEP-NETs),按肿瘤来源分为类癌和胰腺内分泌肿瘤(pNETs)。
由于胰腺为腹膜后器官,传统的影像学检查方式受脂肪、肠道气体等的影响,不能清晰地观察胰腺,有报道称CT和MRI对于直径小于l cm的瘤体定位成功率不足10%,直径1~3 cm的也在30%~40%[2]。EUS在消化管腔内扫查,能够有效避免肠道气体的影响,通过高频探头超声获得清晰的胰腺二维B超图像,可发现胰腺的细微病变及其毗邻组织的病变。Ishikawa等[3]进行了EUS、CT和腹部超声(US)对PNETs术前定位的比较,对于胰腺头部的病变,EUS、CT、US定位准确率分别为100.0%、86.3%和54.5%,对于胰腺体尾部的病变定位准确率分别为92.5%、77.5%和40.0%。本组研究中,有2例患者B超和CT均未发现病灶,而EUS正确地显示了病变的发生部位,进一步证实了EUS对病变的诊断率高于CT和US。本研究中EUS对胰腺的术前定位准确率达100%,这与操作医师的临床经验及技术水平有很大关系。
FNA可以术前提供病理诊断,近年来已经成为诊断PNETs的重要方法[4]。通过EUS-FNA可直接获得病灶部位的组织,为诊断提供病理学依据。而EUS-FNA细胞学检查中不同的细胞学方法,其诊断结果可能会存在差别[5]。这里,我们将液基细胞学(liquid-based cytology,LBC)和细胞块(cell block,CB)技术运用于EUS-FNA的病理检查中,其诊断准确性、敏感性及特异度均较常规涂片细胞学高。TCT因获得组织后立即将其置入细胞保存液中,最大程度地保留了穿刺针获得的标本,及时固定细胞,使细胞不易固缩变形,异常的细胞容易被发现,与传统细胞学涂片相比,涂片更均匀、更薄,避免了细胞丢失、涂片太厚、细胞重叠等问题,大大提高了涂片阳性检出率[6]。而细胞块的应用弥补了传统细胞学涂片单一的缺点,使细胞标本得到很好的保存,不仅能够显示细胞排列和组织结构,而且可以连续切片做多种抗体染色及免疫细胞化学检测[7]。细胞块联合免疫组化可确定肿瘤的组织学类型及排除诊断,使细胞块诊断准确率提高,高于细胞学涂片的诊断符合率。本组中2例病例,传统细胞学只能从形态学上诊断为良性病变,通过细胞块和组织切片免疫组化才得以进一步明确肿瘤的类型。孙思予等[8]认为,在内镜超声引导下行细针穿刺对左肾上腺病变的诊断有明显优势,由于左肾上腺距胃壁较近,内镜超声采用较高的超声频率以最近的距离对病灶进行扫描,不仅对左肾上腺疾病的影像显示效果明显优于体表超声,而且穿刺路径短,定位准确。本研究中成功穿刺1例左肾上腺占位,并通过FNA抽吸组织的细胞,获得细胞块和免疫组化结果,在手术前作出了准确的诊断。
类癌起源于神经外胚层,能摄取胺和胺前体物质,并在细胞内脱羧产生肽或胺类激素的细胞系统,约60%发生在胃肠道,直肠约占胃肠道类癌的20%~55%[9]。类癌因在临床上无特异性临床症状,普通内镜下呈黏膜隆起性变,有时难以与间质瘤或息肉进行鉴别。而EUS检查能清楚显示消化管壁的层次结构和病变起源部位、大小、浸润深度,以及周围淋巴结有无肿大等,可以指导临床治疗方案,避免盲目内镜下治疗或手术切除。故类癌术前的影像学诊断十分重要,可直接决定切除病灶的手术方式,对位于黏膜肌层及黏膜下层的肿物,其固有肌层完整者可直接通过内镜EMR切除[10]。病灶性质难以鉴别时,还可通过EUS引导下穿刺活检获得病灶组织行病理检查。金捷等[11]认为直肠良性类癌常≤10mm,EUS示黏膜下层完整,无淋巴结血管浸润,恶性类癌多≥20mm,EUS可见累及固有肌层或周围探及淋巴结血管。以往认为手术切除是治疗类癌唯一有效的手段,近年来对≤10mm直肠类癌的内镜下治疗报道不断增多[12,13]。本组6例直肠类癌病灶5例均≤10mm,超声示未累及固有肌层,均(100%,5/5)成功实施内镜下治疗;1例直径约1.5cm,超声示均未浸润固有肌层,拟行ESD,因术中抬起征不明显后转手术治疗,术后病理示良性类癌,所有病例术后病理切缘均未见癌,证实类癌病灶较小时可行内镜下治疗。
综上所述,EUS对消化系统神经内分泌瘤的诊断价值明显优于传统影像检查方法,通过EUS-FNA的细胞块技术结合免疫组织化学检查,可以大大提高神经内分泌瘤的诊断率,值得在临床上推广应用。
[1]Massironi B,Sciola V,Peracchi M,et al.Neuroendocrine tumors of the gastro-entero-pancreatic System[J].World J Gastro.enterol,2008,14(35):5377-5384.
[2]wen NJ,Sohaib SA,Peppereom PD,et al.MRI of pancreatic neuroendocrine lumours[J].Br JRadiol,2001,74(886):968-973.
[3]Ishikawa T,Itoh A,Ka was hima H,et al.Usefulness of EUS combined with contrast.enhancement in the differentialdiagnosis of malignant versus benign and preoperative localization of panereatic endocrine tumors[J].Gastmintest Endosc,2010,71(6):951-959.
[4]Gines A,Vazquez·Sequeiros E,S of ia MT,et al.Usefulness of EUS-gui(kxt fine necxlle aspiration(EUS-FNA)in the diagnosis of functioning neuroemlocrine tumors[J].Gastmintest Endosc,2002,56(2):291,296.
[5]Ardengh JC,Lopes CV,de Lima LF,et al.Cell block technique and cytological smears for the differential diagnosis of pancreatic neoplasms after endosonography-guided fine-needle aspiration[J].Acta Gastroenterol Latinoam,2008,38(4):246-251.
[6]赵 航,湛先保,李兆申,等.内镜超声引导下细针穿刺抽吸术不同处理标本方法对诊断结果的影响[J].中华消化内镜杂志,2009,26(7):344-347.
[7]Kopelman Y,Marmor S,Ashkenazi I,et al.Value of EUSFNA cytological preparations compared with cell block sections in the diagnosis of pancreatic solid tumours[J].Cytopathology,2011,22(3):174-178.
[8]孙思予,王孟春,王彩霞,等.内镜超声引导下细针穿刺活检对左肾上腺无功能肿块的诊断价值[J].中国内镜杂志,2002,11(7):676-678.
[9]Modlin IM,Kidd M,Hinoue T,et al.Molecelar strategies and111 in-labelled somatostatin analogues in defining the management of neuroendocrine tumour disease:a new paradigm for surgicalmanagement[J].The surgeon:journal of Royal Colleges of Surgeons of Edinburgh and Ireland,2003,1(3):137-143.
[10]郭 文,张亚历,张振书,等.内镜超声检查对大肠隆起性病变的诊断价值[J].中华超声影像学杂志,2001,10(7):396-398.
[11]金 捷,潘 杰,翁冬兰,等.超声内镜诊断和指导治疗直肠类癌的价值[J].医学影像学杂志,2012,22(4):604-605.
[12]宗 晔,冀 明,俞 力,等.内镜黏膜切除术治疗直肠类癌的价值评价[J].中华消化内镜杂志,2010,27(7):353-355.
[13]Lee DS,Jeon SW,Park SY,et al.The feasibility of endoscopic submucosal dissection for rectal carcinoid tumors:comparison with endosc opicmucosal resection[J].Endoscopy,2010,42(8):647-651.
