红提葡萄采后贮藏过程中花色苷的动力学研究
2013-05-15张玉丽曹丽琴林江丽王吉德
张玉丽,高 晶,郭 芹,曹丽琴,林江丽,王吉德,吴 斌
(1.新疆大学化学化工学院,新疆乌鲁木齐830046;2.新疆大学理化测试中心,新疆乌鲁木齐830046;3.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐830091)
花色苷是一种天然植物色素,广泛存在于植物的花、叶和果皮中,使其呈现出鲜艳的色泽[1]。红提葡萄是花色苷色素的主要来源,含量一般在30~750mg/100g鲜重,呈宝石红,主要存在于葡萄的果皮中,属于黄酮类化合物,其具有黄酮的C6C3C6结构[2]。红提葡萄果皮中花色苷不但含量高,而且种类多,主要以锦葵素-3-葡萄糖苷为多[3]。葡萄花色苷作为一种天然植物色素,安全、无毒,具有降低肝脏及血清中脂肪含量、抑制癌变、改善视力、美容等生理和药物功能[4],在食品、化妆品和医药等领域具有很大的应用前景。花色苷是葡萄的重要功能成分,与其营养价值及保健功能密切相关,但它对温度、pH、光、氧气、酶、抗坏血酸、糖类、二氧化硫和亚硫酸类、金属离子和辅色素类很敏感,在生产和贮藏中容易发生化学变化而降解或聚合,从而引起在贮藏和加工过程中颜色的劣变,成为影响葡萄品质的主要因素,所以研究红提葡萄花色苷的热稳定性及变化规律极为重要[5]。采用化学反应动力学原理来建立食品颜色变化与贮藏期关系数学模型的报道有很多[6-10],该方法简便可行,只需测定2个以上较高温度下颜色变化的数据,经计算可以得到颜色变化的数学模型,将贮藏温度代入到这个模型中,就可以预测和颜色相关的贮藏期或货架期。本实验通过研究葡萄花色苷的热稳定性,推导其热降解的动力学方程,初步建立了红提葡萄热降解的动力学模型,为有效控制葡萄花色苷的降解和延长贮藏期提供理论依据。
1 材料与方法
1.1 材料与仪器
红提葡萄 采自新疆昌吉三平农场,果实大小和成熟度均一,葡萄果实分为两批分别置于室温(23±1)℃和冷藏(0±1)℃条件下贮藏,每隔一段时期,取不同贮藏温度下的果实,将果皮和果肉剥离后,迅速用液氮冷冻,置于-80℃的超低温冰箱中备用;盐酸、甲醇、氯化钾、醋酸钠 均为分析纯,天津基准化学试剂有限公司。
DK-8D型恒温水浴锅 北京市永光明医疗仪器厂;UV2550型紫外分光光度计 日本岛津仪器有限公司;pHs-3B型pH计 上海精密科学仪器有限公司;RE-52型旋转蒸发仪 上海越磁电子科技有限公司。
1.2 实验方法
1.2.1 花色苷的提取及纯化 红提葡萄花色苷的提取方法参考Cemeroglu[11],略加改动。分别称取不同贮藏时间(或不同贮藏温度)的葡萄皮5g,加入0.1%的50mL的盐酸/甲醇溶液,置于暗处过夜,经滤纸过滤后在30℃条件下减压旋转蒸发,大约浓缩为原体积的1/5。浓缩液经滤纸过滤。滤液用离子交换树脂XAD-7(6.0cm×40cm,Sigma)过柱。柱子首先用蒸馏水洗脱,然后用0.1%盐酸/甲醇溶液洗脱。洗脱液经减压旋转蒸发仪浓缩后,得到花色苷粗提液。
1.2.2 花色苷的热降解研究 红提葡萄花色苷热降解动力学研究是在50、60、70和80℃的恒温条件下进行的,方法参考Kechinski[12]和Nayak[13]。取2mL的花色苷粗提液用蒸馏水定容至50mL,取上述溶液2mL,依次置于具塞试管中,然后放入恒温水浴锅中,水浴温度分别为50、60、70和80℃(±1℃),每隔1h从不同温度的水浴锅中取出一个样,然后迅速用冰水冷却。该分析方法是建立在固定时间间隔上,并且要求实验操作迅速准确。
1.2.3 花色苷含量的测定 红提葡萄总花色苷含量的测定采用pH示差法[14]。首先取0.5mL的样品液,分别加入4.5mL 0.025mol/L的KCl(pH1.0)缓冲溶液,4.5mL 0.4mol/L的NaCOOH(pH4.5缓冲溶液),室温下平衡20min。然后用紫外UV2550测其在510nm和700nm下的吸光度值。总花色苷的含量(以锦葵素-3-葡萄糖苷计)计算参考如下公式:
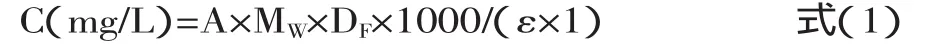
式 中,A=(A510-A700)pH1.0-(A510-A700)pH4.5;MW(锦葵素-3-葡萄糖苷分子量)=528.9;DF=稀释因子,此处为25;比色皿通径(1cm);ε=26,900(L/mol/cm,锦葵素-3-葡萄糖苷的摩尔消光系数)。所有处理平行测定3次。
1.2.4 贮藏期花色苷含量的测定 分别取不同贮藏天数下室温(23±1)℃和冷藏(0±1)℃处理的葡萄果皮5g,参照上述方法1.2.1进行提取和纯化可得花色苷的粗提液,采用pH示差法测定按1.2.3贮藏期内两种温度处理粗提液中花色苷的含量。
1.2.5 降解动力学研究 降解动力学的研究参考王和许的实验方法[15],花色苷类的降解大都属于一级动力学反应,动力学模型可用如下公式表示:

式中:C0为花色苷的初始浓度,Ct为特定温度下一定加热时间后花色苷的浓度,k为一级动力学反应速率常数,t1/2为反应半衰期。
随温度变化的降解速率常数用阿伦尼乌斯方程表示为:

式中,k0是指前因子,对于指定的反应,k0与反应温度和浓度无关,Ea为活化能(J/mol),R是气体常数(8.314J/mol/K),T是绝对温度(k)。
Q10(温度系数)是评价温度对反应速率影响作用的一种方法,它表示温度每升高10℃时对应的反应速率的增加量,计算公式如下:

1.2.6 数据分析 实验数据使用SPSS 18.0进行统计分析,用Sigmaplot 10.0绘图。
2 结果与讨论
2.1 贮藏期花色苷的稳定性
贮藏温度对花色苷降解速率的影响如图1所示。结果表明贮藏温度和时间对样品中花色苷的降解有着重要的影响,其表现为随着贮藏时间的增加花色苷总量有所减少,然而在相同的贮藏时间下,温度则起着至关重要的作用。高温不利于花色苷的保存,由此我们推测高温可以加快花色苷的降解。正如Kirca报道[16],贮藏温度对胡萝卜汁和浓缩液中花色苷的降解有着重要的影响,在4~37℃的温度范围内,降解速率随温度的升高而增大。因此,在长期贮藏时采用低温可以降低花色苷的降解。目前许多鲜食水果的保鲜已经采用了该种方法。

图1 不同贮藏温度下花色苷含量变化Fig.1 The content of anthocyanins at different storage temperature
2.2 加热期花色苷的稳定性
加热期红提葡萄花色苷的含量随时间的变化如图2所示,可以看出高温处理时葡萄花色苷的稳定性很差。花色苷的含量随着热处理时间的延长而迅速下降,且热处理的温度越高,葡萄花色苷降解的速率越快。其原因可能是当温度升高时,葡萄汁被浓缩导致参加反应的分子彼此间的距离变小,由此化学反应速率增大,或者热处理方式导致复合物分解出花色苷基元,其为无色的半缩醛水合物,从而引起花色苷含量的降低。早期草莓和樱桃[17]花色苷热降解的实验已经证实了相似的结论。在50、60、70、80℃水浴热处理后,葡萄花色苷的含量残留率分别为72.31%、62.08%、55.87%和47.5%。

图2 不同温度下花色苷的含量与时间的关系Fig.2 The relationship between content and time at different temperature
2.3 花色苷的降解速率及反应级数
不同温度下花色苷的含量随加热时间变化的关系如图2所示,通过此图我们可以得到-ln(C/C0)和加热时间(Time)的线性关系,如图3所示。花色苷含量随着热处理时间的增加而降低,同时也取决于热处理的方式,温度越高,降解越快。四种不同温度下的线性回归方程如表1所示,其相关系数线性关系良好(R2>0.99)。分析该图可得红提葡萄花色苷的热降解遵循一级动力学反应,即-ln(C/C0)与时间(t)呈线性关系,与先前其他水果热处理得出的结论相符[18]。

图3 不同温度下-ln(C/C0)与时间的关系Fig.3 The relationship between-ln(C/C0) and time at different temperature
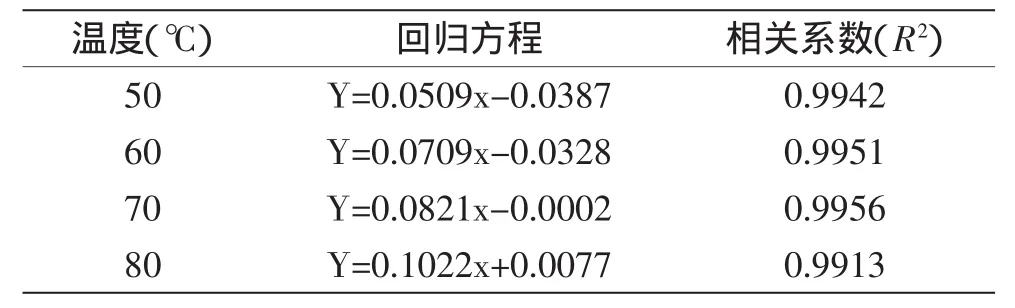
表1 不同温度下线性回归方程Table 1 The equation of linear regression at different temperature
2.4 花色苷降解反应的半衰期及活化能
由式(2)可得出不同温度下的热降解反应常数k,将Arrhenius经验公式左右两边同取对数可得lnk=lnk0-E0/RT,据上式对花色苷一级反应速率常数的对数lnk与贮藏温度的倒数1/T作图,如图4所示,由式(4)可得,直线的斜率为-Ea/RT,截距为-lnk0,从而可求出在50、60、70、80℃条件下,活化能(Ea)为21.29kJ/mol,指前因子k0为145.24。
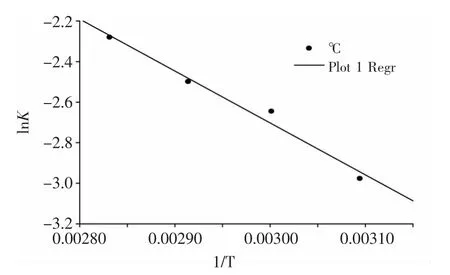
图4 花色苷降解的Arrhenius关系曲线Fig.4 Degradation of anthocyanins Arrhenius relationship curve
热处理得到的葡萄花色苷降解动力学参数如表2,由一级动力学反应速率常数k值和t1/2表示。其表明k随着温度的升高而增加,与温度越高,降解越快规律相符。在所选实验温度范围内,半衰期t1/2值为13.62h降到6.79h。王和许[15]曾报道黑莓果汁花色苷在60、70、80、90℃条件下降解的半衰期分别为16.7、8.8、4.7、2.9h。将红提葡萄花色苷与黑莓花色苷相比,可以看出在相对较高的温度下(70/80℃),半衰期值大小相似,但在60℃时有所差异,红提葡萄为9.78h而黑莓花色苷则为16.7h,表明红提葡萄对热处理更为敏感。由此可以说明,不同果实花色苷对热处理敏感性的差异与花色苷的结构组成和相互作用有关。

表2 温度对红提葡萄花色苷降解的影响(k,t1/2,E0和k0)Table 2 The temperature effection on anthocyanins degradation of red globe grape(k,t1/2,E0and k0)
通常认为化学反应的活化能在40~400kJ/mol范围内,活化能值越小,反应越容易进行[19]。当值低于42kJ/mol时,反应速率非常大;相反,当值高于400kJ/mol时,化学反应速率会很小。通过该实验得出红提葡萄花色苷的活化能为21.29kJ/mol,与活化能越低对温度变化越敏感规律相符,因此可说明红提葡萄容易发生热降解反应。
表3为在温度变化时对应的Q10值,最大值出现在温度由50℃变化到60℃时,表明在此变化范围内,由于温度增加而引起的降解速率变化量最大,在70~80℃时,亦可看出相似的效应,但影响相对较小。据Al-Zubaidy和Khalil研究[21],Q10值高可能是由于温度升高时分子撞击的速率变大,由此而引起的速率变化量较大。

表3 温度对红提葡萄花色苷降解Q10值的影响Table 3 Effect of temperature on Q10values of anthocyanins degradation in red globe grape
2.5 贮藏期花色苷热降解的动力学模型
根据贮藏期内花色苷含量的变化,将式(2)和式(4)分别取对数后可得红提葡萄在贮藏期内花色苷降解的一级动力学反应方程,即:

再将活化能E0,反应初始速率k0及气体反应常数R带入式(6)可得式(7):

式(7)即为红提葡萄花色苷热降解的动力学模型,通过初始浓度和最终浓度可以计算贮藏时间,也可通过贮藏时间计算花色苷剩余量。
2.6 动力学模型的验证
用式(7)分别预测65℃和75℃下热处理5h后的葡萄花色苷含量的保留值。将葡萄花色苷在上述温度处理5h后测定花色苷保留量,结果如表4所示,由表4可以看出该模型具有较高的准确性。

表4 动力学模型验证结果Table 4 The dynamics model verification results
3 结论
通过对红提葡萄贮藏期内花色苷降解动力学的研究,得出其热降解符合一级动力学反应,降解速率随温度的变化遵循符合阿伦尼乌斯定律。贮藏温度对降解速率影响很大,短时间热处理和低贮藏温度有益于维持红提葡萄花色苷的稳定性。但贮藏期红提葡萄花色苷的降解动力学模型是在忽略光和氧影响的条件下获得的,为了使该模型更为精准,可补充光和氧对花色苷降解模型影响的研究。
[1]张学英,张上隆,骆军,等.果实花色素苷合成研究进展[J].果树学报,2004,24(5):456-460.
[2]唐传核,彭志英.天然花色苷类色素的生理功能及应用前景[J].食品添加剂,2001(1):26-28.
[3]吴斌,张玉丽,程琳琳,等.鲜食葡萄花色苷的研究进展[J].现代食品科技,2012,28(4):441-444.
[4]吕忠进.天然食用色素的开发现状及研究进展[J].江苏食品与发酵,1993(1):23-24.
[5]孙建霞,张燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[6]李新华,牟杰,张超,等.紫马铃薯皮中花色苷热降解动力学的研究[J].沈阳农业大学学报,2009,40(2):202-205
[7]郭庆启,张娜.树莓果汁中花色苷降解动力学的研究[J].中国林副特产,2011,10(5):35-37.
[8]张素敏,隋洪涛,隋韶奕.葡萄花色苷的研究进展及应用前景[J].北方果树,2007(3):1-3.
[9]Cisse M,Vaillant F,Acosta O,et al.Thermal degradation kinetics of anthocyaninsfrom blood orange,blackberry,and roselle using the Arrhenius,Eyring,and Ball models[J].Journal of Agricultural and Food Chemistry,2009,57(14):6285-6291.
[10]Aguirre M J,Isaacs M,Matsuhiro B,et al.Anthocyanin composition in aged Chilean Cabernet Sauvignon red wines[J].Food Chemistry,2011,129(2):514-519.
[11]Cemeroglu B,Velioglu S,Isik S.Degradation kinetics of anthocyanins in sour cherry juice and concentrate[J].Journal of Food Science,1994,59(6):1216-1218.
[12]Kechinski C P,Guimarães P V R,Noreña C P Z,et al.Degradation kinetics of anthocyanin in blueberry juice during thermal treatment[J].Journal of Food Science,2010,75(2):C173-C176.
[13]Nayak B,Berrios J D J,Powers J R,et al.Thermal degradation of anthocyanins from purple potato(purple majesty CV) and impact on antioxidant capacity[J].Journal of Agricultural and Food Chemistry,2011,59(20):11040-11049.
[14]刘洪海,张晓丽,杜平,等.pH示差法测定烟73葡萄中花青素含量[J].中调味品,2009,39(5):110-111,117.
[15]Wang W D,Xu SY.Degradation kinetics of anthocyanins in blackberry juice and concentrate [J]. Journal of Food Engineering,2007,82(3):271-275.
[16]Kırca A,Özkan M,Cemerogˇlu B.Effects of temperature,solid content and pH on the stability of black carrot anthocyanins[J].Food Chemistry,2007,101(1):212-218.
[17]ÖZkan M,Yemenicioglu A,Asefi N,et al.Degradation kinetics of anthocyanins from sour cherry,pomegranate,and strawberry juices by hydrogen peroxide[J].Journal of Food Science,2002,67(2),525-529.
[18]郭庆启,张娜,何娇,等.蓝靛果汁花色苷热降解动力学的研究[J].食品与发酵工业,2011,37(9):74-78.
[19]郭松年,董周永,孙海燕,等.石榴汁花色苷热稳定性及其降解动力学研究[J].农业工程学报,2008,24(3):256-259.
[20]王梦泽,阎勤劳,薛少平,等.草莓浑浊汁花色苷热降解动力学[J].食品开发与研究,2010,31(6):50-52.
[21]Al-Zubaidy MMI,Khalil RA.Kinetic and prediction studies of ascorbic acid degradation in normal and concentrate local lemon juice during storage[J].Food Chemistry,2007,101(1):254-259.
