高密度二氧化碳对牛背最长肌颜色稳定性的影响
2013-05-15张巧娜杨红菊高晓光戴瑞彤
张巧娜,杨红菊,高晓光,戴瑞彤,*
(1.中国农业大学食品科学与营养工程学院,北京100083;2.中国动物疫病预防控制中心,北京100107)
高密度二氧化碳技术(DensePhaseCarbonDioxide,DPCD)的基本原理是在一定的温度、压力和时间条件下,给予处于密闭处理釜的物料高压CO2处理,形成高压、高酸环境,从而杀死物料中的微生物、钝化内源酶[1],达到延长贮藏期和改良物料品质的目的。
近些年来,DPCD作为一种新型冷杀菌技术备受青睐,很多研究结果也证实了DPCD具有显著的杀菌效果,但是处理对肉的色泽造成了不利的影响[2]。肉的色泽主要与肌红蛋白(Mb)有关,Mb有三种化学存在形式:还原型肌红蛋白(DeoMb,暗紫色)、氧合型肌红蛋白(OxyMb,鲜红色)和高铁型肌红蛋白(MetMb,棕褐色)。在一定的条件下,这三种形式的Mb在一定条件下可以相互转化。姚中峰等[3]研究DPCD处理能使肉由红色逐渐变成灰棕色,显著提高L*值(p<0.05)、降低a*值(p<0.01),并且4℃冷藏7d后,与对照组相比,DPCD处理能提高肌红蛋白的稳定性。在贮藏期间,MetMb会逐渐积累,肉色变褐,由于屠宰后肉内存在的各种酶系还没有失活,肌肉内还在进行着一系列生理生化的反应,这些都会影响肉品色泽及Mb的含量与状态。戴瑞彤[4]通过对MetMb还原酶与冷却肉色泽稳定性之间的关系研究发现,肌肉中MRA越高,肉的色泽越稳定。有文献[5]报道线粒体活性高,呼吸耗氧上升,进而降低了氧分压,促使OxyMb脱氧形成DeoMb,DeoMb稳定性差,更易被氧化成MetMb,使肉色变褐,影响了肉的颜色稳定性。本文通过研究DPCD处理对Mb、MRA、线粒体呼吸及相关其酶系活性等指标的影响,旨在探究经DPCD处理后这些指标的变化与颜色稳定性的关系。
1 材料与方法
1.1 材料与仪器
屠宰后经24h冷却的牛背最长肌 北京御香苑公司;马心肌红蛋白、琥珀酸、还原型辅酶I(NADH)、吩嗪二甲酯硫酸盐(PMS)、2,6-二氯酚靛酚(DCPIP)
美国Sigma公司;牛血清白蛋白(BSA) 拜尔迪生物有限公司;蔗糖、Tris-Base、乙二胺四乙酸(EDTA)等 北京蓝弋试剂公司,均为分析纯;CO2气体(纯度99.9%) 北京分析仪器公司。
WBN-5/50型高密度二氧化碳杀菌器 温州贝诺机械有限公司;FA25型均质机 上海弗鲁克流体机械制造有限公司;TGL20M型台式高速冷冻离心机 盐城市凯特实验仪器有限公司;CR400型色差仪 日本柯尼卡-美能达公司;Evolution 60S型紫外可见分光光度计 Thermo Fisher;OXYGRAPH型液相氧电极 英国汉莎(Hansatech)公司。
1.2 实验方法
1.2.1 DPCD处理 开机预热DPCD设备30min,开启风箱使得冷冻机组冷却水箱温度降低到-5℃左右,每次实验前在操作控制面板上分别设定处理压力(7、14、21、28、35MPa),开启恒温水浴循环系统,处理釜温度升温至25℃并保持稳定。
取屠宰后经24h冷却的背最长肌。在无菌操作条件下,去掉牛背最长肌的筋膜及可见的脂肪,切成5cm×3cm×1cm的肉片,摆在镂空肉架上置于处理釜中,密封后泵入CO2,经过5~10min的升压过程达到设定压力,保持恒压20min。处理时间达到后,取出样品,真空包装后放于0~4℃冰箱备用。
1.2.2 色泽的测定 取肉样,用手持色差仪直接测量色泽,每组样品选取5~8个点进行测量。
1.2.3 肌红蛋白含量的测定 采用Tang[6]的方法,用分光光度计法进行MetMb相对百分含量的测定。
1.2.4 高铁肌红蛋白还原酶活性(MRA)的测定
1.2.4.1 样品中MetMb还原酶粗酶液的提取 高铁肌红蛋白还原酶活力的测定,按照Mikkelsen的方法[7],稍有改动。取肉样10g加入20mL 4℃磷酸盐缓冲液(2.0mmol/L,pH7.0),4℃下均质1min,均质液在4℃下,10000r/min离心20min,上清液经滤纸过滤除去脂肪,滤液中OxyMb用稍过量的高铁氰化钾氧化后,再用冰的磷酸盐缓冲液(2.0mmol/L,pH7.0),4℃下透析24h,期间换液三次,透析完毕后,12000r/min离心20min(4℃),取上清液作为MetMb还原酶粗酶液。
1.2.4.2 MRA的测定 还原酶的活性用分光光度法测定。配制标准反应混合物,成分见表1(pH6.4,温度为25℃),空白对照以水代替NADH,其他组分不变。反应由加入NADH起始,用紫外可见分光光度计记录波长580nm的吸光值。依照Mikkelsen的方法[7],MetMb还原酶的活性用每毫升提取液在1min内580nm下吸光值变化来表示。在此波长下OxyMb与MetMb的吸光值相差最大,两者的摩尔消光系数为12×103L·mol-1·cm-1。通过反应前后(在反应线性阶段)光吸收值的变化,便可计算出MRA活性。每个样品重复三次,取平均值。

表1 高铁肌红蛋白还原酶活力测定的标准反应混合物Fig.1 Reaction substances of metmyoglobin reductase activity
1.2.5 线粒体的提取 线粒体的提取参考Zhu[8]的方法。
1.2.6 琥珀酸脱氢酶(SDH)活力的测定 参照文献[9]的方法,配制标准反应物,成分如表2所示,反应温度为25℃,对照组以去离子水代替琥珀酸钠溶液,其他组分不变。用去离子水校零,测定反应溶液在600nm处的吸光值。加完反应溶液,立即混合均匀并开始计时,持续记录5min的A600,以获得适当的反应速率。每个样品的酶活力测定重复三次,取平均值。SDH活力的计算公式如下:
SDH活性单位:1U=A600/min=ΔA600/(Δt×0.01)
SDH的比活力[U/(mg蛋白质·min)]=ΔA600/(Δt×0.01)/蛋白质浓度(mg/mL)/0.2×3.0
式中,ΔA600:反应直线段吸光值的改变量;Δt:直线段反应时间(min)。

表2 琥珀酸脱氢酶活力测定的反应物组分Fig.2 Reaction substances of succinic dehydrogenase activity
1.2.7 耗氧率(OCR)的测定 耗氧率的测定依据Kaplan的方法[10],稍有改动。首先分别在4℃和25℃校正氧电极,用高浓度、现用现配的连二亚硫酸钠校正零氧线,然后用去离子水清洗反应室12次以上。再用OC缓冲液(70mmol/L蔗糖、0.002mmol/L EDTA、20mmol/L Tris-HCl、5mmol/L K2HPO4,pH7.4)冲洗几次,向反应室中加入1mL OC缓冲液,盖好反应室盖子。开启转子,开始记录氧含量,等待2min使氧含量平稳。取肉样5g绞碎混匀在50mL去离子水中,测试时加入1mL肉样液加入反应室,立即计时,记录5min内的呼吸速率,即为肉的OCR(nmol/(g meat·min)。
1.2.8 统计分析 采用SPSS 17.0数据分析软件进行单因素方差分析(ANOVA)分析;数据结果以平均值±标准差进行记录,显著性水平p<0.05。
2 结果与讨论
2.1 DPCD处理对色泽的影响
从表3中看出,随着压力的升高,L*值大体呈上升趋势,原因可能是压力的升高,一方面使肉表面纤维结构更疏松、汁液溶出量增加;另一方面高压使CO2扩散进入肉中后,与水结合形成H2CO3并部分水解成H+和HCO3-,使肉的pH降低,蛋白质发生变性和凝集程度增加,肉的保水性下降进而造成更多的水分损失,损失的水分附着在肉的表面使肉的亮度值增加[11]。DPCD处理对a*值有显著影响(表4),随着压力的升高,a*值呈下降趋势,Choi等[2]认为a*下降的原因是肌浆蛋白中的蛋白变性对肉的红度起到遮掩作用,因此影响了肉的红度值和亮度值。随着贮藏时间的延长,L*值上升,a*值下降,可能是由高铁肌红蛋白的积累所导致。对照组中L*值和a*值变化的幅度显著大于处理组,可以得出DPCD处理保持了L*和a*的稳定性。DPCD处理虽对牛肉的色泽造成了影响,但却提高了牛肉在贮藏期间的颜色稳定性。
2.2 DPCD处理对肌红蛋白含量的影响
由表5~表7可知,随着压力的升高,DeoMb和OxyMb的含量下降,MetMb的含量上升,原因可能是随着压力的升高,CO2浓度升高,排出的O2越多,造成氧分压降低。低氧分压会导致Mb部分变性,从而使其失去保护血红素的生理功能[12],失去了保护的Fe2+就会自动氧化成Fe3+,生成褐色的MetMb。MetMb含量与a*成负相关性,这与Carlez等的研究结果是一致的[13]。在贮藏期间,可以明显的看出处理组尤其是压力高的处理组中的三种形式Mb含量的变化速度显著低于对照组,从而可以得出DPCD处理使DeoMb、MbO2和MetMb的含量相对趋于稳定,说明DPCD处理过程中CO2压力的提高能增大肌红蛋白三种氧化还原状态的稳定性,从而也增大了牛肉色泽的稳定性。
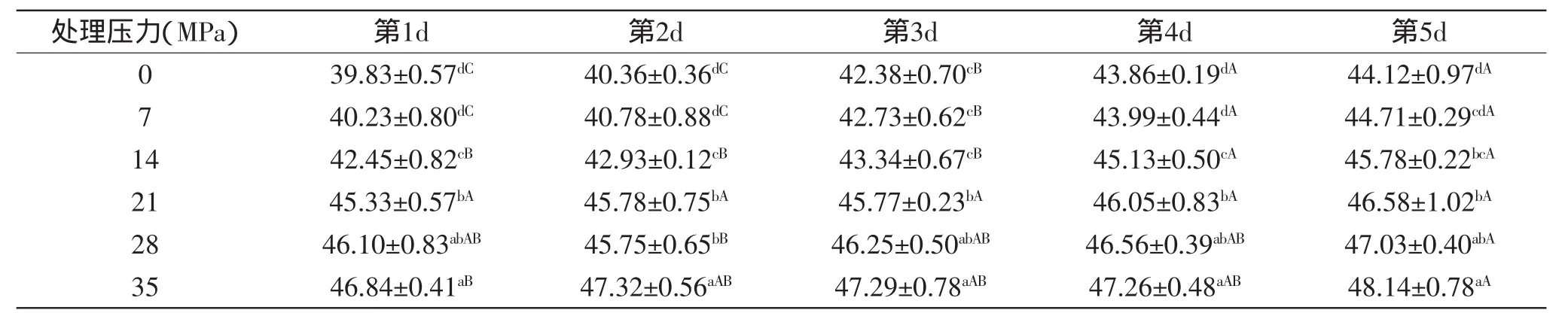
表3 DPCD处理对牛肉及贮藏期间亮度值L*值的影响Table 3 Effect of DPCD treatment on L*value of chilled beef during storage

表4 DPCD处理对牛肉及贮藏期间红度值a*值的影响Table 4 Effect of DPCD treatment on a*value of chilled beef during storage
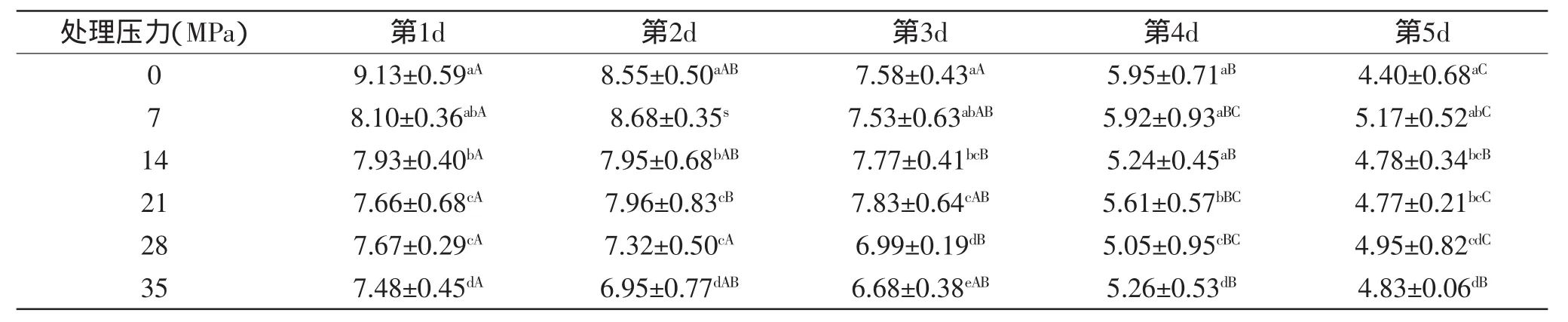
表5 DPCD处理对牛肉及贮藏期间DeoMb含量百分比的影响(%)Table 5 Effect of DPCD treatment on DeoMb content percentage of chilled beef during storage(%)

表6 DPCD处理对牛肉及贮藏期间OxyMb含量百分比的影响(%)Table 6 Effect of DPCD treatment on OxyMb content percentage of chilled beef during storage

表7 DPCD处理对牛肉及贮藏期间MetMb含量的影响(%)Table 7 Effect of DPCD treatment on MetMb content percentage of chilled beef during storage(%)

表8 DPCD处理对牛肉及贮藏期间MetMb还原酶活性的影响(nmolMMb reduced/min)Table 8 Effect of DPCD treatment on MetMb reductase activity of chilled beef during storage(nmolMMb reduced/min)
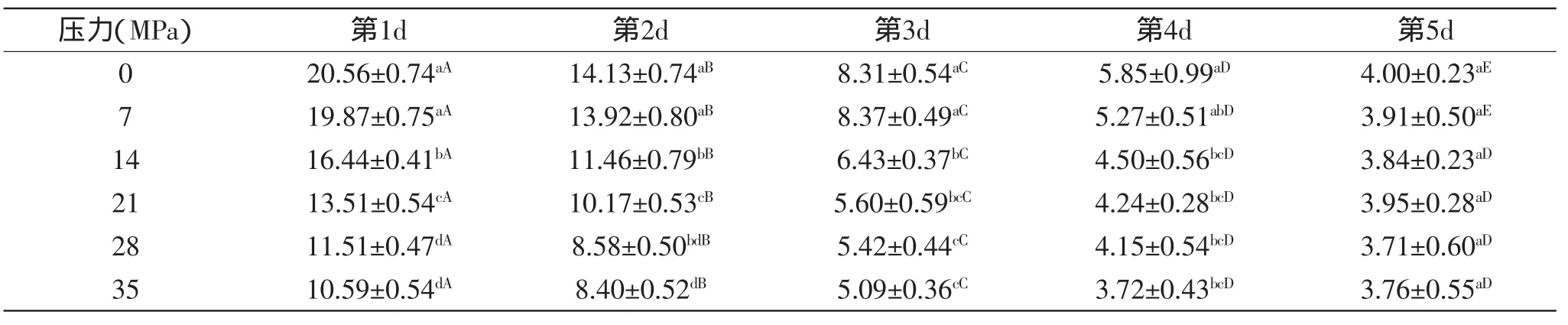
表9 DPCD处理对牛肉及贮藏期间琥珀酸脱氢酶活性的影响(U/(mg pro·min))Table 9Effect of DPCD treatment on succinate dehydrogenase activity of chilled beef during storage(U/(mg pro·min))
2.3 DPCD处理对MRA活性的影响
由表8看出,随着压力的升高,MRA活性下降。但是7MPa处理组与对照组并没有显著差异,而当压力大于14MPa的各处理组,与对照组相比酶活性显著降低(p<0.05),这可能是由于肉的pH较低所致,Zhu等[14]报道pH显著影响MetMb的还原作用,尤其是当pH<6时,低pH降低了MRA的还原能力。随着时间的延长,MRA逐渐降低。有文献报道,MetMb还原酶在冷藏的一定阶段对肉色的稳定性起主导作用,在冷藏的前3d,肉色可能主要由氧分压、OCR及MetMb还原酶等联合控制;在第3~7d,MetMb还原酶起主导作用[15]。
2.4 DPCD处理对SDH活性的影响
SDH是反映线粒体功能的标志酶之一,其活性一般可作为评价线粒体活性的指标。由表9看出,随着压力的升高,SDH的活性降低。原因可能有:一方面,随着压力的增大,肉的pH下降,低pH影响线粒体的结构和活性;另一方面,压力对线粒体结构造成一定的物理性伤害。许多学者[16-17]都提出了低pH是造成线粒体结构完整性和功能性下降的主要原因。本实验中,随着贮藏时间的延长,对照组和处理组线粒体的活性都呈下降的趋势,Tang[18]研究了牛心肌线粒体的完整性和活性,在电镜下观察发现宰后2h线粒体保持结构的完整;96h后,大多出现碎片,大液泡使线粒体肿大,形态不再完整。在本实验中,对照组中牛肉的色泽稳定性低于处理组,表8中的数据正好支持了色泽稳定性差的而线粒体活性高的结论。
2.5 DPCD处理对OCR的影响
由表10可以看出,随着压力的升高,耗氧率下降。随着贮藏时间的延长,对照组和处理组的耗氧率都呈下降的趋势,这与Lanari[19]在文献中的报道是一致的:在贮藏期间,耗氧率随时间的变化是显著的(p<0.05)。经过DPCD处理的牛肉在贮藏期间颜色稳定性好于对照组,其耗氧率低于对照组,即呼吸强度高的肉颜色稳定性差。O’Keeffe等[20]得出OCR与MetMb的积累速度呈显著正相关;线粒体活性高,呼吸耗氧上升,进而降低了氧分压,促使OxyMb脱氧形成DeoMb,DeoMb稳定性差,更易被氧化成MetMb,使肉色变褐,进而缩短了肉的颜色货架期[5]。

表10 DPCD处理对牛肉及贮藏期间耗氧率的影响(nmol/(g meat·min))Table 10Effect of DPCD treatment on oxygen consumption rate of chilled beef during storage(nmol/(g meat·min))
3 结论
本实验研究了DPCD处理对牛肉的颜色稳定性的影响。随着压力的提高,a*、OxyMb含量、高铁肌红蛋白还原酶活、琥珀酸脱氢酶活、耗氧率降低,L*、MetMb含量升高。可见DPCD处理对牛肉的色泽造成了不利的影响,使肉红度值降低,但是DPCD处理却提高了牛肉在贮藏期间的颜色稳定性。因此若想在肉品工业生产中推广这一技术,降低DPCD处理对肉色的影响,需要采取护色技术,防止其对颜色的不利影响。
[1]Damar S,Blaban M O.Review of dense phase CO2technology:microbiol and enzyme inactivation,and effects on food quality[J].Food Science,2006,71(1):1-11.
[2]Choi Y M,Ryu Y C,Lee S H,et al.Effects of supercritical carbon dioxide treatment for sterilization purpose on meat quality ofporcine longissimusdorsimuscle[J].Food Science and Technology,2008,41(2):317-322.
[3]姚中峰,李兴民,刘洁洁,等.高压二氧化碳处理对牛通脊颜色和肌红蛋白的影响[J].食品工业科技,2012(4):142-145.
[4]戴瑞彤.冷却牛肉表面变色现象的控制及其机理研究[D].北京:中国农业大学,2002.
[5]Lanari M C,Zaritzky N E.Potassium sorbate effect on pigment concentration of refrigerated beef[J].Journal of Food Science,1988,53:1621.
[6]Tang J,Faustman C,Hoagland T A.Krzywicki Revisited:Equations for Spectrophotometric Determination of Myoglobin Redox Forms in Aqueous Meat Extracts[J].Food Chemistry and Toxicology,2004,69:717-720.
[7]Mikkelsen A,Juncher D,Skibsted L H.Metmyoglobin reductase activity in porcine m longissimus dorsi muscle[J].Meat Science,1999,51(2):155-161.
[8]Zhu J,Liu F,Li X,et al.Effect of succinate sodium on the Metmyoglobin reduction and color stability of beef patties[J].Journal of Agricultural and Food Chemistry,2009,57(12):5976-5981.
[9]王月云,陈是莹,童武夫.植物生理学实验[M].台北:艺轩图书出版社,1994:135-138.
[10]Ann E,Kaplan B.Metmyoglobin Oxidation during Electron Transport Reactions in Mitochondria[J].JournalofGeneral Physiology,1965,48(4):685-698.
[11]史智佳,成晓瑜,陈文华.高压二氧化碳对冷却猪肉品质的影响[J].肉类研究,2009,10(12):28-30.
[12]Seideman S C.Factors associated with fresh meat color:a review[J].Journal of Food Quality,1984,6:211.
[13]Carlez A,Veciana-Nogues T,Cheftel J.Changes in Color and Myoglobin of Minced Beef Meat Due to High Pressure Processing[J].LWT-Food Science and Technology,1995,28(5):528-538.
[14]Zhu L G,Brewer M S.Effects of urea denaturation and pH on the ability of porcine myoglobin to undergo reduction[J].Meat Science,2003,63:427-432.
[15]汤祥明.高铁肌红蛋白还原酶活力与肉色稳定性的研究[D].南京:南京师范大学,2006.
[16]Ashmore C R,Parker W,Doerr L.Respiration of mitochondria from dark-cutting beef:postmortem changes[J].Journal of Animal Science,1972,34:46.
[17]Cheah K S,Cheah A M.Properties of mitochondria from ox neck muscle after storage in situ[J].International Journal of Biochemistry,1974,5(9-10):753-760.
[18]Tang J L,Faustman C.Postmortem Oxygen Consumption by Mitochondria and Its Effects on Myoglobin Form and Stability[J].Journal of Agricultural and Food Chemistry,2005,53:1223-1230.
[19]Lanari M C,Cassens R G.Mitochondrial activity and beef muscle color stability[J].Journal of Food Science,1991,56:1476-1479.
[20]O’Keeffe M,Hood D E.Biochemical factors influencing metmyoglobin formation on beef from muscles of differing color stability[J].Meat Science,1982,7(3):209-228.
