外源乙烯和茉莉酸甲酯对鲜切甘蓝活性氧代谢的影响
2013-05-15胡文忠姜爱丽
马 杰,胡文忠,毕 阳,姜爱丽
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.大连民族学院生命科学学院,辽宁大连116600)
甘蓝富含维生素和微量元素,具有良好的保健功能,与胡萝卜、花椰菜并称为“防癌三剑客”。国外的食用方法主要是将其制成方便、环保的沙拉,供人们休闲娱乐的甜点。但鲜切甘蓝在具有方便性和可食性的同时,却破坏了甘蓝组织的完整性,扰乱了甘蓝的生理代谢。例如,产生大量活性氧分子,对植物造成氧化伤害,加速植物的衰老进程。
目前,国内外已对鲜切果蔬的保鲜方法进行了研究分析,发现热水处理[1]、降低果蔬的贮藏温度[2]以及利用乳酸钙[3]、抗坏血酸[4]及壳聚糖[5]等抗氧化物质处理鲜切果蔬均可通过诱发组织抗性,从而延长生鲜产品的货架期,而乙烯[6]和MeJA作为信号分子在鲜切叶菜类蔬菜上的应用还不多。研究发现,乙烯在植物生长发育许多过程中均起到重要作用,除可调控果实的成熟、种子的萌发外,乙烯还可在应对植物的生物胁迫、非生物胁迫过程中起到重要作用。植物遭受伤害后诱导乙烯合成[7]。研究发现,鲜切苹果的乙烯生成量急剧增加,达到高峰后逐渐下降[8]。1-MCP和1-MCP、乙烯结合处理相比,经过10μL/L乙烯处理可提高鲜切西瓜的呼吸速率,诱导其软化[9]。JAs作为内源信号分子参与植物在机械伤害、病虫害等条件下的抗逆反应,可诱导启动植物体内的抗性防御基因的表达,同时将创伤或伤害的信息传递到植物的其他部位使系统产生抗性,进而调控植物的连锁防御反应[10-11]。除此之外,外源应用JA和MeJA也能激发植物的抗性基因——pin基因的表达,诱导植物发生化学防御[12]。本实验采用外源乙烯和MeJA处理鲜切甘蓝,观察鲜切甘蓝活性氧代谢的变化以及两种信号分子在鲜切甘蓝活性氧代谢中的作用,为进一步完善丰富鲜切果蔬的加工与保鲜技术奠定理论基础。
1 材料与方法
1.1 材料与仪器
甘蓝 购于大连开发区乐购超市,选择叶片新鲜且无机械损伤,无病虫害,颜色、大小基本一致的叶菜做试材,购买后立即运往实验室进行处理;过氧化氢、l-蛋氨酸(MET)、氮蓝四唑(NBT)、磷酸氢二钠、磷酸二氢钠、甲醇、乙二胺四乙酸(EDTA)、盐酸羟胺、对氨基苯磺酸、聚乙烯吡咯烷酮、亚硝酸钾、冰醋酸、核黄素、丙酮、浓氨水、浓硫酸、四氯化钛、浓盐酸、愈创木酚、95%乙醇、硼酸、硼砂、L-苯丙氨酸、EDTA、β-巯基乙醇、乙酰溴、乙烯利、MeJA 分析纯。
Lamda-25型紫外可见分光光度计 美国PE;SIM-F140型制冰机 日本三洋;BR4i型台式高速冷冻离心机 法国Jouan;T-25型匀浆器 德国IKA;电热恒温水浴锅 上海精宏;超低温冰箱 青岛海尔;Mettler-Toledo型电子分析天平 北京瑞利仪器有限公司。
1.2 实验方法
1.2.1 叶菜处理方法 将叶菜用清水清洗后,切割成1cm×2cm条状,将样品于10μL/L乙烯利溶液(相当于4μL/L乙烯,以双蒸水为溶剂)浸泡10min,以双蒸水中浸泡相同时间的样品作对照,沥干后各处理的样品分别装在经过紫外线杀菌的PE塑料浅盘中,25~30μm聚乙烯保鲜膜密封包装。包装好的样品置于4℃的冷库中贮藏,分别于0、1、2、4、8、12h测定各生理生化指标。每处理每指标用样品10g,重复3次。
1.2.2 O2-·产生速率的测定 参照王爱国和罗广华的方法[13]并作修改。取10.0g甘蓝样品,加入10mL 100mmol/L磷酸缓冲液(pH6.4,含0.1%PVPP),在冰浴条件下匀浆后于4℃下10000×g、离心30min。取上清液1.0mL,加入1mL 50mmol/L磷酸缓冲液(pH6.4)和1.0mL 1mmol/L盐酸羟胺溶液,反复摇匀后于25℃条件下保温1h。之后分别加入17mmol/L对氨基苯磺酸溶液1.0mL和7mmol/L α-萘胺溶液1.0mL,混匀后再于25℃保温20min进行显色反应。测定显色液在波长530nm处的OD值,以不进行保温1h的测定为参比空白进行调零。重复三次。结果以μmol/g表示。
1.2.3 H2O2含量的测定 参照Prochazkova的方法[14]并修改。取10.0g甘蓝样品,加入10mL冷丙酮,冰浴匀浆后于4℃下10000×g离心20min。取100μL上清液,加入100μL 20%的四氯化钛溶液(溶于浓盐酸,V/V)和200μL浓氨水,混匀反应5min后离心15min。沉淀部分用冷丙酮洗涤4次以减少色素的干扰,最后将沉淀溶于1.5mL 1mmol/L H2SO4溶液中,于410nm测定溶液的吸光度值。按此法作H2O2标准曲线。H2O2含量以μmol/gFW表示。
1.2.4 SOD活性的测定 参照Oberley and Spitz的方法[15]并修改。取10.0g甘蓝样品,加入10mL 100mmol/L磷酸缓冲液(pH6.4,含5mmol/L二硫苏糖醇(DTT)和1%PVPP),冰浴条件下匀浆后于4℃下、10000×g离心30min,取上清液用于酶活性测定。取5mL指形管4支,2支为测定管,另2支为对照管,依次加入900μL 50mmol/L磷酸缓冲液、1.5mL130mmol/L甲硫氨酸(MET)溶液、0.3mL 750μmol/L氮蓝四唑(NBT)溶液、0.3mL 100μmol/L EDTA溶液+20μmol/L核黄素、100μL粗酶液。其中对照2支管以缓冲液代替酶液,混匀后将1支对照管置于暗处,其他各管于4000 LUX日光灯下反应15min。至反应结束后,以不照光管做空白参比,于560nm处分别测定其他各管的吸光度值。SOD活性以0.5△OD560/min·g Fw表示。样品重复测定3次。
1.2.5 POD活性的测定 参照Venisse J S的方法[16]并作修改。称取10.0g甘蓝样品,加入10mL 100mmol/L磷酸提取缓冲液(pH6.4内含1%交联聚乙烯吡咯烷酮(PVPP),1mmol/L聚乙二醇,1mmol/L苯甲基磺酰氟(PMSF),0.01%TritonX-100(V/V)),冰浴条件下匀浆,4℃、10000×g离心30min,取上清液为粗酶液提取液。POD反应体系为2.5mL 0.025mol/L愈创木酚、0.2mL 0.25mol/L H2O2和0.2mL粗酶液。加酶液后1min开始记录反应体系每分钟的吸光值变化,连续测定2min。在470nm处测定2min内样品的吸光值。POD活性以△OD470/min·g Fw表示。样品重复测定3次。
1.2.6 CAT活性的测定 参照Clairbone的方法[17]并修改。称取10.0g甘蓝样品,加入10mL 100mmol/L磷酸提取缓冲液(pH6.4,含1%PVPP)在冰浴条件下匀浆,之后于4℃、10000×g条件下离心30min,收集上清液,即为粗酶提取液。反应体系包括2mL 10mmol/L H2O2(用50mmol/L、pH6.4的磷酸缓冲液配制)和100μL粗酶液。在240nm处测定2min内样品的吸光值。CAT活性以0.01△OD240/min·g Fw表示。样品重复测定3次。
1.2.7 APX活性的测定 参照Nakano和Asada方法[18]并修改。称取10.0g甘蓝组织,加入10mL 100mmol/L磷酸缓冲液(pH6.4,含1mmol/L EDTA和1%PVPP),冰浴条件下匀浆后于4℃、10000×g离心30min,收集上清液。酶促反应体系由2mL 100mmol/L磷酸缓冲液(pH7.5,含1mmol/L EDTA),0.8mL 3mmol/L抗坏血酸,100μL粗酶液和0.5mL 0.5mmol/L H2O2组成,最后加入H2O2启动酶促反应。从启动后15s开始记录反应体系在290nm的吸光度值,连续测定2min。酶活性表示为0.01△OD290/min·g Fw。样品重复测定3次。
1.3 数据处理与分析
实验数据采用Excel进行统计分析并作图。
2 结果与分析
2.1 乙烯和MeJA处理对鲜切甘蓝O2·-产生速率的影响
在生物氧化系统中,氧作为一个重要的电子受体,在得到不同电子后形成不同的氧化产物,如O2-·、H2O2、·OH等,O2-·和H2O2随果蔬的成熟而不断积累[19]。由图1可知,甘蓝鲜切O2-·生成速率逐渐增加,4h达到最大值33.57μmol/g之后缓慢回落至初始水平,MeJA处理将O2-·生成速率的峰值提前至鲜切2h,同时峰值也略低于对照2.33μmol/g。与之不同,乙烯处理对O2-·生成速率的抑制作用较明显,12h内均低于对照,鲜切4h差异最大,低于对照17.667μmol/g。活性氧O2-·作为对组织产生氧化损伤的主要自由基,其含量的大量积累可诱导鲜切产品的品质大大降低,因此降低鲜切果蔬的O2-·生成速率是延长鲜切果蔬产品的货架期的重要目标之一,由图1可发现,外源乙烯处理可有效抑制鲜切甘蓝中的O2-·生成速率,从而延缓氧化损伤。
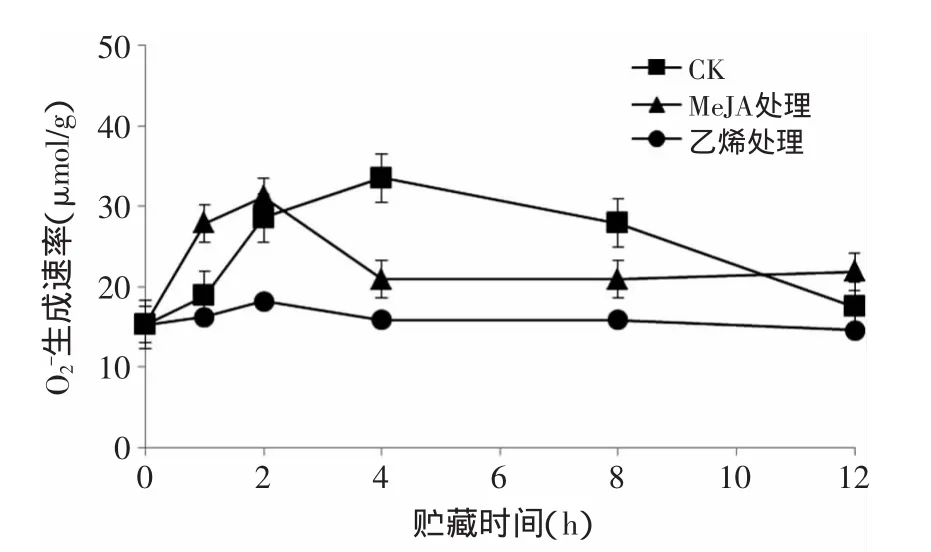
图1 乙烯和MeJA处理对鲜切甘蓝O2-生成速率的影响Fig.1 Effects of ethylene and MeJA on the formation rate of O2-in fresh-cut cabbage
2.2 乙烯和MeJA处理对鲜切甘蓝H2O2含量的影响
H2O2是启动衰老的重要因子,H2O2的积累会引发植物的程序化死亡[20],甘蓝在鲜切12h内H2O2含量呈单峰型变化,于鲜切2h达到含量高峰1789μmol/g Fw之后缓慢下降,乙烯和MeJA两种处理均可有效抑制鲜切12h内甘蓝中的H2O2含量。与乙烯处理相比,MeJA处理对鲜切甘蓝H2O2含量的抑制效果更明显(p<0.05),鲜切2h差异达到最大,低于对照35.7%。H2O2含量的变化由POD、APX以及CAT等抗氧化物酶的活性以及O2-的含量密切相关,由图2可知,MeJA可通过降低鲜切甘蓝的H2O2含量,调控鲜切甘蓝的活性氧代谢。

图2 乙烯和MeJA处理对鲜切甘蓝H2O2含量的影响Fig.2 Effects of ethylene and MeJA on content of H2O2of fresh-cut cabbage
2.3 乙烯和MeJA处理对鲜切甘蓝SOD活性的影响
SOD作为植物抗氧化系统的第一道防线,清除细胞中多余的O2-·[21],其活性的提高可增强植物体的抗性、降低活性氧对组织的氧化损伤,保持组织的正常代谢。甘蓝在鲜切12h内SOD活性呈先显著下降又缓慢上升的变化趋势,乙烯和MeJA两种信号分子对甘蓝组织中SOD活性的影响不同,MeJA处理抑制鲜切甘蓝的SOD活性,而乙烯处理可有效提高鲜切甘蓝的SOD活性,鲜切2h显著高于对照62%(p<0.05)。SOD作为植物抗氧化系统的第一道防线,其主要功能是清除细胞中多余的O2-·,防止对细胞膜系统造成伤害。由图1可知,乙烯处理可显著降低鲜切甘蓝的O2-·生成速率,这与图3显示的乙烯处理提高鲜切甘蓝的SOD活性的实验结果相符合。

图3 乙烯和MeJA处理对鲜切甘蓝SOD活性的影响Fig.3 Effects of ethylene and MeJA on SOD activity of fresh-cut cabbage
2.4 乙烯和MeJA处理对鲜切甘蓝POD的影响
CAT、POD、APX也是植物体内清除H2O2的关键酶,各抗氧化物酶的相互作用可以使体内自由基维持在一个较低水平[22]。其中,CAT与APX的不同之处在于:前者不需要还原力且具有较高的酶活速率,但对H2O2的亲和力较弱,后者需要还原性底物,并对H2O2具有较高的亲和力[23]。甘蓝的POD活性在鲜切1h达到高峰后缓慢降低,鲜切4h又呈上升趋势,并于12h达到最大值。乙烯和MeJA处理后鲜切甘蓝的POD活性在12h内均低于对照(图4),12h差异达到最大,经过乙烯处理12h后的甘蓝样品POD活性低于对照54.1%。POD一方面可以作为细胞膜的保护酶,清除H2O2,减少其对细胞膜脂的伤害;另一方面可利用H2O2释放出的O2氧化酚类物质,引发褐变。由图4可知,两种信号分子处理12h内,鲜切甘蓝的POD活性均低于对照,虽然对于鲜切甘蓝膜质伤害的抑制作用很小,但可以在一定程度下减缓鲜切甘蓝的感官品质。

图4 乙烯和MeJA处理对鲜切甘蓝POD活性的影响Fig.4 Effects of ethylene and MeJA on POD activity of fresh-cut cabbage
2.5 乙烯和MeJA处理对鲜切甘蓝CAT活性的影响
CAT与POD都是植物体内清除H2O2的关键酶,两者相互作用可以使体内自由基维持在一个较低水平。由图5可知,甘蓝鲜切12h内CAT活性呈单峰型变化,鲜切处理1h达到活性高峰后有所回落,外源乙烯和MeJA处理抑制了鲜切甘蓝的CAT活性,同时,MeJA、乙烯两种处理差异不大。结合图4可知,乙烯和MeJA对鲜切甘蓝的CAT和POD这两种以H2O2为底物的催化酶均起到抑制作用,具体原因还有待进一步研究。

图5 乙烯和MeJA处理对鲜切甘蓝CAT活性的影响Fig.5 Effects of ethylene and MeJA on CAT activity of fresh-cut cabbage
2.6 乙烯和MeJA处理对鲜切甘蓝APX活性的影响
APX是以抗坏血酸为电子供体的专一性强的过氧化物酶,能催化抗坏血酸与H2O2发生氧化-还原反应,APX活性的升高也有利于植物体内H2O2的清除。甘蓝鲜切12h内APX活性呈先降后升再降的往复变化趋势,外源乙烯处理提高了APX活性,在第8h时差异达到最大,高于对照49.1%,与之不同,MeJA处理在贮藏前期促进了APX的作用,而在贮藏后期对鲜切甘蓝的APX活性起到抑制作用(图6)。对比两种信号分子,乙烯对鲜切甘蓝的自由基清除方面的作用更明显。

图6 乙烯和MeJA处理对鲜切甘蓝APX活性的影响Fig.6 Effects of ethylene and MeJA on APX activity of fresh-cut cabbage
3 结论
新鲜蔬菜在鲜切加工处理过程中产生的机械伤害诱导鲜切产品产生大量活性氧,这些活性氧诱发植物组织的正常生理生化代谢紊乱。本研究结果表明,外源乙烯处理抑制了鲜切甘蓝中的O2-·生成速率,经过外源乙烯处理使鲜切甘蓝在贮藏后期其H2O2的含量显著降低(p<0.05),同时使抗氧化物酶SOD、APX活性有所提高,而另两种以H2O2为底物的抗氧化物酶——POD和CAT的活性受到抑制。与乙烯处理不同,经过MeJA处理可诱发鲜切甘蓝中O2-·生成速率的高峰提前出现,此外H2O2含量也显著下降(p<0.05),同时SOD、POD、CAT活性受到抑制,而鲜切甘蓝的APX活性在贮藏前期呈上升趋势,贮藏后期酶活受到抑制。APX作为以抗坏血酸为电子供体的专一性强的过氧化物酶,通过催化抗坏血酸与H2O2发生氧化-还原反应,从而清除植物体内活性氧H2O2。MeJA在贮藏前期诱导鲜切甘蓝的APX活性,结合POD、CAT活性受到抑制,初步推测,APX在清除鲜切甘蓝的活性氧H2O2过程中起到至关重要的作用。至于MeJA抑制H2O2产生的具体机理如何,有待进一步研究。
[1]田密霞,胡文忠,姜爱丽,等.不同温度热水处理对鲜切皇冠梨生理生化的影响[J].食品工业科技,2008,29(8):261-267.
[2]金金,刘程惠,胡文忠,等.不同贮藏温度对鲜切甘薯呼吸代谢及营养成分的影响[J].保鲜与加工,2012,10(4):28-32.
[3]田密霞,胡文忠,朱蓓薇,等.不同浓度的乳酸钙处理对鲜切皇冠梨生理变化的影响[J].食品科技,2008,6:226-230.
[4]田密霞,胡文忠,朱蓓薇,等.抗坏血酸处理对鲜切水晶梨营养成分及褐变的影响[J].食品与发酵工业,2008,34(1):156-159.
[5]胡位荣,刘顺枝,黄惠娟,等.抗坏血酸与壳聚糖处理对鲜切香芋贮藏效果的研究[J].食品科学,2010,31(24):436-439.
[6]郑亚男,胡文忠,姜爱丽,等.外源乙烯对鲜切甘薯伤害生理效应的影响[J].食品工业科技,2012,33(17):346-349.
[7]O’donnell P J,Calvert C,Atzornr,et al.Ethylene as a signal mediating the wound response of tomato plants[J].Science,1996,274:1917-1927.
[8]胡文忠,姜爱丽,庞坤,等.鲜切苹果的呼吸强度及乙烯生成量变化的研究[J].大连民族学院学报,2007,36(1):37-40.
[9]Robert S,Yaguang L,James M,et al.A Quality characteristics of fresh-cut watermelon slices from non-treated and 1-methylcyclopropene-and/or ethylene-treated whole fruit[J].Postharvest Biology and Technology,2007,44:71-79.
[10]蔡昆争,董桃杏,徐涛.茉莉酸类物质(JAs)及其在逆境胁迫中的抗性作用[J].生态环境,2006,15(2):397-404.
[11]段伟,李新国,孟庆伟,等.低温条件下植物光抑制机制[J].西北植物学报,2003,23(6):1017-1023.
[12]毛国红,郭毅,崔素娟.伤害信号分子及其信号转导[J].西北植物学报,2002,22(6):1504-1511.
[13]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,6:55-57.
[14]Prochazkova D,Sairam R K,Srivastava G C,et al.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Sci,2001,161:765-771.
[15]Oberley L,Spitz D.Nitroblue tetrazolium.Handbook of methods of oxygen radical research[C].In:Greenwald W A(ed.),CRC press,Boca Raton,1985(5):217-220.
[16]Venisse J S,Malnoy M,Faize M,et al.Modulation of defenses of Malus spp.during compatible and incompatible interactions with Erwinia amylovora[J].Mol Plant-Microbe Inter,2002,15:1204-1212.
[17]Clairbone A.Catalase activity——Handbook of methods of oxygen radical research[C].In:Greenwald W A(ed.),CRC press,Boca Raton,1985(5):283-284.
[18]Nakano Y,Asada K.Hydrogen peroxidase is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant Cell Physiol,1981,22:867-880.
[19]Jimenez A,Creiseen G,Kular B,et al.Changes in oxidative processes and components of the antioxidant systems during tomato fruit ripening[J].Planta,2002,214:751-758.
[20]Desikan R,Reynolds A,Hancock JT,et al.Harpin and hydrogen peroxide both initiate programmed cell death but have differential effects on defense gene expression in Arabidopsis suspension cultures[J].Biochem J,1998,330:115-120.
[21]Bowler C,Van M M,Inze D.Superoxide dismutase and stress tolerance[J].Plant Mol Biol,1992,43:83-116.
[22]胡文忠.鲜切果蔬科学与技术[M].北京:化学工业出版社,2009:1-7,91-98.
[23]杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001,17(2):121-125.
