水分胁迫和杀真菌剂对黄顶菊生长和抗旱性的影响
2013-05-14陈冬青皇甫超河刘红梅王楠楠杨殿林
陈冬青,皇甫超河,刘红梅,王楠楠,杨殿林
(农业部环境保护科研监测所,天津市农业环境与农产品安全重点实验室,天津 300191)
外来入侵是当今生态学界和环境科学界广泛关注的一个问题,外来入侵生物对入侵地生态系统的结构、功能及生态环境产生严重的干扰与危害,并对全球的农业和自然生态系统的生产力和生态系统构成了严重的威胁[1]。外来入侵植物作为一类能够快速入侵新生境的物种,其对环境条件的多变性和异质性有着独特的适应机制,其中菌根作为一种互惠互利的植物-真菌的共生体,是外来植物适应不利生境机制中不可缺少的一个组成部分。越来越多的研究认为丛枝菌根(AM)真菌在外来植物入侵中起到正反馈调节作用,成为外来植物入侵的驱动者[2],特别是外来植物通过与土著AM真菌形成互利共生对入侵实现正反馈促进作用及其机制受到极大的关注[3]。Mummey和Rillig[4]通过野外试验表明,外来入侵植物斑点矢车菊(Centaurea maculosa)改变了入侵地AM真菌群落,促进了矢车菊的成功入侵。金樑等[5]研究表明,AM真菌的存在可以减缓不利水分环境条件对加拿大一枝黄花(Solidago canadensis)生长的影响,提高其在新生境中的存活机会,并产生最大的生物量。
黄顶菊[Flaveria bidentis(L.)Kuntze]属于菊科黄顶菊属,原产南美洲,是近年来广泛蔓延于我国河北、山东、天津等地的入侵植物,其成功入侵已对我国华北地区生态系统造成重大威胁。黄顶菊是C4植物,它的光合作用很强,并和其他植物竞争养料和水分,在光线充足,土地湿润的地方长势很好,而土壤养分对其影响较小。作为一种菌根共生植物[6]其抗热性、抗践踏、抗病虫害、耐盐碱等能力较强[7],而这种强抗逆性与AM真菌共生的关系尚待研究。
目前报道的影响AM真菌作用及其分布的环境因子(水分、营养、土壤氧气含量等)的研究较多[7]。而有关不同的环境胁迫条件对菌根真菌与外来种共生机制的影响,以及菌根共生体功能的发挥与程度如何方面的报道较少。为进一步研究环境因子对AM真菌与黄顶菊的共生效应的影响,本试验选用苯菌灵为杀真菌剂,从植物生长过程中最常见的水分条件出发,分别模拟干早条件和渍水条件,以正常的水分为对照,研究不同水分条件下菌根对外来种黄顶菊生长和抗旱性的影响。苯菌灵能很好的抑制AM真菌的活性,降低其与植物形成共生体的机会,抑制丛枝菌根的形成[8],导致植物菌根侵染率降低[9],进而导致植物株高降低、生物量减少、相对生长率下降[10],植物抗逆性减弱等。本研究从土壤微生物学角度出发,研究AM真菌与入侵植物黄顶菊间的作用关系,对阐明其入侵机制及合理防控措施的制定具有重要的理论意义和应用价值。
1 材料和方法
1.1 供试材料
黄顶菊种子采集于河北省献县陌南村荒地,土壤采集于农业部环保所网室(39°05'804″N,117°08'805″E)。50%苯菌灵可湿性粉剂(有效成分:1-正丁氨基甲酰-2-苯并咪唑氨基酸甲酸甲酯)由上海农化实业有限公司生产。供试土壤硝态氮 4.77 μg/g,铵态氮 2.09 μg/g,速效磷10.35 μg/g,有机质18.41 g/kg,pH 值 7.10,最大田间持水量31.00%。
本试验分为4个水分梯度:渍水条件(相对含水量120%)、正常供水(相对含水量80%)、中度胁迫(相对含水量40%)和重度胁迫(相对含水量20%),同一水分条件均设灭菌和不灭菌两种处理,每个处理3个重复。
2011年5月25日开展网室盆栽,试验容器为240 cm×280 cm的塑料盆,每盆装土4.0 kg,在苗高5 cm时选长势一致的植株每盆定苗4株,灭菌处理每隔14 d施苯菌灵1次,施用剂量为50 mg/kg。每14 d随机转盆1次以消除局部环境条件差异影响,称重法保持土壤相对水分含量,90 d后测定光合相关指标,收获植株,进行生物量及生理生化指标的测定。
1.2 试验方法
收获时用常规方法测定植株株高、主根长,称重法测定植株各部分干重。植株保水力测定参见高俊凤《植物生理学实验技术》中的方法[11]。光合指标(净光合速率、气孔导度和蒸腾速率)用LI-6400型光合仪(LI-COR Inc,incoln,USA)测定。菌根侵染率用Phillips等[12]的方法测定,洗净根系,剪取距根尖1 cm左右的跟段,以台盼蓝染色测定菌根侵染率。
采集植株顶端起第3片新鲜叶子,测定植株生理学特性指标。可溶性糖含量用蒽酮比色法;可溶性蛋白质含量用考马斯亮蓝G-250染色法;MDA含量用硫代巴比妥酸比色法。
酶液的提取:0.5 g鲜叶片加入5 mL磷酸缓冲液于冰浴中研磨,匀浆转入离心管,于5000 r/min在-4℃离心15 min,上清液用于保护酶系统测定。SOD、POD、CAT活性分别采用氮蓝四唑(NBT)法(以抑制NBT降解10%作为1个酶活单位),愈创木酚法(以1 min光密度值上升0.01作为1个酶活单位)和紫外吸收法测定(吸光度每下降0.1作为1个酶活单位)测定[13]。
植株105℃杀青2 h,65℃烘至恒重后,粉碎称取0.5 g干物质测定植株全N、全P含量,组织全N用凯氏定氮法;组织全P用钒钼黄比色法[14]。
相关公式如下:

试验数据用SPSS17.0统计软件进行统计分析。同一水分条件下灭菌处理与不灭菌处理用T-test进行比较,采用双因子方差分析杀真菌剂和水分胁迫二者之间的交互效应。
2 结果与分析
2.1 不同水分条件和杀真菌剂对植株生长的影响
由表1可见,杀真菌对植株侵染率影响显著,相同水分条件下,不灭菌处理分别是灭菌处理的3.55、4.60、3.76和3.83倍;同时,菌根作用效果因水分条件的变化而不同,根系侵染率随相对含水量的降低而先增后降,在相对含水量为40%时达最大值。植株株高和主根长随土壤相对含水量降低表现为先增后降,正常水分时达最大值,均显著高于重度胁迫处理。
杀真菌剂对植株各部分生物量影响显著,均表现为灭菌处理低于不灭菌处理,其中地上部分生物量随水分条件变化表现为先增后降,正常水分显著高于重度胁迫处理。灭菌处理时,地下部分和须根生物量随相对含水量的降低先增后降,正常水分处理显著高于重度胁迫;不灭菌处理时两生物量逐渐降低,渍水条件分别是重度胁迫的3.21和3.86倍。
双因子方差分析结果表明,水分条件和杀真菌剂对植株各生长指标作用显著,且除对侵染率无显著交互作用外,对其余各生长指标均交互作用显著。

表1 水分胁迫和杀真菌剂处理对黄顶菊生长的影响Table 1 Effects of water stress and fungicide on the growth of Flaveria bidentis
2.2 不同水分条件和杀真菌剂对植株光合指标的影响
净光合速率、气孔导度和蒸腾速率均随相对含水量降低表现出先增后降的趋势(表2),正常水分处理时最高,且显著高于重度胁迫处理;杀真菌剂对各光合指标影响显著,除蒸腾速率在渍水条件下表现不一致外,其余条件下各光合指标均表现为灭菌处理低于不灭菌处理。
净光合速率/蒸腾速率表示在消耗单位重量的水分条件下,植物固定CO2的量的多少,该比值越高,代表植物水分利用效率越高;反之该值越低,则代表植物水分利用效率越低。由表2可知,植株水分利用率随土壤相对含水量降低而升高,重度胁迫下最高,灭菌与不灭菌处理分别为6.51和5.75,均显著高于渍水条件和正常水分处理,与中度胁迫无显著差异。
双因子方差分析结果表明,水分条件对黄顶菊光合指标和水分利用率均影响显著,杀真菌剂对净光合速率、气孔导度和蒸腾速率影响显著,对水分利用率无显著影响,且水分条件与杀真菌剂对各指标均无显著的交互作用。
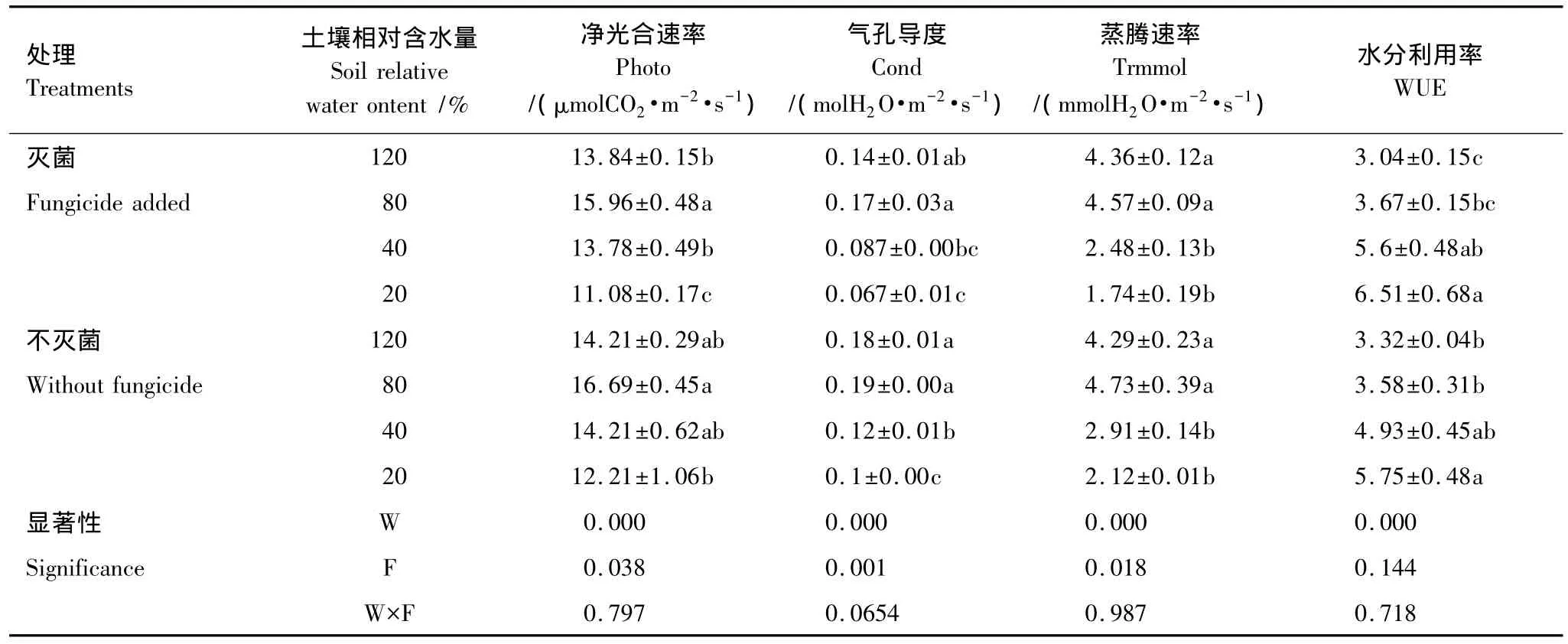
表2 水分胁迫和杀真菌剂处理对黄顶菊光合作用的影响Table 2 Effects of water stress and fungicide on the physiological indices of Flaveria bidentis
2.3 不同水分条件和杀真菌剂对植株叶片保水力的影响
叶片在离体条件下具有保持原有水分的能力,在一定时间内含水量越高,表明植物保水力越强,抗旱性也越强。8月24日(35℃,室内湿度43%)收取样品,测定黄顶菊叶片保水力,结果如表3所示,水分条件和杀真菌剂均对黄顶菊失水率产生显著影响。室内自然干燥条件下离体叶在不同时刻累计失水结果表明,灭菌处理在单位时间内累计失水量都高于不灭菌处理,同一时刻叶片失水率随土壤相对含水量的变化而不同,渍水条件和正常水分时失水率较高,重度胁迫时较低,特别是在48 h和72 h,重度胁迫下叶片失水率均显著低于渍水条件和正常水分处理。
对植株叶片失水率进行双因子方差分析,结果表明(表3),不同时刻,水分条件和杀真菌剂对叶片保水力均影响显著,且除8 h外均交互作用显著。

表3 水分胁迫和杀真菌剂处理对植株叶片保水力的影响Table 3 Effects water stress of and fungicide on the water preservation in leaves of Flaveria bidentis
2.4 不同水分条件和杀真菌剂对植株生理学特性的影响
如表4所示,同一水分条件,灭真菌处理降低了黄顶菊酶活性、可溶性糖和可溶性蛋白含量。但变化趋势和作用程度随土壤相对含水量变化而不同。在渍水条件和中度胁迫处理时,植株SOD、POD活性较正常水分有所上升,在重度胁迫时SOD升高,POD降低。CAT表现为正常水分最大,显著高于中度和重度胁迫处理。无论灭菌与否,渍水条件均增加了可溶性糖与可溶性蛋白含量,但作用程度因土壤相对含水量不同而存在差异,可溶性糖含量在重度胁迫达到最大值,两处理分别为0.71和1.05,可溶性蛋白在渍水条件时最大,两处理分别为4.9和5.67。黄顶菊叶片MDA含量随土壤相对含水量降低而逐渐增高,且随相对含水量降低,菌根作用逐渐增强,相对于灭菌处理,不灭菌植株体内MDA含量随相对含水量降低依次降低了2.04%、7.02%、18.84%和25.00%。
双因子方差分析结果表明,水分条件和杀真菌剂对植株各生理学指标均影响显著,且对POD、CAT和可溶性糖含量交互作用显著,对SOD、MDA和可溶性蛋白无显著交互作用。
2.5 不同水分条件和杀真菌剂对植株全N、P含量的影响
如表5所示,杀真菌剂对黄顶菊植株全N、P含量影响显著,灭菌处理均低于不灭菌处理。灭菌处理下,随相对含水量降低,全N、P含量均逐渐降低.。菌根对植株全N、P贡献率均逐渐上升,即随胁迫程度增强菌根作用增强。
双因子方差分析表明,水分条件和杀真菌剂对植株全N含量、每株吸氮量有显著交互效应,而对植株全P、每株吸P含量无显著交互效应。
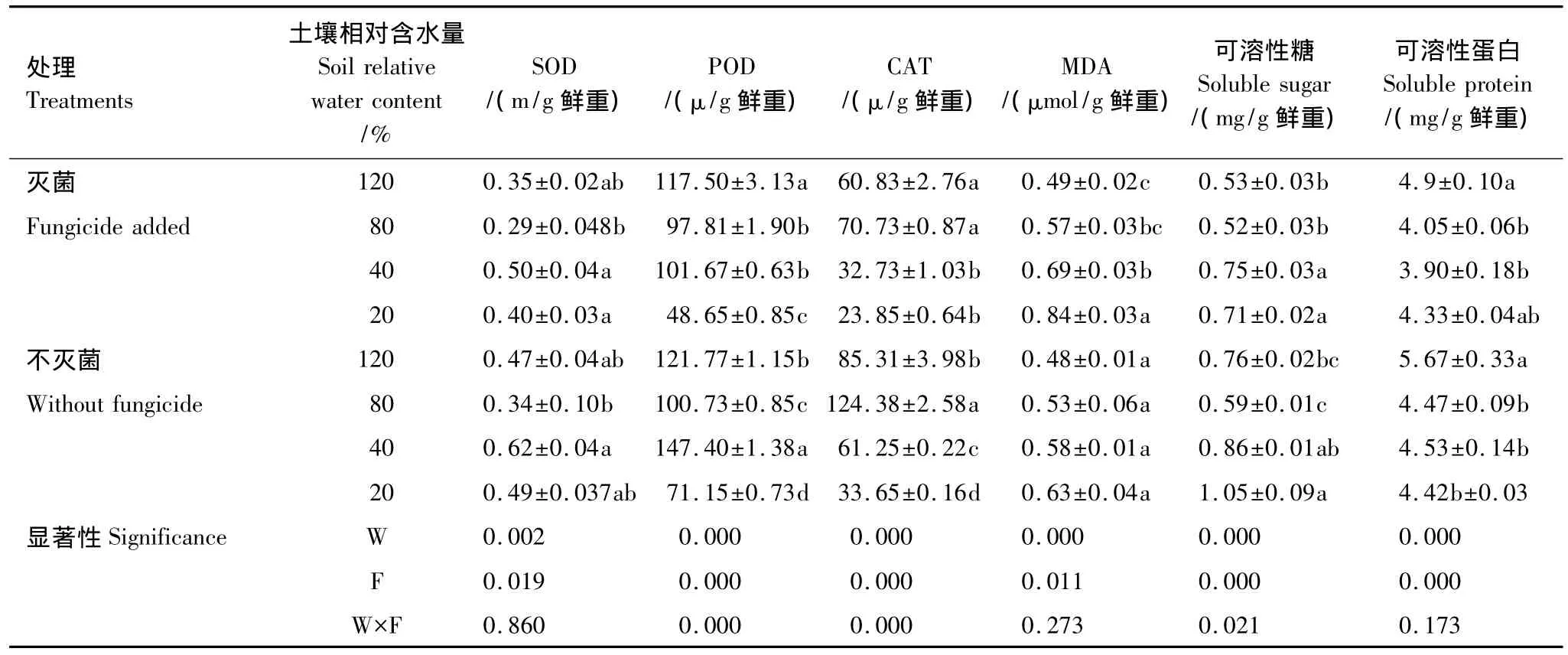
表4 水分胁迫和杀真菌剂处理对黄顶菊生理学特性的影响Table 4 Effects of water stress and fungicide on the physiological indices of Flaveria bidentis

表5 水分胁迫和杀真菌剂处理对黄顶菊植株全N、P含量的影响Table 5 Effects of water stress and fungicide on the complete N and P content of Flaveria bidentis
3 讨论
目前,关于AM真菌提高植物抗旱性的机理有多种解释。主要通过改善植株水分和养分吸收[15],调节细胞渗透势[16],以及改变植物体内一些次级代谢产物[17]等过程来调控植物生长。
Wright等[18-19]研究表明,AM真菌能够明显改善宿主植物水分状况,提高水分利用效率,增强宿主植物的耐旱性。本试验结果与之相似,杀真菌剂处理显著降低了黄顶菊菌根侵染率,降低了离体叶片保水力,减弱了黄顶菊在干旱环境中的生存与生长的能力。生物量的变化能够直观反映菌根的效应,贺学礼等[20]通过菌根依赖性和贡献率来描述AM真菌对宿主植物生物量的影响。本试验中,在中度和重度胁迫时,氮的菌根贡献率为43.11%和49.40%,磷的菌根贡献率为44.69%和58.26%,都较正常水分条件下菌根贡献率高,这与前人研究结果相似,说明水分胁迫下AM真菌能够促进植株养分吸收,特别是促进磷的吸收,而磷营养的改善,有利于光合效率的提高,最终促进了植株生长[21]。
许多研究者认为[22-23],干旱胁迫下,植物体为缓解干旱胁迫影响会诱导或加速多种生理反应,促进可溶性糖等渗透调节物质的积累。本试验中,水分胁迫促进黄顶菊叶片可溶性糖的合成,不灭菌处理下叶片可溶性糖含量均高于灭菌处理,与刘盛林[24]在甘草上的研究结果一致,可能因为AM真菌可通过促进氮、磷等营养元素的吸收进而促进宿主植物光合速率,可溶性糖的积累可稳定植物体内渗透压平衡,保证蛋白质结构稳定[17],从而增强植物抗旱能力,维持植物正常生长。
大量研究表明,AM真菌提高植物抗旱性可能与其增强植物酶促防御系统和非酶促防御系统功能有关[16,25]。干旱胁迫下,植物自动和被动地调节非酶促保护物质,以缓解细胞伤害[26]。本研究表明,AM真菌显著提高了植株叶片可溶性蛋白含量,增强了非酶促防御系统的能力,相似的结果在赵金莉[26]关于油蒿以及贺学礼[20]关于民勤绢蒿的研究中也有描述。关于干旱胁迫对SOD、POD、CAT活性的影响,不同作者以不同作物或不同品种为对象,所得的研究结果颇为不同。贺学礼等[27]报道,干旱胁迫丛下,AM真菌显著提高了柠条锦鸡儿的SOD、POD和CAT酶活性。张焕仕等[28]研究表明AM真菌提高了油蒿POD和CAT酶活性,MDA的积累减少,SOD活性受到了抑制。胡桂馨[29]研究发现,干旱胁迫下AM真菌增强了CAT酶的活性,但同时又抑制了POD酶活性,而侵染植株较不带菌植株表现出更强的抗旱性。本研究结果表明,灭菌处理均降低了POD、SOD、CAT活性并提高了MDA含量。AM真菌可通过提高SOD、POD和CAT酶活性进而清除因干旱胁迫导致的活性氧积累,从而减轻细胞膜脂过氧化的伤害,减少膜脂过氧化产物MDA的合成,最终提高植株的抗旱性[30]。本实验结果说明AM真菌的存在确实在一定程度上提高了植物的抗旱性,但不同植物应对水分胁迫时保护酶的变化趋势不尽相同,这可能是因为不同植物对干旱胁迫的响应机制不同,保护酶通过调节其含量变化协调干旱胁迫对植物生理的影响,其含量的多少与酶反应顺序有关,也与植物种类和抗旱性以及土壤性质有关,反应机理有待进一步研究。
AM真菌改善植物氮、磷营养已得到广泛认可,尤其是促进磷的吸收[21]。本研究也的到了相似的结果,菌根的作用不仅局限在植物根部对养分的吸收,而且可能通过一定途径调节植物养分运输的生理过程,从而进一步满足叶片光合代谢需要[31],促进植物生长。
综上所述,AM真菌能与黄顶菊根系形成良好的共生关系,改变了宿主根系形态,改善植株保水能力,提高宿主植物对土壤氮、磷元素等的吸收,刺激抗氧化保护酶生成以及渗透调节物质积累,缓解了由于干旱引起的细胞生理代谢紊乱,增强了宿主抗旱性,促进了宿主植物生长。本研究为菌根生物技术在黄顶菊入侵及防治等方面的应用提供了科学依据,对于防控黄顶菊向我国南方扩散具有重要的实践价值,同时对其他入侵植物入侵机理的研究也具有重要的借鉴意义。
[1]Dukes J S,Mooney H A.Does global change increase the success of biological invaders?.Trends in Ecology and Evolution,1999,14(4):135-139.
[2]Shah M A,Reshi Z A,Khasa D P.Arbuscular mycorrhizas:drivers or passengers of alien plant invasion.Botanical Review,2009,75(4):397-417.
[3]Harner M J,Mummey D L,Stanford J A,Rillig M C.Arbuscular mycorrhizal fungi enhance spotted knapweed growth across a riparian chronosequence.Biological Invasions,2009,12(6):1481-1490.
[4]Mummey D L,Rillig M C.The invasive plant species Centaurea maculosa alters arbuscular mycorrhizal fungal communities in the field.Plant and Soil,2006,288(1/2):81-90.
[5]Jin L.Ecology of Arbuscular Mycorrhizal Associations in Solidago Canadensis,An Invasive Alien Plant[D].Shanghai:Fudan University,2005.
[6]He B,He X L.Study on correlations between AM fungi and soil factors in the rhizosphere of Flaveria bidentis.Journsl of Agricultureal University of Hebei,2010,33(1):34-38.
[7]Raed D J.Mycorrhizas in ecosystems.Cellular and Molecular Life Sciences,1991,47(4):376-391.
[8]O'Connor P J,Smith S E,Smith F A.Arbuscular mycorrhizas influence plant diversity and community structure in a semiarid herbland.New Phytologist,2002,154(1):209-218.
[9]Allen M F.Formation of vesicular-arbuscular mycorrhizae in atriplex gardneri(Chenopodiaceae):seasonal response in a cold desert.Mycologia,1983,75(5):773-776.
[10]Brundrett M C.Mycorrhizas in natural ecosystems.Advances in Ecological Research,1991,21:171-313.
[11]Gao J F.Experiment Technology of Plant Physiology.Xi'an:Corporation of World Books Press,2000:19-19.
[12]Phillips J M,Hayman D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection.Transactions of the British Mycological Society,1970,55(1):158-161.
[13]Li H S.Principle and Technology of Plant.Physiological Biochemical Experiment.Beijing:Higher Education Press,2000:164-168
[14]Lu R K.Conventional Analysis Methods of Soil Agricultural Chemistry.Beijing:Science Press,1983:18.
[15]Nelson C E,Safir G R.Increased drought tolerance of mycorrhizal onion plants caused by improved phosphorus nutrition.Planta,1982,154(5):407-413.
[16]Ruiz-Lozanouan J M.Arbuscular mycorrhizal symbiosis and alleviation of osmotic stress:new perspectives for molecular studies.Mycorrhiza,2003,13(6):309-317.
[17]Qu T,Nan Z B.Research progress on responses and mechanisms of crop and grass under drought stress.Acta Prataculturae Sinica,2008,17(2):126-135.
[18]Wright D P,Scholes J D,Read D J.Effects of VA mycorrhizal colonization on photosynthesis and biomass production of Trifolium repens L.Plant,Cell and Environment,1998,21(2):209-216.
[19]Bethlenfalvay G J,Brown M S,Ames R N,Thomas R S.Effects of drought on host and endophyte development in mycorrhizal soybeans in relation to water use and Phosphate uptake.Physiologia Plantarum,1988,72(3):565-571.
[20]He X L,Gao L,Zhao L L.Effects of AM fungi on the growth and drought resistance of Seriphidium minchünense under water stress.Acta Ecologica Sinica,2011,31(4):1029-1037.
[21]Li X L,Yao Q.VA mycorrhiza and plant mineral nutrition.Progress in Natural Science,2000,10(6):524-531.
[22]Amundson R G,Kohut R J,Laurence J A,Fellows S,Colavito L J.Moderate water stress alters carbohydrate content and cold tolerance of red spruce foliage.Environmental and Experimental Botany,1993,33(3):383-390.
[23]Zwiazek J J.Cell wall changes in white spruce(Picea glauca)needles subjected to repeated drought stress.Physiologia Plantarum,1991,82(4):513-518.
[24]Liu S L,He X L.Effects of AM fungi on growth of Glycyrrhiza inflate Bat under water stress.Journal of Nuclear Agricultural Sciences,2009,23(4):692-696.
[25]Alguacil M,Caravaca F,Díaz-Vivancos P,Hernández J A,Roldánl A.Effect of arbuscular mycorrhizae and induced drought stress on antioxidant enzyme and nitrate reductase activities in Juniperus oxycedrus L.grown in a composted sewage sludge-amended semi-arid soil.Plant and Soil,2006,279(1/2):209-218.
[26]Zhao J L,He X L.Effects of AM fungi on the growth and drought-resistance of Artemisia ordosica.Acta Agriculturae Boreali-Sinica,2007,22(5):994-1001.
[27]He X L,Liu T,An X J,Zhao L L.Effects of AM fungi on the growth and drought resistance of Caragana korshinskii under water stress conditions.Acta Ecologica Sinica,2009,29(1):47-52.
[28]Zhang H S,He X L.Effect of AM fungi on the protective system in leaves of Artemisia ordosica under drought stress.Biotechnology Bulletin,2007,(3):129-133.
[29]Hu G Q,Wang D J,Liu RT.The effect of endophyte on activities of protective enzyme of tall fescue under drought stress.Grassland and Turf,2001,92(1):28-31.
[30]Wu Q S,Zou Y N,Xia R X.Effects of arbuscular mycorrhizal fungi on reactive oxygen metabolism of Citrus tangerine leaves under water stress.Chinese Journal of Applied Ecology,2007,18(4):825-830.
[31]Yan X F,Wang Q.Effects of ectomycorrhizal inoculation on the seedling growth of Quercus Liaotungensis.Acta Phytoecologica Sinica,2002,26(6):701-707.
参考文献:
[5]金樑.外来入侵种加拿大一枝黄花的菌根生态学研究[D].上海:复旦大学,2004.
[6]何博,贺学礼.黄顶菊根围AM真菌与土壤因子相关性研究.河北农业大学学报,2010,33(1):34-38.
[11]高俊凤.植物生理学实验技术.西安:世界图书出版社,2000:19-19.
[13]李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:164-168.
[14]鲁如坤.土壤农业化学分析方法.北京:中国科学技术出版社,1983:18.
[17]曲涛,南志标.作物和牧草对干旱胁迫的响应及机理研究进展.草业学报,2008,17(2):126-135.
[20]贺学礼,高露,赵丽莉.水分胁迫下丛枝菌根AM真菌对民勤绢蒿生长与抗旱性的影响.生态学报.2011,31(4):1029-1037.
[21]李晓林,姚青.VA菌根与植物的矿质营养.自然科学进展,2000,10(6):524-531.
[24]刘盛林,贺学礼.水分胁迫下AM真菌对甘草生长的影响.核农学报,2009,23(4):692-696.
[26]赵金莉,贺学礼.AM真菌对油蒿生长和抗旱性的影响.华北农学报,2007,22(5):994-1001.
[27]贺学礼,刘媞,安秀娟,赵丽莉.水分胁迫下AM真菌对柠条锦鸡儿 (caragana korshinskii)生长和抗旱性的影响.生态学报,2009,29(1):47-52.
[28]张焕仕,贺学礼.干旱胁迫下AM真菌对油蒿叶片保护系统的影响.生物技术通报,2007,(3):129-133.
[29]胡桂馨,王代军,刘荣堂.干旱胁迫下内生真菌对高羊茅保护酶活性的影响.草原与草坪,2001,92(1):28-31.
[30]吴强盛,邹英宁,夏仁学.水分胁迫下丛枝菌根真菌对红橘叶片活性氧代谢的影响.应用生态学报,2007,18(4):825-830.
[31]阎秀峰,王琴.接种外生菌根对辽东栎幼苗生长的影响.植物生态学报,2002,26(6):701-707.
