自生固氮菌活化土壤无机磷研究
2013-05-14杨宇虹吴叶宽黄建国
张 亮,杨宇虹,李 倩,吴叶宽,黄建国,*
(1.西南大学资源环境学院,北碚 400716;2.云南省烟草农业研究院,玉溪 653100)
磷是植物生长必须的大量营养元素之一。大多数土壤的含磷量较低,且以难溶状态存在[1]。磷肥施入土壤之后易形成难溶性的磷酸盐并迅速被土壤矿物吸附固定或微生物固持,其当季利用率通常只有施用量的10%—20%[2],活化利用土壤中的难溶性磷对于改善植物磷素营养有重要意义。微生物不同程度的参与土壤磷的活化,它们对土壤难溶性磷的溶解作用日益引起人们重视[3]。
目前,有关微生物活化土壤难溶性磷的研究多局限在芽孢杆菌(Bacillaceae)、真菌和放线菌[4]。前苏联蒙金娜于1935年最早从土壤中分离出1株解磷的巨大芽孢杆菌(Bacillus megaterium),具有分解核酸和卵磷脂的能力[5]。Sundara等利用磷酸三钙为磷源,经过14 d的培养后发现芽孢杆菌和埃希氏菌的溶磷能力最强[6]。此外,某些真菌也具有溶解无机磷能力,它们主要是青霉属(Penicillium)和AM菌根菌(Arbuscular mycorrhizal fungus);放线菌主要是链霉菌(Streptomyces)[7]。进一步的研究发现,溶磷微生物一般都能分泌有机酸,如甲酸、乙酸、柠檬酸和丁二酸等。在这些有机酸中,甲酸和乙酸的电离常数最大,能电离出氢离子,溶解氟磷灰石、氯磷灰石、羟磷灰石等磷酸钙盐,释放磷酸根[8-9];高碳有机酸能与铁铝形成稳定络合物,进而溶解高磷铁矿石、粉红磷铁矿、水铝矿等铁铝磷酸盐[10-11]。就自生固氮菌而言,它们不仅具有固氮作用而且还能溶解磷酸盐,改善土壤供磷能力[12],但溶磷机理尚待施入探讨。从多方面研究自生固氮菌的生物学功能,可更全面地了解它们的生态作用,更好地为农林生产服务。
1 材料与方法
1.1 材料准备
自生固氮菌(Azotobacter sp.)保存于西南大学资源环境学院微生物实验室,从重庆市北碚灰棕紫泥菜地土壤中分离获取,菌种均已进行固氮酶活性的测定。取其中的5株为供试菌株,代号分为N 01、N 02、N 03、N 04和N 05。先将自生固氮菌固体培养基蒸汽灭菌((121±1)℃,30 min),冷却后接种供试菌株,(30±1)℃斜面培养4 d备用。正常培养基组成为:蒸馏水1000 mL、琼脂20 g、葡萄糖10 g、KH2PO40.2 g、MgSO4·7H2O 0.2 g、NaCl 0.2 g、CaSO4·7H2O 0.2 g、CaCO35.0 g、pH 值 7.0—7.2。然后,再接种到盛有 50 mL(KCl代替KH2PO4)的自生固氮菌液体培养基中,摇床培养((28±1)℃、60 r/min)3 d,获得菌悬液备用。
供试土壤为侏罗纪紫色砂泥岩发育的灰棕紫泥。蒸汽灭菌后的土壤pH值6.15、有机质15.0 g/kg、全氮1.07 g/kg、全磷 0.89 g/kg、全钾 16.3 g/kg、铝磷 94.3 mg/kg、铁磷 65.9 mg/kg、闭蓄态磷 130.8mg/kg、钙磷274.0 mg/kg、有机磷320.8 mg/kg、有效磷20.0 mg/kg、速效钾92.6 mg/kg。风干土壤,磨细过100目筛,取1.0000 g土壤置于两端开口的直径为1 cm的塑料管中部,然后两端塞入玻璃纤维,将土壤夹在中间,再用孔径为0.22 μm的微孔滤膜密封两端,121℃蒸汽灭菌150 min。在振荡培养自生固氮菌时,将盛有土壤的塑料管放入液体培养基中,水分子、无机离子和有机酸等均可自由进出,但土壤又不会穿过滤膜而进入溶液,自生固氮菌也不能穿过滤膜进入土壤中。
试验中有机酸标准品为色谱纯,其余试剂均为分析纯。精确称取草酸、柠檬酸、苹果酸、丁二酸、乳酸、甲酸、乙酸各100 mg,用流动相溶解并定溶于100 mL容量瓶中,配置成1.0 g/L的有机酸的标准混合溶液,再用流动相将标准溶液分别稀释至0.01、0.02、0.04、0.06、0.08和0.10 g/L。
1.2 试验设计
取250 mL三角瓶,加入50 mL KCl代替KH2PO4的供试培养基,蒸汽灭菌((121±1)℃,30 min),冷却。接入1 mL 1.1中制备的菌悬液,再加1个装有土壤的灭菌塑料管;不接种的液体培养基为对照,余同接种处理,重复6次。摇瓶培养((28±1)℃、60 r/min)7 d,备测有关项。
1.3 测定项目与方法
将液体培养基摇匀,用PHS-3C精密酸度计测定pH值;取10 mL液体培养基用H2SO4-H2O2消化,钼蓝比色法测定消化液的含磷量;另取20 mL将液体培养基于10000 r/min离心8 min,钼蓝比色法测定上清液的无机磷含量。
利用高效液相色谱仪(日本HITACHI公司生产)测定液体培养基中的有机酸含量。色谱条件为:Diode Array L-7455紫外检测器,Ion-300有机酸分析专用柱 (Phenomenex,Torrance,CA,USA),流动相为2.5 mmol/L硫酸,流速为0.5 mL/min,进样量为20 μL样液(样液先经硫酸酸化),紫外检测波长为210 nm,柱温为35℃,压力为450 P。测定的有机酸包括草酸、柠檬酸、苹果酸、乳酸、丁二酸、甲酸、乙酸,其出峰时间(min)依次是 9.57、11.52、13.31、14.53、15.95、17.47、20.72(图 1)。

图1 有机酸的标准色谱图Fig.1 Standard chromatogram of organic acids
从塑料管中取出土壤,风干后用Olsen法提取,钼蓝比色法测定土壤中的有效磷含量[13];土壤无机磷组分测定:采用张守敬和Jackson提出的方法[14]。该方法将土壤无机磷分为:1 mol/L NH4C1浸提疏松态磷,0.5 mol/L NH4F浸提Al-P,0.1 mol/L NaOH浸提Fe-P,0.3 mol/L柠檬酸钠+1.0 g Na2S2O4+0.5 mol/L NaOH浸提的闭蓄态磷(O-P),0.5 mol/L(1/2H2SO4)浸提Ca-P。
1.4 数据处理
用Excel2003对试验数据进行基本计算,SPSS18.0进行统计分析,不同处理间的差异显著性用单因素方差分析进行比较,使用Pearson法进行双因素相关分析。
2 结果
2.1 自生固氮菌对培养基pH值的影响
图2可见,培养7 d之后,液体培养基的pH值显著低于对照(不接种),但菌株不同,液体培养基的pH值降幅也不一样。接种N 02之后,液体培养基的pH值为3.45,降幅最大;接种N 04,液体培养基的pH值为5.45,降幅最小;其余菌株培养基的pH值介于3.50和4.00之间。
2.2 自生固氮菌的有机酸分泌
表1可见,在液体培养基中检测到甲酸、乙酸、草酸、乳酸、丁二酸、柠檬酸、苹果酸等7种有机酸。在不接种的液体培养基中(对照),检测到草酸、苹果酸和丁二酸,但含量极低,可忽略不计。值得注意的是,自生固氮菌不同菌株分泌有机酸的种类和数量也不一样。在接种自生固氮菌的液体培养基中,草酸和苹果酸的含量显著高于对照,说明自生固氮菌均能分泌草酸和苹果酸,其中草酸分泌量普遍最高;此外,大多数自生固氮菌能分泌丁二酸和甲酸(N 04除外),N 01、N 03、N 05能分泌乙酸;N 02、N 03、N 05能分泌柠檬酸;N 02和N 04能分泌乳酸。从5种有机酸的总量看,N 03的分泌量最高,N 01次之,N 02和 N 05居第三,N 04最低。

图2 液体培养基中pH变化Fig.2 The changes in pH in liquid culture mediums

表1 液体培养基中有机酸的含量Table 1 Contents of organic acids in liquid culture mediums/(mg/L)
2.3 培养基中磷的形态与含量
表2可见,培养7 d之后,液体培养基中的无机磷含量因菌株不同而异。在接种N 02、N 03和N 05的液体培养基中,无机磷含量显著高于对照组,分别比对照提高28.54%(N 02)、21.12%(N 03)和15.73%(N 05);其余菌株培养基中的无机磷含量与对照相似,变化于4.58—4.82 mg/L之间。

表2 自生固氮菌培养液中的磷形态与含量Table 2 Phosphorus forms and contents in the liquid culture mediums grown with Azotobacter sp./(mg/L)
在接种自生固氮菌的液体培养基中,全磷含量均显著高于对照,比对照提高25.42%—50.53%,但接种不同菌株之间无显著差异,变化于8.24—9.89 mg/L之间(表2)。
培养基中的全磷减无机磷等于有机磷,少量是自生固氮分泌的有机磷,大部分存在于自生固氮菌细胞中(简称自生固氮菌细胞磷)。全部接种菌株的液体培养基中有机磷含量均显著高于对照,比对照提高72.64%—96.70%(表2)。
2.4 土壤有效磷
图3可见,土壤有效磷的含量因自生固氮菌菌株不同而异。与不接种相比,N 01和N 05显著增加土壤有效磷含量,培养7 d后分别增加了28.01%和22.06%,其余菌株土壤中的有效磷与对照相似。
2.5 土壤无机磷的组分与含量
培养7 d之后,土壤无机磷组分及含量见表3。在液体培养基中接种自生固氮菌,土壤铝磷、铁磷、钙磷和闭蓄态磷不同程度地降低。其中,除N 04之外,4株自生固氮菌显著降低土壤中的铝磷,降幅变化于22.03%—29.19%之间。除N 04和N 05之外,3株自生固氮菌显著降低土壤中的铁磷,降幅变化于6.52%—9.60%之间。除N 04之外,4株自生固氮菌显著降低土壤中的闭蓄态磷,降幅变化于16.94%—24.39%之间。全部接种菌株显著降低土壤中的钙磷,降幅变化于8.15%—17.89%之间。从土壤无机磷总量看,自生固氮菌均能显著降低土壤中的无机磷总量,降幅变化于8.11%—19.54%之间。此外,菌株不同,土壤无机磷各组分的降幅也不一样。就土壤无机磷总量而言,N 02降幅最大,N 04降幅最低,其余菌株介于二者之间。
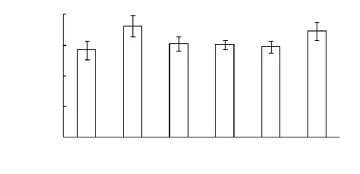
图3 土壤中有效磷含量变化Fig.3 The changes in available phosphorus in soils

表3 土壤中无机磷组分的变化Table 3 The changes in inorganic phosphorus fractions in soil/(mg/kg)
2.6 各因素的相关分析
表4可见,培养液中的pH值与培养液中的无机磷和全磷呈显著或极显著负相关(r=-0.850*和r=-0.918**,n=6,与土壤无机磷总量呈极显著正相关(r=0.959**,n=6);自生固氮菌的草酸分泌量与有机酸分泌总量呈极显著正相关(r=0.991**,n=6)。

表4 试验各因素的相关系数Table 4 Correlation coefficients among experimental factors
3 讨论
液体培养基中的全磷包括无机磷和有机磷,后者主要存在于自生固氮菌细胞中(简称自生固氮菌细胞磷)。在部分自生固氮菌液体培养基中,无机磷显著增加;在全部自生固氮菌液体培养基中,自生固氮菌细胞磷和培养液中的全磷含量均显著高于对照。与此同时,土壤无机磷总量(铁磷、铝磷、闭蓄态磷、钙磷四者之和)则显著降低。由于土壤磷是培养基磷的唯一来源,说明自生固氮菌可促进土壤无机磷的溶解释放,以无机磷或自生固氮菌细胞磷的形式存在于液体培养基中。值得注意的是,在全部自生固氮菌的液体培养基中,土壤钙磷显著降低。由于氢离子的释放有利于钙镁磷酸盐的溶解[15-16],这说明自生固氮菌能分泌大量的氢离子,也是自生固氮菌活化无机磷能力较强的原因之一。此外,自生固氮菌因菌株不同,土壤中的闭蓄态磷、铁磷、铝磷发生不同程度的降低,说明自生固氮菌活化土壤不同形态的无机磷因菌株不同而异。在接种N 01和N 05的处理中,土壤有效磷含量显著增加;而在接种其余菌株的处理之中,土壤有效磷含量无显著变化,进一步说明自生固氮菌菌株不同活化释放无机磷的能力也不一样。
磷细菌能够分泌草酸、苹果酸、乳酸、乙酸、柠檬酸等多种有机酸,不同菌株之间差异很大[17];有研究者认为解磷细菌的溶磷能力与培养液中的介质有关,磷细菌通过NH+4的同化作用释放出质子,降低pH值,从而引起磷酸盐的溶解[18]。Wallander曾报道,溶磷微生物通过呼吸作用释放CO2,能降低培养液中的pH值,从而释放出磷酸根离子[19]。Whitelaw等[20]发现磷细菌溶解难溶性磷酸盐时,是培养液中氢离子和有机酸共同作用的结果。Hameeda等[21]研究表明,微生物溶解无机磷的能力与其产生葡萄糖酸的量有一定的关系,解无机磷能力强的菌株,其相应的产生葡萄糖酸的量也多,并且还发现在培养过程中pH值是降低的。在本试验中,全部菌株均能分泌草酸和柠檬酸。此外,大多数自生固氮菌能分泌丁二酸和甲酸(N 04除外),因菌株不同分泌乙酸、柠檬酸和乳酸的情况而异,这说明不同的菌株溶磷机理可能有所差异。需要指出的是,草酸分泌量与有机酸分泌总量呈极显著正相关(r=0.991**,n=6),自生固氮菌的草酸分泌量普遍最高。由于草酸(HOOC—COOH)中的两个羧基的电子互相吸引,产生共轭作用,其酸度约是甲酸的100倍,乙酸的1000倍;乙酸也属于较强的有机酸,其电离常数为1.8×10-5(25℃),大于碳酸(4.3×10-7)100倍,推测草酸在活化土壤无机磷的过程中可能起重要作用。
供试自生固氮菌菌株显著降低液体培养基中的pH值,至少降低了1.76个单位,即氢离子浓度增加约58倍。但是,接种自生固氮菌之后,液体培养基中的有机酸最高仅增加7.19倍(N 03),推测自生固氮菌分泌氢离子的数量可能远远超过所有机酸离解产生的氢离子。有研究表明,豆科植物在低磷环境中能向周围土壤中分泌氢离子和有机酸,进而溶解土壤中的难溶性磷,改善植物的磷素营养[22]。相关分析表明,培养液中的pH值与培养液中的无机磷和全磷呈显著或极显著负相关(r=-0.850*和r=-0.918**,n=6),这说明培养液中pH值的降低是导致土壤无机磷向培养液中释放磷酸根的直接原因;并且培养基的pH值与土壤无机磷总量呈极显著正相关(r=0.959**,n=6),溶解钙镁磷酸盐的机理可能与自生固氮菌细胞的质子分泌有关。因为在酸性条件下,钙镁磷酸盐溶解度提高。这可能是部分豆科植物改善土壤磷素营养的原因之一。与此同时,铝磷、铁磷和闭蓄态磷的溶解可能与高碳有机酸的分泌密切相关。因为柠檬酸和草酸络合Fe3+和Al3+的能力极强,并且 Fe3+、Al3+分别和柠檬酸、草酸的 logK稳最低为 7.26,最高达到 25.00[23]。其中,[Al(C2O4)3]3-和[Fe(C2O4)3]3-的稳定常数分别为2.0×1016和3.9×1016。所以,草酸能络合铁铝磷酸盐和铁铝氧化物胶膜中的Al3+、Fe3+,导致铁铝磷酸盐和闭蓄态磷释放,提高生物有效性[24]。考虑到试验中自生固氮菌的草酸分泌量占有机酸分泌总量的比重大,推测草酸的分泌在活化土壤无机磷的过程中可能起着至关重要的作用。有学者研究表明,磷细菌在生长过程中分泌到介质中的草酸、柠檬酸和苹果酸是溶解铝磷和铁磷的主要原因[25-26]。并且,有研究表明,直接向含有难溶性磷酸盐的红壤中加入草酸、苹果酸等有机酸,发现培养液中的可溶性磷含量显著增加[27],这直接说明有机酸对难溶性磷酸盐有活化作用。试验中自生固氮菌与大多数磷细菌一样,都能分泌有机酸,产生相似溶磷机理。除此之外,自生固氮菌还能直接分泌氢离子,直接溶解钙镁磷酸盐。因此,自生固氮菌兼具分泌氢离子和多种有机酸的能力,以多种方式活化土壤不同形态的无机磷,促进周围植物的生长。这一点也得到了证实,有学者曾将自生固氮菌接种到杨柴根际的土壤中,对其有明显的促生作用,同时提高了土壤有效磷的活性[28]。
总之,自生固氮菌除固氮活性之外,还具有活化土壤无机磷的作用。因菌株不同,它们以不同的方式活化土壤中的铝磷、铁磷、闭蓄态磷、钙磷,导致自生固氮菌的溶磷机理出现了多样性。
[1]Liang J F,Yu H W,Ye G P,Jiang P K.Influence of organophosphate on growth and phosphorus-dissolving of phosphobacteria.Acta Agriculturae Jiangxi,2007,19(8):89-90.
[2]Kang Y J,Hu J,Shan J,He F,Piao Z,Yin S X.Solubilization capacity of insoluble phosphates and it's mechanism by two phosphate solubilizing fungi(PSF).Microbiology,2006,33(5):22-27.
[3]Zhang Y L,Lu X L,Yang C D.A preliminary study on the isolation and characterization of inorganic phosphate-solubilizing bacteria in soil of alpine grasslands in Eastern Qilian Mountains.Acta Agrestia Sinica,2011,19(4):560-564.
[4]Li J F,Zhang S Q,Shi S L,Huo P H.Ventilation conditions on phosphorus-dissolving Rhizobia.Grassland and Turf,2010,30(1):28-32.
[5]Xi L Q,Feng R Z.Research of plant phosphate-solubilizing microorganisms.Jouranl of Tarim University,2006,18(4):57-61.
[6]Sundara Rao W V B,Sinha M K.Phosphate dissolving microorganisms in the soil and rhizosphere.India Journal of Agricultural Science,1963,33(4):272-278.
[7]Jones D L,Oburger E.Solubilization of phosphorus by soil microorganisms.Soil Biology,2011,100(2):169-198.
[8]Guiñazú L B,Andrés J A,Del Papa M F,Pistorio M,Rosas S B.Response of alfalfa(Medicago sativa L.)to single and mixed inoculation with phosphate-solubilizing bacteria and Sinorhizobium meliloti.Biology and Fertility of Soils,2010,46(2):185-190.
[9]Adeleke R A,Cloete T E,Bertrand A,Khasa D P.Mobilisation of potassium and phosphorus from iron ore by ectomycorrhizal fungi.World Journal of Microbiology and Biotechnology,2010,26(10):1901-1913.
[10]Hu HQ,Tang C X,Rengel Z.Role of phenolics and organic acids in phosphorus mobilization in calcareous and acidic soils.Journal of Plant Nutrition,2005,28(8):1427-1439.
[11]Fankem H,Nwaga D,Deubel A,Dieng L,Merbach W,Etoa F X.Occurrence and functioning of phosphate solubilizing microorganisms from oil palm tree(Elaeis guineensis)rhizosphere in Cameroon.African Journal of Biotechnology,2006,5(24):2450-2460.
[12]Kumar V,Behl R K,Narula N.Establishment of phosphate-solubilizing strains of Azotobacter chroococcum in the rhizosphere and their effect on wheat cultivars under green house conditions.Microbiological Research,2001,156(1):87-93.
[13]Yang J H,Wang C L,Dai H L.Soil Agro-Chemistry Analysis and Environmental Monitoring.Beijing:China Land Press,2008.
[14]Bao S D.Soil and Agro-Chemistry Analysis.Beijing:China Agriculture Press,2000.
[15]Grierson P F.Organic acids in the rhizosphere of Banksia integrifolia L.f..Plant and Soil,1992,144(2):259-265.
[16]Hinsinger P.Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes:a review.Plant and Soil,2001,237(2):173-195.
[17]Bian W Y,He Z L,Huang C Y.Increasing transformation and bioavailability of specifically sorbed P by P efficient microorganisms(PEM).Journal of Zhejiang University:Agriculture and Life Sciences,2000,26(4):461-464.
[18]Asea P E A,Kucey R M N,Stewart J W B.Inorganic phosphate solubilization by two Penicillium species in solution culture and soil.Soil Biology and Biochemistry,1988,20(4):459-464.
[19]Wallander H.Uptake of P from apatite by Pinus sylvestris seedlings colonised by different ectomycorrhizal fungi.Plant and Soil,2000,218(1/2):249-256.
[20]Whitelaw M A,Harden T J,Helyar K R.Phosphate solubilisation in solution culture by the soil fungus Penicillium radicum.Soil Biology and Biochemistry,1999,31(5):655-665.
[21]Hameeda B,Harish Kumar Reddy Y,Rupela O P,Kumar G N,Reddy G.Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna.Current Microbiology,2006,53(4):298-302.
[22]Shen J B,Yuan L X,Zhang J L,Li H G,Bai Z H,Chen X P,Zhang W F,Zhang F S.Phosphorus dynamics:from soil to plant.Plant Physiology,2011,156(3):997-1005.
[23]Li Y Y,Zeng Z J,Li X F,Yu Y X,Huang Q C.Mobilization of sparingly soluble phosphate by Secale cereale L.and its corresponded mechanisms.Acta Botanica Boreali-Occidentalia Sinica,2008,28(4):724-729.
[24]Zhang A Q,He L Y,Zhao H E,Guo Z H,Cui X M.Effect of organic acids on inorganic phosphorus transformation in soils and its readily available phosphate.Acta Ecologica Sinica,2009,29(8):4061-4069.
[25]Hinsinger P,Gobran G R,Gregory P J,Wenzel W W.Rhizosphere geometry and heterogeneity arising from root-mediated physical and chemical processes.New Phytologist,2005,168(2):293-303.
[26]Scervino J M,Mesa M P,Mónica I D,Recchi M,Moreno N S,Godeas A.Soil fungal isolates produce different organic acid patterns involved in phosphate salts solubilization.Biology and Fertility of Soils,2010,46(7):755-763.
[27]Gong S G,Wang X X,Zhang T L,Li Q M,Zhou J.Release of inorganic phosphorus from red soils induced by low molecular weight organic acids.Acta Pedologica Sinica,2010,47(4):692-697.
[28]Zhao Z Q.Isolation of Nitrogen Fixing Bacteria and Study on Effects of Inoculation with Heysarum fruticosum var mongolicum in Erdos[D].Ya'an:Sichuan Agricultural University,2008.
参考文献:
[1]梁锦锋,于红卫,叶国平,姜培坤.有机磷化物对磷细菌生长和解磷的影响.江西农业学报,2007,19(8):89-90.
[2]康贻军,胡健,单君,何芳,朴哲,殷士学.两株解磷真菌的解磷能力及其解磷机理的初步研究.微生物学通报,2006,33(5):22-27.
[3]张宇龙,卢小良,杨成德.东祁连山高寒草地土壤无机磷溶解菌分离及溶磷能力初探.草地学报,2011,19(4):560-564.
[4]李剑峰,张淑卿,师尚礼,霍平慧.解磷根瘤菌液体培养基类型,浓度及透气条件的比较.草原与草坪,2010,30(1):28-32.
[5]席琳乔,冯瑞章.植物根际解磷菌的研究进展.塔里木大学学报,2006,18(4):57-61.
[13]杨剑虹,王成林,代亨林.土壤农化分析与环境监测.北京:中国大地出版社,2008.
[14]鲍士旦.土壤农化分析.北京:中国农业出版社,2000.
[17]边武英,何振立,黄昌勇.高效解磷菌对矿物专性吸附磷的转化及生物有效性的影响.浙江大学学报:农业与生命科学版,2000,26(4):461-464.
[23]李耀燕,曾志军,黎晓峰,玉永雄,黄秋婵.黑麦对难溶性磷酸盐的吸收及活化机制研究.西北植物学报,2008,28(4):724-729.
[24]章爱群,贺立源,赵会娥,郭再华,崔雪梅.有机酸对土壤无机态磷转化和速效磷的影响.生态学报,2009,29(8):4061-4069.
[27]龚松贵,王兴祥,张桃林,李清曼,周静.低分子量有机酸对红壤无机磷活化的作用.土壤学报,2010,47(4):692-697.
[28]赵志强.鄂尔多斯几种沙生植物根际自身固氮菌的筛选及对杨柴接种效应研究[D].雅安:四川农业大学,2008.
