高温影响番茄小孢子发育的细胞学研究
2013-05-14何艳军关小燕刘松瑜
彭 真,程 琳,何艳军,王 洁,关小燕,刘松瑜,卢 钢
(浙江大学农业与生物技术学院园艺系,杭州 310058)
高温严重影响植物的生长发育及生理代谢,已成为限制植物分布、生长和生产力的一个主要环境因子。大多数栽培作物(如番茄[1]、辣椒[2]、菜豆[3]、拟南芥[4]、水稻[5]、大麦[6]等)的生殖生长时期比营养生长时期对高温更敏感,前人的研究表明这主要是因为花粉发育与萌发对高温非常敏感[7-8]。番茄作为重要的园艺作物其产量和质量却受到高温或者低温的影响。在日温高于32℃的环境下生长的番茄植株其雄配子的发育与功能比雌配子更易受到影响,从而导致授粉受精不良、坐果率下降、果实品质变劣等[9-11]。
关于番茄高温胁迫的影响,前人研究重点主要涉及高温对番茄种子萌发和植株生长的影响、番茄耐热性鉴定方法和高温影响成熟花粉粒表达谱差异分析等诸多方面[12-14],但对于持续高温胁迫对番茄花粉小孢子发育影响的细胞与分子生物学研究尚未见报道。正常条件下的番茄小孢子发育过程的研究表明,绒毡层细胞在孢母细胞减数分裂时开始出现自溶迹象,而且同一花药不同药室内,孢母细胞减数分裂高度同步[15]。同时证实小孢子发育时期与花器形态密切相关[16-18]。本研究以番茄‘Micro-Tom’为材料,通过 DAPI(4',6-diamidino-2-phenylindole)染色、石蜡切片等方法对正常情况下小孢子发育各时期进行划分;并研究了高温胁迫对番茄小孢子发育细胞学结构的影响,旨在探索高温胁迫下小孢子败育的细胞学基础。
1 材料与方法
1.1 材料
实验材料为番茄品种‘Micro-Tom’(Solanum lycopersicum L.),由美国番茄遗传资源中心(Tomato Genetics Resource Center,TGRC)本实验室多代自交保存的稳定自交系。在基质(草炭∶蛭石∶珍珠岩=3∶1∶1)上培育的幼苗,种植于智能光照培养箱内,光照强度约为300 μmol·m-2·s-1,光周期为16 h/8 h(光/暗),空气湿度保持在70%—85%。植株正常生长温周期为(25±1)℃/(20±1)℃(昼/夜),高温胁迫处理的温度为(35±1)℃/(30±1)℃。植株培育现第一花序时开始高温胁迫,处理时间为7 d。对照组植株与热处理组植株相比,除生长环境温周期不同外,保证其他条件均相同。
1.2 方法
1.2.1 DAPI染色法检测小孢子发育时期
进行番茄小孢子发育观察和时期划分的材料种植温度为(25±1)℃/(20±1)℃。于开花期取处于不同发育阶段的花蕾(图1),保持新鲜,用Leica体视显微镜拍照并测量花蕾长度。取不同发育阶段的花药,于洁净载玻片上用手术刀横切花药并分离出小孢子,用1 mg/mL的DAPI溶液于黑暗环境下染色小孢子30 s,在Leica DMLB荧光显微镜下观察小孢子发育各阶段的形态,并用Zeiss CCD系统拍照记录。
1.2.2 TTC染色法检测花粉活力
9:00以前取花瓣初展开的番茄花蕾,放入培养皿中,并注意保湿,备用。将50 μL 0.5g/100mL浓度的TTC(Triphenyltetrazolium chloride)溶液滴到洁净载玻片上,用手术刀横切不同发育阶段的花药,放入载玻片上溶液中挤出花粉粒,加盖玻片。将制片放入垫有湿吸水纸的培养皿,于37℃恒温箱中,避光,放置90 min左右,然后取出制片,置于低倍显微镜下观察染色情况并拍照记录。每份材料观察不同植株上的3—4个花蕾,每一花蕾制一个制片,每片取5个视野,统计并计算花粉的活力百分率。

图1 番茄‘Micro-Tom’小孢子发育各时期花蕾形态观察Fig.1 Investigation of bud morphology of Solanum lycopersicum var.Micro-Tom during microspores development stages
1.2.3 花粉体外萌发法检测花粉萌发力
上午9时以前取花瓣初展开的番茄花蕾,于体外进行花粉萌发实验。花粉萌发液体培养基[19]各成分、工作浓度及培养基pH值分别为:蔗糖120 g/L,H3BO350 mg/L,Ca(NO3)2·4H2O 300 mg/L,MgSO4·7H2O 200 mg/L,KNO3100 mg/L,pH值=6.5。向液体培养基中添加琼脂粉(终浓度为0.1%)使培养基有适量粘性,防止花粉粒在培养基上漂移到液滴边缘,保证花粉粒能够均匀分布。
对照花粉[CK(25℃),Control Check]分别置于25℃和35℃温度下萌发,高温胁迫处理花粉[HS(35℃),Heat Stress]也分别置于25℃和35℃温度下萌发。花粉萌发60 min后在培养基上滴加20 μL 0.1g/100mL浓度的苯胺蓝溶液对花粉管荧光染色3 min,然后在Leica荧光显微镜下镜检拍照,统计各处理的花粉萌发率。
1.2.4 石蜡切片
制作石蜡切片,观察高温胁迫前后番茄小孢子发育各阶段的花药、药室、绒毡层、小孢子等的变化。分别取对照和高温胁迫番茄的各级花蕾,固定于FAA固定液(50%乙醇∶冰醋酸∶福尔马林=18∶1∶1)中48 h,随后将固定好的材料依次转入50%、70%、85%、95%、100%乙醇中逐级脱水(各1 h),然后经二甲苯彻底透明后,进行透蜡和石蜡包埋,包埋好的蜡块放入4℃冰箱中保存备用。切片时制成厚度为8 μm的连续切片,用铁矾-苏木精法染色,中性树胶干燥封片。Leica DMLB荧光显微镜观察,并用Zeiss CCD系统拍照记录。
2 结果与分析
2.1 番茄花粉发育过程的细胞学特征
2.1.1 番茄花粉发育进程
番茄花蕾初期发育比较慢,从花芽开始分化到可见萼片,以及花瓣的发生大约需要10 d,到能观察到初生的雄蕊又需要3 d左右。以后发育加快,雄蕊发育到花粉母细胞可见需要5 d,以后进行减数分裂形成四分体小孢子直到四分体小孢子分离而形成单核花粉粒大约需要4 d,单核花粉粒经过约3—4 d就可以形成完全成熟的花粉粒。
2.1.2 小孢子母细胞形成期至前减数分裂期
花蕾完全闭合,被萼片包被,呈绿色,有稠密绒毛,花蕾长度约2 mm(图1 A)。剥离花被,可见各花药独立未形成花药筒,呈浅黄绿色,透明。石蜡切片观察,该时期花药壁的各层已分化明显。最外层是表皮,细胞小,具角质层,有保护功能。表皮下层近于方形的较大细胞为药室内壁,内部1—3层较小的、呈切向延长的扁细胞,为中层。最内一层是绒毡层,为质浓、核大的长柱状细胞,其功能是提供小孢子发育所需的营养物质。药室呈马蹄形,内含许多有棱的小孢子母细胞(图1 a)。小孢子母细胞拥有一个较大的核(图2 A),并被具有双核的绒毡层细胞所包围。

图2 番茄花粉小孢子发育各时期的DAPI染色观察Fig.2 Investigation of tomato microspores development using DAPI staining
2.1.3 前减数分裂期至四分体时期
花蕾仍完全闭合,被萼片包被,呈绿色,蕾长2.5—3.5 mm(图1 B)。各花药相互靠近结合但未形成花药筒,呈浅黄绿色,半透明,药室内空间增大(图1 b)。小孢子母细胞完成正常的减数分裂,分裂完成时在4个核间产生细胞壁,并分隔成由胼胝质所包围的4个细胞,形成正四面体形的小孢子四分体,4个小孢子处于共同的胼胝质中,通常只能观察到3个小孢子(图2 B)。
2.1.4 四分体至单核早期
花蕾明显长大,萼片微高于花冠,花蕾呈浅绿色,蕾长约3.5—4.5 mm(图1 C)。花药基部独立,上部结合,呈浅黄绿色,药室内空间继续增大(图1 c)。这一阶段小孢子已从四分体的胼胝质中释放出来,此时小孢子具有不规则形状(图2 C)。
2.1.5 单核小孢子中后期
花蕾明显长大,花冠接近萼片长度,花蕾呈浅绿色、淡黄,蕾长约4.5—6.5 mm(图1 D)。花药基部结合,形成花药筒,呈黄绿色。花粉粒的三条萌发沟清晰可见,细胞质中含有大液泡,细胞核靠边,花粉粒形状接近圆球形(图2 D)。
2.1.6 双核花粉粒形成期
花蕾充分膨大,花萼裂开,呈黄绿色,花冠微露于萼片外,黄色,绒毛稀疏,花蕾长约6.5—7.5 mm。各花药联合形成完整的花药筒,呈浅黄色(图1 E,e)。花粉粒经过一次有丝分裂后形成双核花粉粒,此时期可见一个染色较淡的营养细胞和一个染色较深的生殖细胞(图2 E)。
2.1.7 成熟花粉粒时期
萼片、花瓣全部开裂,暴露出花药,花冠深黄色,花朵长度约7.5—8.5 mm(图1 F)。花药黄色,花粉囊开裂,能够散粉(图1 f)。花粉粒发育完成,形成颗粒饱满充实、细胞质染色较深的成熟花粉粒(图2 F)。
2.2 高温胁迫对番茄小孢子发育影响的分析
2.2.1 花粉TTC染色结果
在正常温度环境 (25℃/20℃)下,花药内的成熟花粉粒数目多,花粉粒生活力强,花粉红染率为84.65%。高温胁迫环境(35℃/30℃)下,花药内的成熟花粉粒数目减少,花粉生活力显著减弱,红染率为仅为10.72%(图3)。

图3 TTC染色法检测Micro-Tom番茄成熟花粉粒在高温胁迫前后的生活力变化Fig.3 Analysis of pollen viability of these plants subjected to normal(25℃/20℃)and high(35℃/30℃)temperature treatments by TTC staining
2.2.2 花粉萌发结果
对照花粉饱满、颗粒之间无粘连(图4 A,B);在25℃和35℃温度下的萌发率分别为57.08%和52.62%,35℃下的萌发率略有降低,但差异不显著。高温胁迫花粉有空瘪、外壁凹陷、颗粒粘连现象,正常花粉粒数目比例较低(图4 D);无论是在35℃还是在25℃的温度下,均没有发现处理后番茄的花粉管伸长,重复萌发实验并将萌发时间延长至4 h仍然未观察到花粉管伸长(图4 C)。以上结果表明35℃/30℃高温胁迫影响了小孢子发育,导致花粉败育,而35℃高温对正常花粉粒萌发的影响不显著。
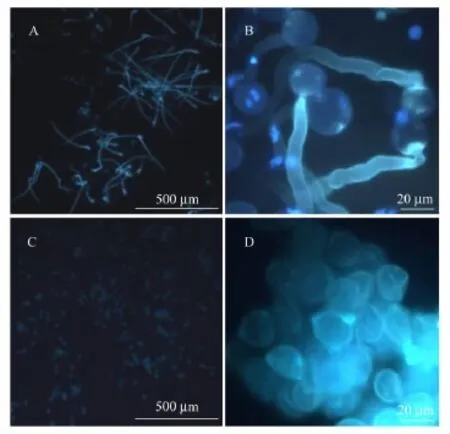
图4 适温与高温胁迫条件下发育的番茄‘Micro-Tom’成熟花粉粒体外萌发比较Fig.4 In vitro germination of tomato pollen grains under optimum(CK,25℃/20℃)or high temperature(HS,35℃/30℃)
2.2.3 石蜡切片结果
高温胁迫处理材料与对照材料均能够正常分化花药壁的各层,药室内的花粉小孢子母细胞排列整齐(图5 A,G)。小孢子发育在四分体时期开始表现出差异。与对照相比,高温胁迫处理材料的绒毡层细胞异常肥厚(图5 H)。到了单核小孢子时期,对照材料的小孢子从胼胝质中释放出来,形状逐渐变圆,小孢子大小一致,细胞核接近小孢子中央,绒毡层开始降解并且贴近药室内壁(图5 C);此时期,高温胁迫处理材料中只有一部分小孢子从四分体中释放出来,大部分畸形并且聚集成团,绒毡层没有降解反而明显膨大、挤压进入药室内部(图5 I)。单核小孢子中后期,对照材料的小孢子相互独立分散于药室内、染色加深,绒毡层降解留下丝线状残骸,药室内壁细胞降解消退,花药表皮细胞呈细长状纵向排列,药隔细胞减少,花药同侧两药室间膈膜变薄,裂口处的环状细胞簇形成正常的圆环为花药开裂做准备(图5 D);高温胁迫处理材料中,畸形小孢子则较多、大小不一致,绒毡层细胞体积增大、具有大液泡和较大细胞核,部分绒毡层细胞相互挤压而破裂,花药表皮细胞呈方形,裂口处的环状细胞簇形成的圆环形状不规则(图5 J)。双核花粉粒时期(开花前一天),对照花粉粒充实,细胞质染色较深,仅有个别花粉粒畸形,绒毡层完全消失或仅存残余,花药同侧的两个药室之间的药隔解体,两个药室相互连通成为一体,裂口附近花药壁仅剩一层表皮细胞且排列整齐,花药开裂(图5 E);高温胁迫处理材料花药中的正常花粉粒极少,多数花粉粒畸形或停止发育,而且花粉粒被绒毡层细胞包围而积聚粘连,花药开裂但裂口不规则,裂口附近花药壁细胞畸形(图5 K)。花朵开放时,对照材料药室完全打开,都能散粉,花药维管等组织仍保持原有结构(图5 F);然而,高温胁迫材料的药室塌陷,花药表现出萎缩状(图5 L)。
对番茄小孢子发育过程的连续观察研究,表明35℃热胁迫处理影响了小孢子、绒毡层、药隔、花药壁等的正常发育,从而导致花粉粒畸形或败育,产生的正常花粉粒数量严重减少,花药散粉障碍等,进而影响花朵的正常授粉受精过程。
3 讨论
番茄品种‘Micro-Tom’由于其生长周期短,易于栽培等特性,已经成为番茄遗传与发育研究的重要模式品种。本研究通过对番茄‘Micro-Tom’小孢子细胞核形态学以及DAPI染色观察,依据核发育变化,将小孢子发育过程分为孢母细胞时期、四分体小孢子时期、单核小孢子早期、单核小孢子中后期、双核花粉粒时期和成熟花粉粒时期等6个主要时期,这与Brukhin[16]、辛建华[17]等对番茄小孢子发育主要时期的划分基本一致。依据番茄‘Micro-Tom’小孢子发育时期与花蕾外部形态、花蕾长度和花药发育特征的对应关系,划分出的小孢子发育时期依次对应于 Brukhin[16]划分的花发育阶段的 stage7-8、stage9-11、stage12-13、stage14-15、stage16-17 和stage18-20。因此,依据花蕾形态观察能够判断‘Micro-Tom’番茄小孢子发育时期,为后续番茄生殖发育分子生物学研究提供取材依据。但由于花蕾的大小会因环境的变化而存在差异[17],实验中应注意环境条件的控制,在精细实验中有必要借助于小孢子的镜检观察来准确无误地确定发育时期。
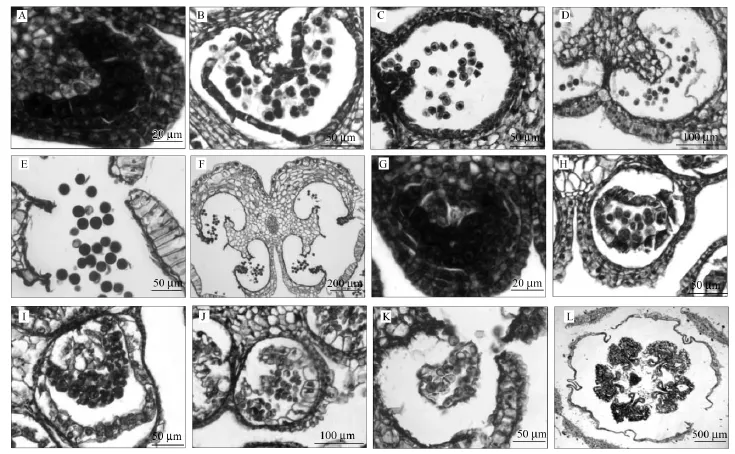
图5 番茄‘Micro-Tom’各级花蕾的石蜡切片观察Fig.5 Investigation of tomato microspores development stages using paraffin section
可育番茄小孢子在正常发育情况下,绒毡层在单核小孢子发育早期启动PCD(Programmed Cell Death)进程,不断自我降解而提供营养给小孢子发育。本研究发现,高温胁迫(35℃/30℃)后,花药绒毡层内绒毡层细胞液泡化膨大、裂口附近细胞延迟降解,而番茄小孢子畸形或败育、空瘪凹陷花粉粒数量比例大等现象。绒毡层发育异常现象在番茄雄性不育材料中的研究较多。本研究表明,热胁迫处理番茄的小孢子败育从四分体小孢子时期到花粉成熟时期均有发育异常表现,这一结果与毛秀杰[20]、袁亦楠[21]等研究的番茄雄性不育系小孢子发育异常发生在广泛时期内的结果基本一致。本研究结果表明,热胁迫处理造成花粉畸形或败育与绒毡层细胞的发育紊乱密切相关。绒毡层细胞降解延迟,未提供充足的营养物质供小孢子发育和花粉壁结构的形成,类似现象在水稻[22]、拟南芥[23-24]等作物研究中也有报道。同时,绒毡层细胞高度液泡化并向药室内生长使药室内空间变小;花朵开放花药开裂时,破碎的绒毡层细胞及其内含物使花粉粒粘连成团,该现象在本研究花粉萌发实验中同样可被观察到,表明高温胁迫不仅使花粉畸形或败育,而且使花药散粉困难。
本研究还发现,热胁迫还引起了药隔组织、药室内壁、花药表皮、环状细胞簇等花药细胞结构的发育异常。张桂莲等[25]对水稻的研究发现,水稻耐热品系在高温胁迫下花药维管组织正常,而热敏感品系在高温胁迫下花药维管组织发育异常。高温胁迫使番茄植株韧皮部形成胼胝质,胼胝质因阻塞胞间连丝而增加韧皮部的阻力[11],而高温对番茄花药维管组织发育是否有类似影响尚需研究考证。有关热胁迫引起的番茄小孢子和花药组织发育异常的分子生物学研究在本实验室还在进行中,希望有助于阐明热胁迫对番茄小孢子发育的影响机制,并为培育耐高温农作物新品种提供新途径。
[1]Peet M M,Bartholemew M.Effect of night temperature on pollen characteristics,growth and fruit set in tomato(Lycopersicon esculentum Mill.).Journal of the American Society for Horticulture Science,1996,121(3):514-519.
[2]Erickson A N,Markhart A H.Flower developmental stage and organ sensitivity of bell pepper(Capsicum annuum L.)to elevated temperature.Plant,Cell and Environment,2002,25(1):123-130.
[3]Suzuki K,Takeda H,Tsukaguchi T,Egawa Y.Ultrastructural study on degeneration of tapetum in anther of snap bean(Phaseolus vulgaris L.)under heat stress.Sexual Plant Reproduction,2001,13(6):293-299.
[4]Zinn K E,Tunc-Ozdemir M,Harper J F.Temperature stress and plant sexual reproduction:uncovering the weakest links.Journal of Experimental Botany,2010,61(7):1959-1968.
[5]Zhang G L,Chen L Y,Lei D Y,Zhang S T.Progresses in research on heat tolerance in rice.Hybrid Rice,2005,20(1):1-5.
[6]Sakata T,Takahashi H,Nishiyama I,Higashitani A.Effects of high temperature on the development of pollen mother cells and microspores in Barley Hordeum vulgare L.Journal Plant Research,2000,113(4):395-402.
[7]Wahid A,Gelani S,Ashraf M,Foolad M R.Heat tolerance in plants:an overview.Environmental and Experimental Botany,2007,61(3):199-233.
[8]Lu M H,Gong Z H,Chen R G,Huang W,Li D W.High temperature stress on crop pollen:a review.Chinese Journal of Applied Ecology,2009,20(6):1511-1516.
[9]Peet M M,Willits D H,Gardner R.Response of ovule development and post-pollen production processes in male-sterile tomatoes to chronic,subacute high temperature stress.Journal of Experimental Botany,1997,48(1):101-111.
[10]Peet M M,Sato S,Gardner R G.Comparing heat stress effects on male-fertile and male-sterile tomatoes.Plant,Cell and Environment,1998,21(2):225-231.
[11]An F X,Li J F,Xu X Y.Study on present condition of heat tolerance of tomato.Journal of Northeast Agricultural University,2005,36(4):507-511.
[12]Du Y C,Mao S L,Wang X X,Zhu D W,Li S D,Dai S S,Gao Z H.The different changes of endogenous polyamines in tomato plants with different heat-tolerance under high temperatures.Acta Horticulturae Sinica,2003,30(3):281-286.
[13]Alsadon A A,Wahb-allah M A,Khalil S O.In vitro evaluation of heat stress tolerance in some tomato cultivars.Agricultural Sciences,2006,19(1):13-24.
[14]Frank G,Pressman E,Ophir R,Althan L,Shaked R,Freedman M,Shen S,Firon N.Transcriptional profiling of maturing tomato(Solanum lycopersicum L.)microspores reveals the involvement of heat shock proteins,ROS scavengers,hormones,and sugars in the heat stress response.Journal of Experimental Botany,2009,60(13):3891-3908.
[15]Chen G J,Cheng Y J,Wu D H,Wu X Y.Microsporogenesis,megasporogenesis and male,female gametophyte development in tomato(Lycopersion esculentum).Journal of South China Agricultural University,1999,20(2):36-40.
[16]Brukhin V,Hernould M,Gonzalez N,Chevalier C,Mouras A.Flower development schedule in tomato Lycopersicon esculentum cv.sweet cherry.Sexual Plant Reproduction,2003,15(6):311-320.
[17]Xin J H,Zhang Y H,Yuan Y W.Study on interrelation of cytological development period of processing tomato microspor and morphology of flower organ.Northern Horticulture,2007,(5):15-17.
[18]Shen J,Cao G Q,Liang Q X,Ying F Q,Ding X B.Identification of cytological development period and activity of tomato's microspore.Journal of Changjiang Vegetables,2008,(16):21-24.
[19]Karapanos I C,Akoumianakis K A,Olympios C M,Passam H C.Tomato pollen respiration in relation to in vitro germination and pollen tube growth under favourable and stress-inducing temperatures.Sexual Plant Reproduction,2010,23(3):219-224.
[20]Mao X J,Liu T,Sun Z F,Yan J G.Cytological observasion on microsporogenesis of the male sterile of tomato.Seed,2009,25(8):1-3.
[21]Yuan Y N,Zhu D W,Lian Y,Dai S S,Lu C X.Cytological investigations on microspore development in the male sterile L.esculentum vat.95305.Acta Agriculturae Boreall-Sinica,2000,15(3):61-65.
[22]Li N,Zhang D S,Liu H S,Yin C S,Li X X,Liang W Q,Yuan Z,Xu B,Chu H W,Wang J,Wen T Q,Huang H,Luo D,Ma H,Zhang D B.The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development.The Plant Cell,2006,18(11):2999-3014.
[23]Vizcay-Barrena G,Wilson Z A.Altered tapetal PCD and pollen wall development in the Arabidopsis ms1 mutant.Journal of Experimental Botany,2006,57(11):2709-2717.
[24]Xu J,Yang C Y,Yuan Z,Zhang D S,Gondwe M Y,Ding Z W,Liang W Q,Zhang D B,Wilson Z A.The ABORTED MICROSPORES regulatory network is required for postmeiotic male reproductive development in Arabidopsis thaliana.The Plant Cell,2010,22(1):91-107.
[25]Zhang G L,Chen L Y,Zhang S T,Liu G H,Tang W B,Li M H,Lei D Y,Chen X B.Effects of high temperature stress on pollen characters and anther microstructure of rice.Acta Ecologica Sinica,2008,28(3):1089-1097.
参考文献:
[5]张桂莲,陈立云,雷东阳,张顺堂.水稻耐热性研究进展.杂交水稻,2005,20(1):1-5.
[8]逯明辉,巩振辉,陈儒钢,黄炜,李大伟.农作物花粉高温胁迫研究进展.应用生态学报,2009,20(6):1511-1516.
[11]安凤霞,李景富,许向阳.番茄耐热性研究现状.东北农业大学学报,2005,36(4):507-511.
[12]杜永臣,毛胜利,王孝宣,朱德蔚,李树德,戴善书,高振华.高温胁迫下耐热性不同番茄多胺水平变化的差异.园艺学报,2003,30(3):281-286.
[15]陈国菊,程玉瑾,吴定华,吴筱颖.番茄大、小孢子的发生及雌、雄配子体的发育.华南农业大学学报,1999,20(2):36-40.
[17]辛建华,张永华,苑育文.加工番茄小孢子发育时期与花器形态相关性研究.北方园艺,2007,(5):15-17.
[18]申娟,曹刚强,梁秋霞,应芳卿,丁晓兵.番茄小孢子发育时期的检测和活性鉴定.长江蔬菜,2008,(16):21-24.
[20]毛秀杰,刘婷,孙中峰,闫建国.番茄雄性不育系JL-2小孢子发育的细胞学观察.种子,2009,25(8):1-3.
[21]袁亦楠,朱德蔚,连勇,戴善书,陆长旬.番茄雄性不育突变体小孢子发育的细胞学研究.华北农学报,2000,15(3):61-65.
[25]张桂莲,陈立云,张顺堂,刘国华,唐文邦,李梅华,雷东阳,陈信波.高温胁迫对水稻花粉粒性状及花药显微结构的影响.生态学报,2008,28(3):1089-1097.
