Toll样受体研究与疫苗研发
2013-05-09梁争论
邵 杰,吴 星,梁争论
Toll样受体研究与疫苗研发
邵 杰,吴 星,梁争论
疫苗是控制传染病的主要手段,但目前疫苗的研发仍然处于经验阶段,多数疫苗的免疫机制尚不十分清楚,传统疫苗的研发思路在新型 HIV、HCV 等疫苗的研发中遭遇瓶颈,难以取得突破。Toll 样受体(TLRs)是模式识别受体(pattern recognition receptor,PRRs)的一种。TLRs 信号通路的激活,不仅诱导机体产生炎症反应,同时也促进 DC的成熟与 Th 细胞的分化,进而产生获得性免疫应答,因此有研究认为其处于沟通固有免疫与获得性免疫的核心地位[1]。研究表明,同时激活多条 TLRs 通路的疫苗具有更好的免疫效果,黄热疫苗的高免疫原性与其可同时激活树突状细胞(DC)多条 TLRs 通路相关[2]。在对麻疹、风疹、乙肝等疫苗免疫应答机制的研究中,也均发现存在特异激活的 TLRs 信号通路。TLRs 与下游接头分子的单核苷酸多态性,可影响乙肝、麻疹等疫苗效果,可能是该疫苗免疫无应答及低应答现象产生的原因。由于 TLRs 在诱导固有免疫的重要作用,目前研发的新型疫苗佐剂几乎均为 TLRs 的配体[3]。对 TLRs 作用机制的研究有助于深入认识疫苗的免疫机制,改进疫苗研发和评价的思路。本文对 TLRs 在疫苗免疫机制研究中的进展进行综述。
1 TLRs 概述
TLRs 为模式识别受体的一个重要家族,在宿主免疫细胞对微生物病原体识别以及应答过程中起到重要作用。Toll蛋白最早由法国科学家 Hoffmann 于 1996 年在研究果蝇时首先发现,该蛋白可识别病原微生物并激活机体的先天免疫,其研究成果发表在当年的 Cell 杂志上[4]。两年后,美国科学家 Beutler 证实哺乳动物小鼠中也存在类似的基因,且编码的受体蛋白同样能激活机体的天然免疫[5]。由于发现了 TLRs,两位科学家获得了 2011 年的诺贝尔医学或生理学奖。至今为止,人类已被确认的 TLRs 有 11 种,小鼠有 13 种[6]。TLRs 主要在固有免疫细胞表达,包括:DC、肥大细胞、巨噬细胞、中性粒细胞、内皮细胞、纤维母细胞等[7-12];以及获得性免疫细胞,如:T 淋巴细胞、B 淋巴细胞等[13]。此外,在一些神经细胞中也发现 TLRs 表达[14]。不同的 TLRs 在细胞上的位置不同:TLR 1、2、4、5 和6 位于细胞表面,而 TLR 3、7、8 和 9 则主要位于细胞内[8, 10]。
目前发现的 TLRs 皆为 I 型跨膜蛋白,膜外包含一个不同长度的富含亮氨酸的重复序列(LRR domain);膜内包括一个与白介素-1 受体(IL-1R)同源的结构域(TIR domain)[15]。TLRs 的胞外区之间存在较大的差异性,如人的 TLR2 和 TLR4 的胞外区仅有 24% 同源,这可能是不同配体激活不同受体的结构基础。不同种属 TLRs 基因胞外区也存在显著差异,例如人和小鼠的 TLR4 胞外区仅53% 相同,而胞质区同源性为 83%,可能是不同生物对相同病原体侵袭反应不同的机制之一[16]。
TLRs 可以广泛地识别许多细菌、真菌以及病毒的保守结构,不同的 TLRs 识别特异的配体。一般认为:TLR1或 TLR6 与 TLR2 协同识别脂肽类(lipopeptides);TLR3的配体为双链的 RNA;TLR4 的配体为细菌脂多糖(lipopolysaccharides,LPS);TLR5 的配体为鞭毛蛋白(flagellin);TLR7 与 TLR8 的配体为单链 RNA 分子;TLR9 的配体为细菌或病毒的非甲基化 CpG 序列[14]。随着对 TLRs 认识的不断深入,一些新的 TLR 配体被不断发现,2011 年 Kawai 与 Akira[6]对 TLRs 识别的 PAMP 重新进行了总结(表 1)。
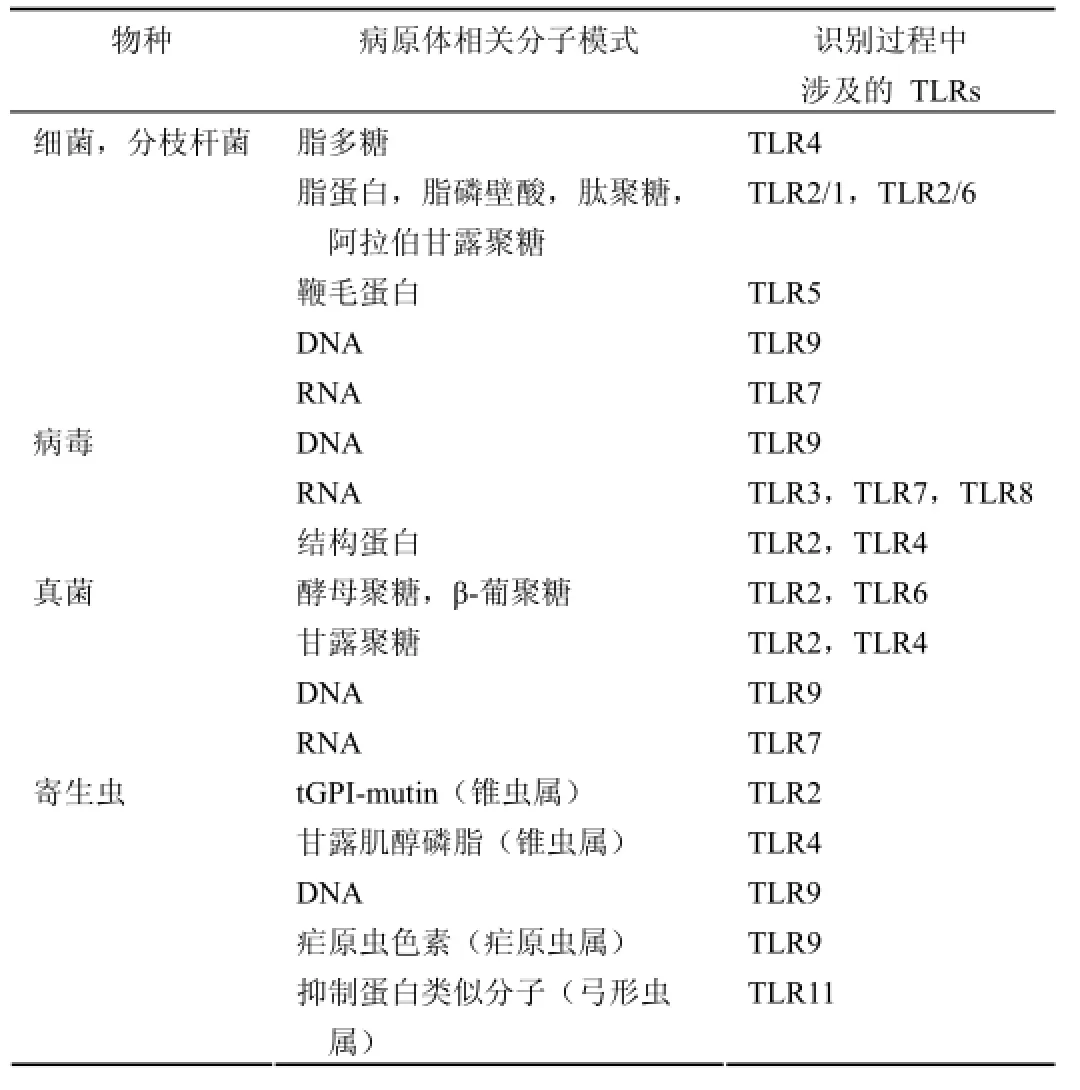
表1 TLRs 识别的病原体相关分子模式
大多数关于 TLRs 信号通路的信息是通过对 HEK 293细胞过表达体系以及 TLR 基因敲除小鼠的研究获得的[14]。TLRs 信号通路的激活不仅诱导机体产生炎症反应,同时也促进 DC 的成熟与 Th 细胞的分化,进而产生获得性免疫应答[17]。TLRs 信号通路可简要概括为:特异配体与相应的 TLR 结合,使得 TLRs 活化;TLR 的活化可激活MyD88、MAL、TRIF、TRAM 和 SARM[11,18]等中间调控因子;这些中间调控因子的激活最终引起转录因子 IRF3、IRF7、AP-1 和 NF-κB 等活化;炎症因子 TNF-β、IL-6、IL-1β 和 IL-12 等基因表达增强;协同刺激分子,如:DC 表面的 CD80、CD86 和 CD40 表达上调,从而活化 DC。活化的 DC 可产生不同的细胞因子和化学激活因子,如:TLR2 刺激 DC 优先表达 IL-8 和IL-23,TLR4 主要刺激产生 IL-12p70,IFN-γ 介导蛋白(IP210)及 IFN-β。这些可溶性细胞因子诱导 T 辅助细胞(Th)向有利于清除病原体的方向分化,进而产生获得性免疫应答[19-21]。
2 TLRs 与疫苗免疫机制的研究
目前上市的疫苗包括:减毒活疫苗、灭活疫苗和重组蛋白疫苗三种。减毒活疫苗是指毒力被减弱的菌株或病毒株,可在机体内生长繁殖,但不会引起疾病发生。当其进入体内后,可以与自然感染天然病原体一样激活 PRR 通路,诱导机体产生固有免疫,然后增殖进入主动免疫部位,被 DC 或其他抗原提呈细胞(APC)捕获并转移至淋巴器官,将抗原呈递给 B 与 T 淋巴细胞,产生获得性免疫应答。Leavy[22]认为同时激活多条 TLRs 通路的疫苗具有更好的免疫效果,比如黄热减毒活疫苗 YF-17D,可同时通过 TLR 2、7、8、9 途径活化 DC,促使 DC 分泌促炎症因子(IL)-12p40、IL-6、INF-α,进而引起多种不同的获得性免疫应答反应[2]。
灭活疫苗是指培养获得的病原微生物经甲醛或加热等方式灭活后制备成的疫苗。有效成分是灭活病原体颗粒,在体内无法增殖。虽然也有报道指出某些灭活疫苗可激活特异的 TLRs 通路,目前仍普遍认为其激活 PRR 的能力较差,需要添加佐剂以获得更好的疫苗免疫效果[17]。
重组蛋白疫苗指运用 DNA 重组技术,把病原微生物的遗传物质定向插入细菌、酵母菌或哺乳动物细胞等表达体系中表达,收获表达产物纯化制成的疫苗。基因工程疫苗可通过 TLRs 启动有效疫苗免疫应答,并且不同表达系统或不同构建模式疫苗可诱导不同的 TLRs 应答。Mizukoshi等[23]发现酵母表达的 HIV VLP 通过 DCs 的 TLR2 诱导免疫应答,而 Aricò 等[24]发现杆状病毒表达的 HIV-1 Pr55gag VLPs 则通过 DCs TLR3 和 TLR9 诱导疫苗免疫应答。一般认为基因工程疫苗刺激机体识别“非己”的能力较差,导致较差的免疫活性,为提高其免疫效率,一些研究者将目光放在了研究新型佐剂和运载系统中[25]。
3 TLRs 与新型疫苗佐剂
新型疫苗佐剂的研发与应用是近些年来疫苗学中的一个研究热点,目前研发的新型疫苗佐剂几乎皆为TLRs 的配体[3,26]。与目前广泛使用的传统铝佐剂相比,TLR 配体型佐剂存在明显优势:TLRs 配体能够沟通固有免疫与获得性免疫,同时降低直接由炎症反应引起的不良反应;与铝佐剂主要激活 Th2 介导的免疫应答反应不同,TLR 配体型佐剂可同时激活 Th1、Th3(T-reg)介导的免疫通路,作用更加全面[27-28]。对 TLR 配体型佐剂的研发主要通过对天然TLRs 配体进行化学修饰或由人工合成小分子配体实现。
目前较为成功的 TLR 配体型佐剂包括:单磷酰脂 A(monophosphoryl lipid A,MPL)为 TLR4 配体,可激活TRAM 和 TRIF 信号通路,起到与 LPS 相似的效果,同时明显减弱促炎症的 MYD-88 依赖的信号通路[29]。MPL还能促进 Th1 应答,促进细胞免疫,因此在许多疫苗的研发中都将其作为一个最可能的佐剂,在疟疾、结核、艾滋以及利什曼病疫苗的研发中皆有类似的报道[27]。MPL 经氢氧化铝或磷酸铝吸附后,称为 AS04 佐剂,已经在预防性的乙肝疫苗、人乳头瘤病毒(HPV)疫苗、单纯疱疹病毒(HSV)疫苗、艾巴病毒(EBV)疫苗、诺瓦克病毒(NLV)疫苗上进行了评价,葛兰素史克公司生产的添加了 AS04 佐剂的乙肝疫苗 Fendrix 已在欧盟获得批准[30-34]。与之相似的TLR4 配体佐剂还有:用于预防性乙肝疫苗的 RC-529 佐剂,已在阿根廷获得批准[35];E6020 佐剂,主要激活 Th1 型体液免疫途径,作为三价流感疫苗与脑膜炎疫苗的佐剂,表现出良好的安全性与有效性[36-37]。TLR3 配体佐剂 POLY(I•C)为一段人工合成的双链 RNA 分子类似物,可激活Th1 介导的细胞免疫应答,作为重组 H5N1 流感疫苗佐剂,在攻毒小鼠上起到了良好的保护效果[38]。TLR5 配体佐剂鞭毛蛋白,可激活 NF-κB 信号通路,鞭毛蛋白作为灭活流感疫苗的佐剂,能够有效保护攻毒小鼠[39]。关于 TLR7,8 配体佐剂咪唑喹啉可增强 Th1 介导的体液与细胞免疫也有报道[40-41]。另一种获得批准的 TLR 配体佐剂为非甲基化的CpG,它是 TLR9 的配体,已获准应用于炭疽疫苗中[42]。
4 TLRs 多态性影响疫苗免疫效果
随着分子生物学技术的发展,以基因组学、蛋白组学为代表的一些高通量技术应用于疫苗学的研究中,TLR 基因多态性与疫苗免疫效果间的关系也得以揭示。Chen 等[43]对乙肝疫苗无应答人群与正常应答人群的遗传信息进行了比较,发现两组人群间 TLR2 基因存在差异,认为 TLR2基因的单核苷酸多态性(SNP),很可能是两组人群对同一种乙肝疫苗的免疫应答出现差异的原因。Dhiman 等[44]对麻疹疫苗研究发现,TLR3 以及其下游的胞内信号分子MYD88 和 MD2 基因 SNP 与麻疹疫苗体液及细胞免疫水平皆相关;TLR4 基因 SNP 可能导致机体感染麻疹疫苗株后,IL-4 分泌水平发生变化。在风疹疫苗的研究中也有类似报道,Ovsyannikova 等[45]发现 TLRs 以及维生素A、D 受体的 SNP 与接种疫苗后获得性免疫相关细胞因子表达水平相关。接种百日咳疫苗的考拉幼崽血清中和抗体水平同样受到 TLR4 启动子区域及其下游信号分子基因型的影响[46]。TLRs 基因 SNP 影响疫苗免疫效果,不仅从侧面证实了 TLRs 在疫苗免疫应答中发挥重要作用,也为疫苗低应答与无应答现象提供了一种解释。
5 结语
新型疫苗研发时间漫长且风险巨大,在疫苗研发阶段科学预测疫苗免疫效果以及安全性是疫苗企业缩短研发周期、降低研发成本的有效途径。近年来各种基因、蛋白等组学技术和免疫学研究进展迅速,为依据固有免疫应答预测疫苗的安全性和免疫效果提供了基础。TLRs 在疫苗诱导的固有免疫应答中发挥关键作用,为新型疫苗佐剂研究的重点,因此开展 TLRs 在疫苗应答中作用的研究对促进疫苗学的发展具有重要意义。
[1] Beutler B. Inferences, questions and possibilities in Toll-like receptor signalling. Nature, 2004, 430(6996):257-263.
[2] Kasturi SP, Skountzou I, Albrecht RA, et al. Programming the magnitude and persistence of antibody responses with innate immunity. Nature, 2011, 470(7335):543-547.
[3] Hedayat M, Netea MG, Rezaei N. Targeting of Toll-like receptors: a decade of progress in combating infectious diseases. Lancet Infect Dis, 2011, 11(9):702-712.
[4] Lemaitre B, Nicolas E, Michaut L, et al. The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell, 1996, 86(6):973-983.
[5] Poltorak A, He X, Smirnova I, et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science, 1998, 282(5396):2085-2088.
[6] Kawai T, Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity, 2011, 34(5): 637-650.
[7] Pashine A, Valiante NM, Ulmer JB. Targeting the innate immune response with improved vaccine adjuvants. Nat Med, 2005, 11 (4 Suppl):S63-S68.
[8] Iwasaki A, Medzhitov R. Regulation of adaptive immunity by the innate immune system. Science, 2010, 327(5963):291-295.
[9] Pulendran B, Tang H, Manicassamy S. Programming dendritic cells to induce T(H)2 and tolerogenic responses. Nat Immunol, 2010, 11(8): 647-655.
[10] Pulendran B, Ahmed R. Translating innate immunity into immunological memory: implications for vaccine development. Cell, 2006, 124(4):849-863.
[11] Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell, 2006, 124(4):783-801.
[12] Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat Immunol, 2010, 11(5): 373-384.
[13] Henault M, Lee LN, Evans GF, et al. The human Burkitt lymphoma cell line Namalwa represents a homogenous cell system characterized by high levels of Toll-like receptor 9 and activation by CpG oligonucleotides. J Immunol Methods, 2005, 300(1-2):93-99.
[14] McCoy CE, O'Neill LAJ. Toll-like receptors -- methods and protocols. New York: Humana Press, 2009:447.
[15] Kang JY, Lee JO. Structural biology of the Toll-like receptor family. Annu Rev Biochem, 2011, 80:917-941.
[16] Kubarenko A, Frank M, Weber AN. Structure-function relationships of Toll-like receptor domains through homology modelling and molecular dynamics. Biochem Soc Trans, 2007, 35(Pt 6):1515-1518.
[17] Buonaguro L, Pulendran B. Immunogenomics and systems biology of vaccines. Immunol Rev, 2011, 239(1):197-208.
[18] Sasai M, Yamamoto M. Pathogen recognition receptors: ligands and signaling pathways by Toll-like receptors. Int Rev Immunol, 2013, 32(2):116-133.
[19] Stokes JA, Corr M, Yaksh TL. Spinal toll-like receptor signaling and nociceptive processing: regulatory balance between TIRAP and TRIF cascades mediated by TNF and IFNβ. Pain, 2013, 154(5):733-742.
[20] Marcondes MC, Spina C, Bustamante E, et al. Increased toll-like receptor signaling pathways characterize CD8+ cells in rapidly progressive SIV infection. Biomed Res Int, 2013, 2013:796014.
[21] Li LC, Varghese Z, Moorhead JF, et al. Cross-talk between TLR4-MyD88-NF-κB and SCAP-SREBP2 pathways mediates macrophage foam cell formation. Am J Physiol Heart Circ Physiol, 2013, 304(6):H874-H884.
[22] Leavy O. Vaccines: dual TLR hit for vaccine success. Nat Rev Immunol, 2011, 11(4):234-235.
[23] Mizukoshi F, Yamamoto T, Mitsuki YY, et al. Activation of HIV-1 Gag-specific CD8+ T cells by yeast-derived VLP-pulsed dendritic cells is influenced by the level of mannose on the VLP antigen. Microbes Infect, 2009, 11(2):191-197.
[24] Aricò E, Wang E, Tornesello ML, et al. Immature monocyte derived dendritic cells gene expression profile in response to Virus-Like Particles stimulation. J Transl Med, 2005, 3:45.
[25] Harandi AM, Davies G, Olesen OF. Vaccine adjuvants: scientific challenges and strategic initiatives. Expert Rev Vaccines, 2009, 8(3): 293-298.
[26] Mbow ML, De Gregorio E, Valiante NM, et al. New adjuvants for human vaccines. Curr Opin Immunol, 2010, 22(3):411-416.
[27] Casella CR, Mitchell TC. Putting endotoxin to work for us: monophosphoryl lipid A as a safe and effective vaccine adjuvant. Cell Mol Life Sci, 2008, 65(20):3231-3240.
[28] Lahiri A, Das P, Chakravortty D. Engagement of TLR signaling as adjuvant: towards smarter vaccine and beyond. Vaccine, 2008, 26(52): 6777-6783.
[29] Mata-Haro V, Cekic C, Martin M, et al. The vaccine adjuvant monophosphoryl lipid A as a TRIF-biased agonist of TLR4. Science, 2007, 316(5831):1628-1632.
[30] Garcon N, Chomez P, Van Mechelen M. GlaxoSmithKline Adjuvant Systems in vaccines: concepts, achievements and perspectives. Expert Rev Vaccines, 2007, 6(5):723-739.
[31] Paavonen J, Naud P, Salmerón J, et al. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet, 2009, 374(9686):301-314.
[32] Wheeler CM, Castellsagué X, Garland SM, et al. Cross-protective efficacy of HPV-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by non-vaccine oncogenic HPV types: 4-year end-of-study analysis of the randomised, double-blind PATRICIA trial. Lancet Oncol, 2012, 13(1):100-110.
[33] El-Kamary SS, Pasetti MF, Mendelman PM, et al. Adjuvanted intranasal Norwalk virus-like particle vaccine elicits antibodies and antibody-secreting cells that express homing receptors for mucosal and peripheral lymphoid tissues. J Infect Dis, 2010, 202(11):1649-1658.
[34] Sow PS, Watson-Jones D, Kiviat N, et al. Safety and immunogenicity of human papillomavirus-16/18 AS04-adjuvanted vaccine: a randomized trial in 10-25-year-old HIV-Seronegative African girls and young women. J Infect Dis, 2013, 207(11):1753-1763.
[35] Johnson DA. Synthetic TLR4-active glycolipids as vaccine adjuvants and stand-alone immunotherapeutics. Curr Top Med Chem, 2008, 8(2):64-79.
[36] Singh M, Kazzaz J, Ugozzoli M, et al. MF59 oil-in-water emulsion in combination with a synthetic TLR4 agonist (E6020) is a potent adjuvant for a combination Meningococcus vaccine. Hum Vaccin Immunother, 2012, 8(4):486-490.
[37] Baudner BC, Ronconi V, Casini D, et al. MF59 emulsion is an effective delivery system for a synthetic TLR4 agonist (E6020). Pharm Res, 2009, 26(6):1477-1485.
[38] Asahi-Ozaki Y, Itamura S, Ichinohe T, et al. Intranasal administration of adjuvant-combined recombinant influenza virus HA vaccine protects mice from the lethal H5N1 virus infection. Microbes Infect, 2006, 8(12-13):2706-2714.
[39] Skountzou I, Martin Mdel P, Wang B, et al. Salmonella flagellins are potent adjuvants for intranasally administered whole inactivated influenza vaccine. Vaccine, 2010, 28(24):4103-4112.
[40] Boghdadi G, Khalik DA, Wahab SA, et al. Immunomodulatory effect of R848 on cytokine production associated with Schistosoma mansoni infection. Parasitol Res, 2013, 112(1):135-140.
[41] Jähnisch H, Wehner R, Tunger A, et al. TLR7/8 agonists trigger immunostimulatory properties of human 6-sulfo LacNAc dendritic cells. Cancer Lett, 2013, 335(1):119-127.
[42] Cooper CL, Davis HL, Morris ML, et al. Safety and immunogenicity of CPG 7909 injection as an adjuvant to Fluarix influenza vaccine. Vaccine, 2004, 22(23-24):3136-3143.
[43] Chen J, Liang Z, Lu F, et al. Toll-like receptors and cytokines/cytokine receptors polymorphisms associate with non-response to hepatitis B vaccine. Vaccine, 2011, 29(4):706-711.
[44] Dhiman N, Ovsyannikova IG, Vierkant RA, et al. Associations between SNPs in toll-like receptors and related intracellular signaling molecules and immune responses to measles vaccine: preliminary results. Vaccine, 2008, 26(14):1731-1736.
[45] Ovsyannikova IG, Dhiman N, Haralambieva IH, et al. Rubella vaccine-induced cellular immunity: evidence of associations with polymorphisms in the Toll-like, vitamin A and D receptors, and innate immune response genes. Hum Genet, 2010, 127(2):207-221.
[46] Banus S, Bottema RW, Siezen CL, et al. Toll-like receptor 4 polymorphism associated with the response to whole-cell pertussis vaccination in children from the KOALA study. Clin Vaccine Immunol, 2007, 14(10):1377-1380.
10.3969/cmba.j.issn.1673-713X.2013.04.010
“十二五”国家科技重大专项(2012ZX10004701)
100050 北京,中国食品药品检定研究院卫生部生物技术质量控制重点实验室
梁争论,Email:lzlun@yahoo.com
2013-05-06
