大豆提取液中大豆黄素的紫外分光光度测定法
2013-05-07蒋盼顾建明
蒋盼,顾建明
(上海大学生命科学学院,上海200444)
异黄酮(isoflavone)在自然界中的分布只局限于豆科的蝶形花亚科等少数植物中,其中含量较高的有苜蓿、红三叶草和大豆(Giycine max(L)Merrill)。大豆异黄酮主要分布于大豆种子的子叶和胚轴中,种皮中含量极少,是大豆生长过程中形成的次级代谢产物,属黄酮类中的异黄酮多酚化合物,是大豆中主要的生理活性物质。在大豆中存在十二种异黄酮,按照结构可以分为四类:游离型异黄酮苷元(aglucone)、葡萄糖苷(glucoside)、乙酰基葡萄糖苷(acetylglucoside)和丙二酰基葡萄糖苷(malonylucoside)。其中对人体的起主要生理作用的是游离型异黄酮苷元[1-5]:染料木素(genistein),大豆黄素(daidzein),黄豆黄素(glycitein)。
近年来,动物实验、体外实验以及临床实验的研究表明,大豆异黄酮对人体具有保健功能,主要有:(1)雌激素样作用,由于其结构与女性雌激素内源雌二醇相似,能维持女性雌激素水平的平衡,缓解妇女更年期综合症[6-7];(2)预防骨质酥松症[8-9];(3)调节血脂以及抗动脉粥样硬化[10-11];(4)抗氧化活性[12-13];(5)缓解心血管疾病[14];(6)抗癌作用[15-16]等。
在日常生活中,大豆制品是人们摄取大豆异黄酮的主要膳食来源,研究表明,加工过程会造成大豆异黄酮的显著损失,其中,浸泡使12%的大豆异黄酮流失于浸泡水中;凝固使44%大豆异黄酮丢失于乳清溶液中[17-18],这些含保健功能物质的废弃排放物也污染了环境,因此,豆制品加工过程中大豆异黄酮的回收利用具有研究价值。
目前检测大豆异黄酮常用的方法[19]有紫外分光光度法和高效液相色谱法。高效液相色谱法灵敏、重现性好,但需要专门的人员操作维护,成本高。紫外分光光度法简单、方便、快速但精密度低。本实验旨在通过研究大豆提取液中大豆黄素的紫外分光光度和HPLC测定结果间的差异,建立一新的准确的大豆黄素的紫外分光光度测定法。这对工业化豆制品加工生产中准确、方便、快速检测、回收和利用大豆异黄酮资源都具有十分重要的意义。
1 材料和方法
1.1 实验材料和仪器
黄豆(当地超市购买);甲醇(色谱纯),乙腈(色谱纯),浓磷酸(分析纯,≥85%),BHT(色谱纯,purity≥99%);大豆黄素(daidzein,purity≥99%)购自田同生化技术有限公司。
UV-754紫外可见分光光度计,恒温干燥箱,水浴锅,YXJ-1 型低速离心机,AB104(METTL ER-TOLEDO Group,Max101g,d=0.1mg) 电子分析天平,LC-20A(SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵)高效液相色谱仪:日本岛津。
1.2 实验方法
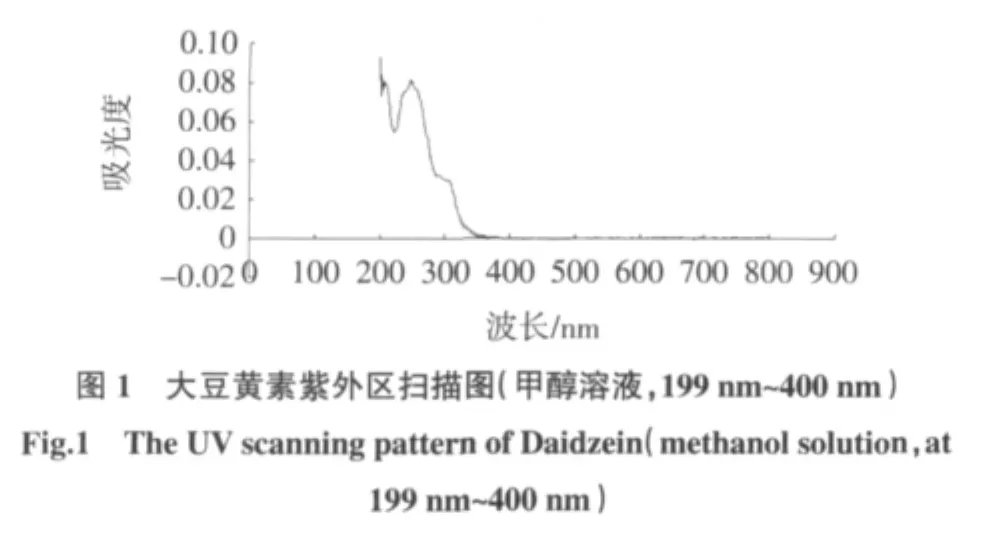
1.2.1 大豆黄素紫外吸收波长的测定
准确称取大豆异黄酮标准样品大豆黄素5 mg,甲醇溶解后,定容于50 mL容量瓶中,配置成0.1 mg/mL的母液。在199 nm~400 nm紫外区扫描。4℃下保存[20]。
1.2.2 标准曲线的绘制
1.2.2.1 高效液相色谱法
准确吸取 1.0、2.0、4.0、6.0、8.0、10.0 mL 1.2.1 中配置的母液于10 mL容量瓶中,甲醇定容,配置成1、2、4、6、8、10 μg/mL 的标准品溶液。用 Ф13 mm,孔径为0.45μm的有机针孔过滤器过滤于进样瓶中,在色谱柱CLC-NH2(Ф6 mm×150 mm),流动相:V乙腈∶V0.001%磷酸=28∶72,流速 0.7 mL/min,柱温 40 ℃,检测波长 230 nm条件下,进样10 μL进行测定,绘制浓度与峰面积的标准曲线。
1.2.2.2 紫外分光光度法
将1.2.2.1中的大豆黄素标准溶液用UV-754紫外可见分光光度计在特定波长下测定吸光度值A,其中波长为1.2.1扫描图中读出的最大吸收波长,绘制浓度与吸光度值的标准曲线。
1.2.3 样品的制备和测定
压制黄豆至厚度为0.35 cm,称取50 g于烧杯中。往烧杯中添加水(第一次加120 mL,以后每次加100 mL),置50℃水浴中,每隔20 min收集一次浸泡液,重复10次。收集浸提液后,4℃下保存。
取20 mL浸提液,加入25 mL甲醇溶液,50 mL,4 mol/L盐酸溶液,0.75 g BHT。44.6℃下水浴回流3 h,过滤,收集上清液,用甲醇定容至100 mL[21]。4℃下保存。取处理好的黄豆浸提液,在相同色谱条件下测定其大豆黄素的峰面积;在相同紫外波长条件下测定吸光度值。
1.2.4 紫外和HPLC测定方法的比较
将黄豆浸提液按表1准确稀释成6种不同浓度样品,该系列浓度涵盖UV和HPLC标准曲线的有效范围。在最大吸收波长下用紫外法测量它们的吸光度值A,根据1.2.2.2绘制的紫外标准曲线计算出各稀释样品的浓度值,每种稀释样品重复测定5次。同样也用HPLC法测得各稀释样品的浓度值,每种稀释样品重复测定5次。对每种稀释样品的紫外和HPLC测定值间进行差异性检验(t检验法)。
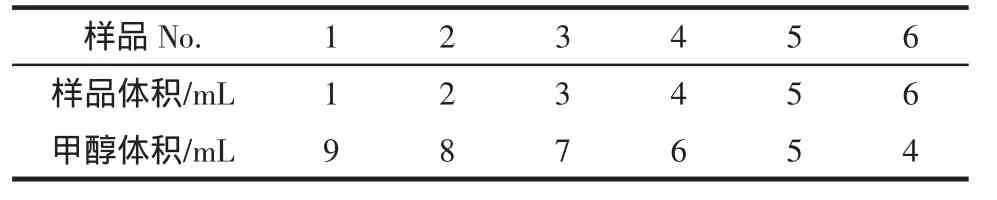
表1 黄豆浸提液样品的制备Table 1 Dilution factor of soy extraction sample
1.2.5 紫外法标准曲线的矫正方法
设HPLC标准曲线方程为YHPLC=k1XHPLC+b1,紫外标准曲线方程为Y紫外=k2X紫外+b2,矫正后的的紫外标准曲线为Y=kX+b,用表1中样品1和样品5紫外和HPLC测得的值代入矫正后的方程得下列二元一次方程组:

解此方程组,得k和b值,即可求得矫正后的紫外标准曲线方程Y=kX+b,再按1.2.4的测定程序,检测矫正后的紫外标准曲线测得值与HPLC测得值间是否存在差异。
1.2.6 精密度和准确度测定
准确吸取黄豆浸提液样品1 mL于甲醇定容至10 mL,在最大吸收波长下测定其吸光度值A,并根据1.2.5绘制的曲线计算其浓度,重复5次,计算RSD值。
取黄豆浸提泡液1 mL 6份于10 mL具塞试管中,再分别准确加入 1.2.2.1 中标准品溶液 1、1、1、2、2、2 mL,用甲醇定容至10 mL,混匀后在最大吸收波长下测定吸光度值A。根据1.2.5绘制的标准曲线计算大豆黄素的浓度值,按(测得大豆黄素量-原样品量)/加样量×100%计算回收率。
2 结果与讨论
2.1 大豆黄素的紫外吸收波长
大豆黄素在248 nm处有最大吸收值,如图1。
2.2 两种测定方法的标准曲线
2.2.1 高效液相色谱法
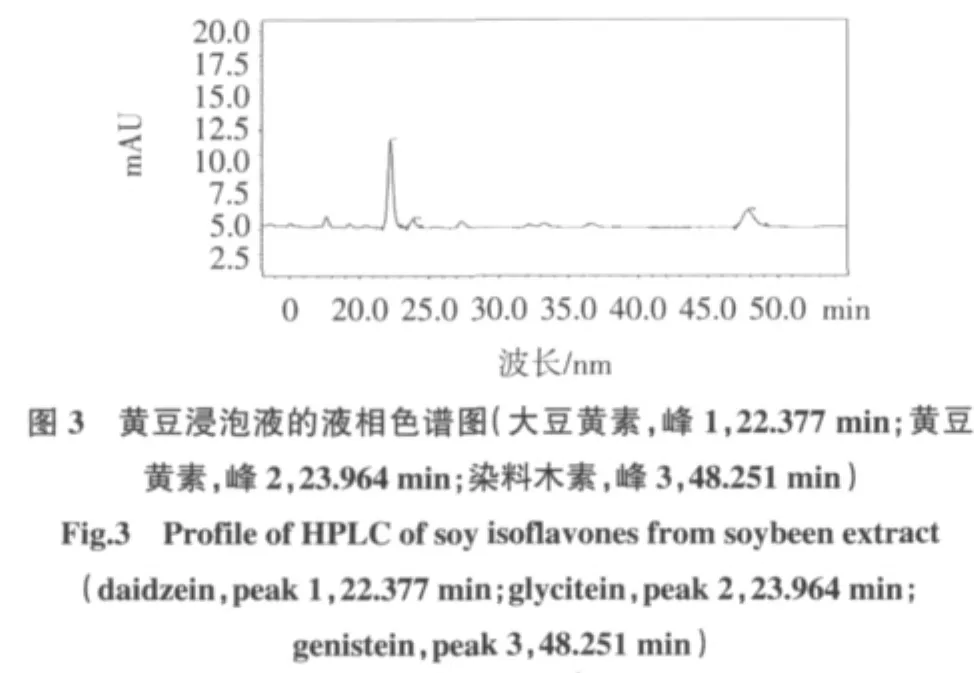
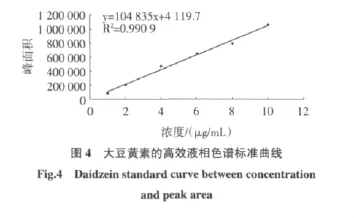
高效液相色谱法测定结果见图2、图3、图4。

HPLC法测得的大豆黄素浓度与峰面积方程为y=104 835x+4 119.7,R2=0.990 9,浓度与峰面积呈较好的线性关系,大豆黄素的高效液相色谱标准曲线见图4。
2.2.2 紫外分光光度法
紫外分光光度法法测得的大豆黄素浓度与吸光度分别为y=6.959x-0.002 7,R2=0.997 7,浓度与吸光度呈较好的线性关系,如图5。
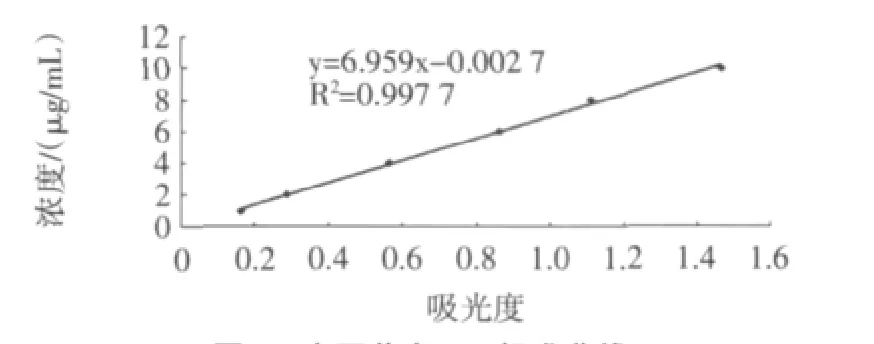
图5 大豆黄素UV标准曲线Fig.5 Daidzein standard curve between concentration and absorbency
2.3 两种方法测定样品浓度值的差异性及其矫正
表2选取列出了大豆浸提液稀释液样品2、4、6紫外法和HPLC法测得的浓度值和差异性,查表得t0.01,5=4.032 1,计算得出的 t均大于 t0.01,5,即用 2.2.2中的 UV和HPLC标准曲线方程测得的浓度值间存在极显著性差异,因此,需要对原紫外吸光度与浓度的标准曲线方程进行矫正。
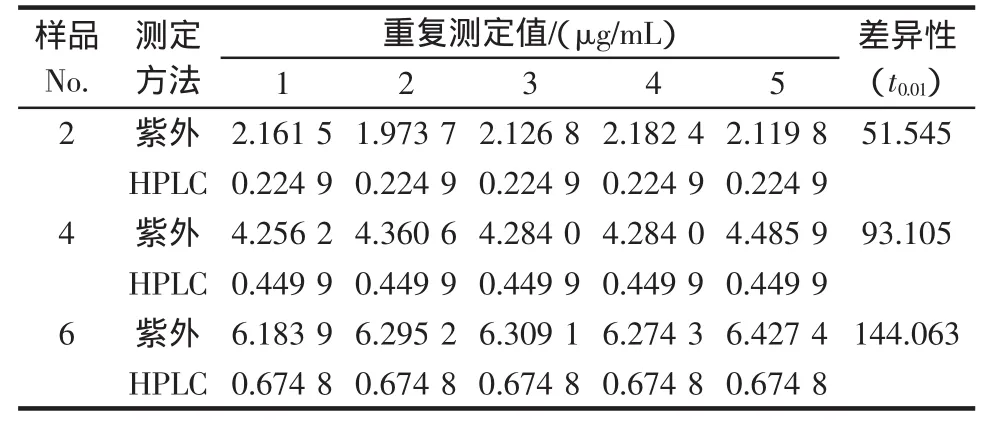
表2 第2、4、6号样品紫外和HPLC测定值间的比较Table 2 The daidzein content difference by UV and HPLC(sample 2,4,6)
按照1.2.5中方法对原紫外法曲线进行矫正,得到新的紫外法标准曲线方程为y=0.706 1x+0.012 5(见图6)。采用此方程测得的大豆浸提液稀释样品浓度值与HPLC测得的值差异性分析见表3(表中仅列出稀释样品 1,3,5),t均小于 t0.01,5,UV 法与 HPLC 法测定值间已无显著性差异。

2.4 精密度和准确度
矫正后紫外法测定大豆黄素的精密度和准确度测定结果分别见表4和表5,平均回收率为99.128%。

表3 第1、3、5号样品紫外(矫正后)和HPLC测定值间的比较Table 2 The daidzein content difference by UV(corrected)and HPLC(sample 1,3,5)

表4 大豆黄素的精密度Table 4 Precision of daidzein detection
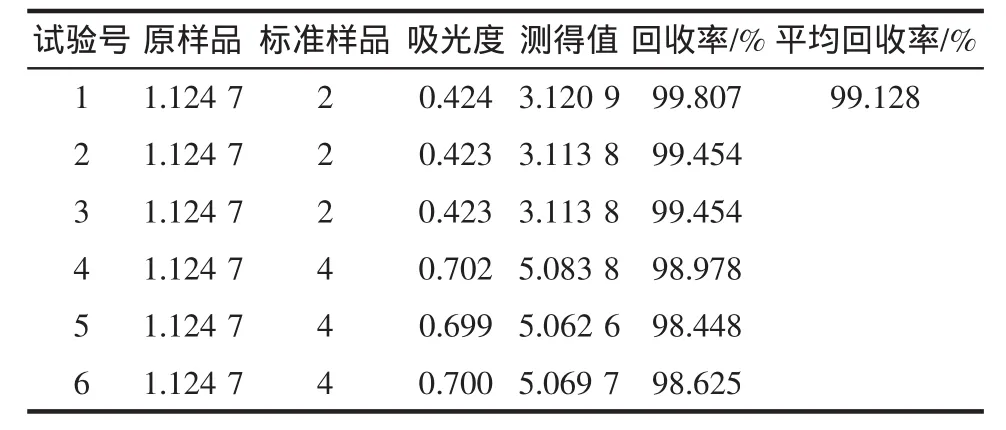
表5 大豆黄素曲线的准确度(×10-3mg)Table 5 Accuracy of daidzein detection(×10-3mg)
大豆浸提液中不仅含有大豆黄素,还含有黄豆黄素、染料木素等大豆异黄酮,这些黄酮类物质由于含有苯环,在248 nm处都有弱紫外吸收,这就构成了对用紫外法测定大豆黄素的含量的干扰。故需要对吸光度与浓度的曲线进行矫正,矫正所得到的标准曲线的准确度和精密度均较好。
3 结论
由于大豆提取液中存在许多影响大豆黄素的测定结果物质,如黄豆黄素、染料木素及其它在248nm有吸收的化学成分,从液相色谱法和紫外法测定的结果即可以看出。以液相色谱法测定的大豆黄素浓度值作为可信值,对紫外标准曲线方程进行矫正,得到新的紫外标准曲线方程y=0.706 1x+0.012 5,该方程可准确、快速、方便地运用于大豆提取液中大豆黄素的测定,该研究方法也可为其它大豆异黄酮的紫外测定所借鉴。
[1]Naim M,Gestetner B,Zilkah S,et al.Soybean isoflavones.Characterization,determination,and antifungal activity[J].Journal of agricultural and food chemistry,1974,22:806-810
[2]Walter R D.Genistin(an isoflavone glucoside)and its aglucone,genistein,from soybeans[J].Journal of the American chemical Society,1941,63:3273-3276
[3] Walz E.Isoflavon-und saponin-glucoside in Soja-hispida[J].Justus Liebigs Annalen der Chemie,1931,489:118-155
[4] Wang H J,Murphy P A.Isoflavone composition in American and Japanese soybeans in Iowa:effects of variety,crop year,and location[J].Journal of agricultural and food chemistry,1994,42:1674-1677
[5] Singletary K,Faller J,Li J Y,et al.Effect of extrusion on isoflavone content and antiproliferative bioactivity of soy/corn mixtures[J].Journal of agricultural and food chemistry,2000,48:3566-3571
[6] Yoon-Bok Lee,Hyong Joo Lee,Heon Soo Sohn.Soy isoflavones and cognitive function[J].Journal of nutritional biochemistry,2005,16:641-649
[7]Adrian A Franke,Brunhild M Halm,Leslie A Ashburn.Isoflavones in children and adults consuming soy[J].Archives of biochemistry and biophysics,2008,476:161-170
[8] Gilberto Eiji Shiguemoto,Elizeu Antonio Rossi,et al.Isoflavone supplemented soy yoghurt associated with resistive physical exercise increase bone mineral density of ovariectomized rats[J].Maturitas,2007,57:261-270
[9] Silvina Levis,Nancy Strickman-Stein,Daniel R Doerge.Design and baseline characteristics of the soy phytoestrogens as replacement estrogen (SPARE)study-A clincal trial of the effects of soy isoflavones in menopausal women[J].Contemporary Clinical Trials,2010,31:293-302
[10]张玉梅.大豆异黄酮的抗动脉粥样硬化作用[J].国外医学内科学分册,2003,6(3):239-242
[11]Anthony M S,Clarkon T B,Birk Y,et al.Soy protein versus soy phytoestrogens in the prevention of diet-induced coronary artersclerosis of male cynomolgus monkeys[J].Arterioscler Thromb Vasc Biol,1997,17(11):2524-2531
[12]Zih-Rou Huang,Chi-Feng Hung,Yin-Ku Lin.In vitro and in vivo evaluation of topical delivery and potential dermal use of soy isoflavones genistein and daidzein[J].International journal of pharmaceutics,2008,364:36-44
[13]郑高利.大豆异黄酮的抗氧化作用[J].浙江医科大学学报,1997,26(5):196-199
[14]Eliana A P Nahas,Jorge Nahas-Neto,Shiraiwa M,et al.Efficacy and safety of a soy isoflavone extract in postmenopausal women:A randomized,double-blind,and placebo-controlled study[J].Maturitas,2007,58:249-258
[15]Mizunuma H,Kanazawa K,Ogura S,et al.Anticarcinogenic effects of isoflavones may be mediated by genistein in mouse mammary tumor virus-induced breast cancer[J].Oncology,2002,62(1):78-84
[16]Gallo D,Giacomelli S,Cantelmo F,et al.Chemoprevention of DMBA-induced mammary cancer in rats by dietary soy[J].Breast Cancer Res Treat,2001,69(2):153-164
[17]Umphress S T,Murphy S P,FRANKE A A,et al.Isoflavone content of foods with soy additives[J].Journal of Food Composition and Analysis,2005,18:533-550
[18]Wang H J,Murphy P A.Isoflavone content in commercial soybean foods[J].Agric Food Chem,1994,42:1666-1673
[19]鞠兴荣,袁建,汪海峰.高效液相色谱法测定大豆提取物中大豆异黄酮含量[J].中国粮油学报,2000,15(4):26-28
[20]Mauricio A Rostagno,Miguel Palma,Kuduo S,et al.Short-term stability of soy isoflavones extracts:Sample conservation aspects[J].Food chemistry,2005,93:557-564
[21]Wen-Dee Chiang,Chieh-Jen Shih,Yan-Hwa Chu.Optimization of acid hydrolysis conditions for total isoflavones analysis in soybean hypocotyls by using RSM[J].Food chemistry,2001,72:499-503
