重组腺病毒载体AdOX40Ig 的构建、表达及相关体外实验
2013-05-07陈志红赵媛媛张守亮林建扬魏法星朱伟
陈志红,赵媛媛,张守亮,林建扬,魏法星,朱伟
(1.江苏大学附属人民医院普外科,江苏 镇江212002;2.江苏大学基础医学与医学技术学院,江苏 镇江212013)
目前唯一有效治疗终末期器官功能衰竭的方法就是器官移植,但是由于存在器官移植排斥反应,传统的终身免疫治疗常常引起各种器官功能衰竭而导致移植失败[1-2]。因而发展一种新途径诱导特异性免疫耐受,对于防止发生急性和慢性排斥反应以及避免器官移植后终身免疫抑制治疗都是非常重要的。在器官移植中,T 细胞是介导移植排斥反应的主要效应细胞之一,而OX40/OX40L 可以提供T 细胞活化后进一步增殖、分化并最终形成效应T 细胞或者记忆细胞的关键共刺激信号[3-5]。因此阻断OX40/OX40L 间的相互作用,有可能诱导受体针对移植物抗原的特异性T 细胞失能从而产生免疫耐受。已有研究表明,阻断OX40/OX40L 信号通路可以有限地延长移植皮肤的存活[6],对移植物抗宿主病有潜在治疗意义[7]。
本实验拟构建含人OX40-IgG1 融合基因的重组腺病毒载体,通过转染293A 细胞,包装出具有感染性的完整病毒颗粒,进一步感染肝HL-7702 细胞,并检测了其感染效率及相关目的基因和蛋白的表达。这将为进一步进行基因诱导免疫耐受从而抑制肝移植排斥反应的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和细胞株 pAdTrack-CMV 穿梭质粒由复旦大学钟江老师惠赠;pAdeasy-1 由本室冻存;大肠埃希菌DHα、BJ5183 菌株由本室冻存;293A 细胞株来自加拿大Microbix Biosystems 公司;肝细胞HL-7702 来自中国科学院上海细胞生物学研究所细胞库;小鼠抗人OX40 mAb (1F7)由苏州大学张学光教授惠赠。
1.1.2 主要试剂 限制性内切酶BglⅡ、EcoRⅤ、SalⅠ、PacⅠ、PmeⅠ(New England Biolab 公司);T4DNA 连接酶和TaqDNA 聚合酶(TaKaRa 生物技术公司);PCR 产物回收试剂盒(Qiagen 公司);质粒抽提试剂盒(杭州V-gene 公司);Lipofect Amine 2000 试剂盒(Gibco Brl 公司);小牛血清(Hyclone公司)。
1.2 方法
1.2.1 转移质粒pTOX40Ig 的构建 根据基因库公布的人OX40 和hIgG1 Fc 片断序列设计引物,经PCR 扩增后,hOX40 PCR 扩增产物用BglⅡ和SalⅠ进行双酶切,hIgG1 Fc 用SalⅠ和EcoRⅤ进行双酶切,最后pAdTrack-CMV 用BglⅡ和EcoRⅤ双酶切。然后经核酸琼脂糖凝胶电泳,并用胶回收试剂盒回收体系中hOX40 片段、hIgG1 Fc 片段和pAdTrack-CMV 的DNA 片段,接着将它们在基因重组连接反应体系中16 ~18 ℃连接过夜。连接产物转化大肠埃希菌,用LB 培养板(卡拉霉素30 μg/mL)筛选阳性克隆,提取质粒,然后经琼脂糖凝胶电泳鉴定。鉴定过的阳性质粒送北京奥科公司进行DNA测序,将测序正确的质粒命名为pAdTrack-CMVOX40Ig(pTOX40Ig)。
1.2.2 重组腺病毒质粒pAdOX40Ig 和pAdGFP 的构建 把质粒pAdTrack-CMV、pTOX40Ig 分别经PmeⅠ单酶切线性化后,进行电泳和产物胶回收。胶回收片段与pAdeasy-1 腺病毒质粒以氯化钙法分别共转化BJ5183 感受态细胞。挑选阳性克隆进行PCR 及PacⅠ酶切鉴定。将鉴定正确的重组腺病毒质粒pAdOX40Ig、pAdGFP,分别转化DHα 感受态细胞,将转化子大量扩增保种。
1.2.3 重组腺病毒AdOX40Ig 的制备 用碱裂解法抽提重组腺病毒质粒pAdOX40Ig 和pAdGFP,经PacⅠ酶切线性化后,按Lipofectamine 2000 操作说明转染70%贴壁的293A 细胞。转染后更换为含5%FBS 的DMEM 培养基,隔2 ~3d 换1 次培养液,继续培养10 ~14d,第3 ~5 天在荧光显微镜下观察荧光。待细胞有噬斑病变时收集细胞悬液,2000 r/min 离心5 min,细胞沉淀用无菌PBS 洗涤2 ~3 次后,将细胞悬液在-80 ~37 ℃间反复冻融3 次,释放出病毒,2000 r/min 离心5 min,取上清,经多轮感染后获得高滴度重组腺病毒AdOX40Ig 和空载体病毒AdGFP,于-80℃冻存。
1.2.4 AdOX40Ig 和AdGFP 转染293A 细胞及RTPCR 鉴定OX40Ig 用AdOX40Ig 和AdGFP 分别转染293A 贴壁细胞3 h,更换含10%小牛血清的RPMI1640 培养液后在37 ℃条件下继续培养。3d 后提取RNA,采用RT-PCR 鉴定OX40Ig。
1.2.5 AdOX40Ig 重组腺病毒感染效率的检测AdOX40Ig 重组腺病毒体外感染HL-7702 细胞,分为3组,分别为HL-7702 细胞对照未感染组、HL-7702 +Ad 空病毒感染组、HL-7702 +Ad-OX40Ig 重组腺病毒感染组,采用1、10、100、200 MOI 剂量感染,实验各设3 个平行孔。48 h 后分别在普通光镜视野下观察HL-7702 细胞生长形态和荧光视野下观察GFP 绿色荧光表达情况,以判断重组腺病毒不同感染剂量对HL-7702 细胞生长的影响及其感染效率,旨在筛选最佳感染剂量进行重组腺病毒感染和生物学功能研究。
1.2.6 间接免疫荧光检测外源性OX40Ig基因的表达 利用免疫荧光染色试剂盒-抗小鼠Cy3 进行间接免疫荧光,检测腺病毒介导的外源性OX40Ig基因在HL-7702 细胞中的表达,方法按免疫荧光染色试剂盒-抗小鼠Cy3 说明书进行。
1.2.7 AdOX40Ig 转染的细胞上清中OX40Ig 蛋白的测定 采用夹心酶联免疫吸附试验测定肝HL-7702 细胞上清中OX40Ig 含量。在37 ℃下用MOI为10 的AdOX40Ig 对HL-7702 细胞感染3 h,收集培养上清,用羊抗人IgG Fc 段单克隆抗体2 μg/mL包被96 孔ELISA 反应板,最后经ELISA 检测仪检测450 nm 处D值。同时设定完全空白对照及空载腺病毒AdGFP 对照。
2 结果
2.1 转移质粒pTOX40Ig 的鉴定
重组后的转移质粒pTOX40Ig 经双酶切后行1%琼脂糖凝胶电泳分析,结果发现与OX40Ig融合基因大小一致,提示转移质粒pTOX40Ig 构建成功(图1)。

图1 转移质粒pTrack-CMV-hOX40Ig(pTOX40Ig)的鉴定Fig 1 Identification of recombinant vector pTrack-CMV-hOX40Ig (pTOX40Ig)by restriction enzymedigestion
2.2 重组腺病毒质粒pAdOX40Ig 的鉴定
PacⅠ酶切鉴定重组后的腺病毒质粒pAdOX40Ig,能释放出大小约1300 bp 的片段,提示重组腺病毒质粒pAdOX40Ig 已成功构建(图2)。

图2 重组腺病毒质粒的鉴定Fig 2 Identification of recombinant adenovirus plasmid pAdOX40Ig
2.3 重组腺病毒AdOX40Ig 的制备及鉴定
鉴定正确的重组腺病毒质粒pAdOX40Ig 经PacⅠ酶切后,按Lipofectamine 2000 操作说明转染293A 细胞。转染第3 天在荧光显微镜下能观察到荧光,提示转染成功(图3)。用pAdOX40Ig 和pAdGFP 分别转染293A 细胞,培养后采用RT-PCR鉴定OX40Ig。只有AdOX40Ig 组出现1 条大小约1300 bp的条带,提示重组腺病毒质粒AdOX40Ig 已成功制备(图4)。

图3 转染293A 细胞后第3 天重组腺病毒质粒pAdOX40IgFig 3 Threedays after recombinant adenovirus plasmid pAdOX40Ig were transfected into 293A cells,green fluorescent protein were observed in cells

图4 重组腺病毒AdOX40Ig 和AdGFP 的PCR 鉴定Fig 4 Identification of AdOX40Ig and AdGFP
2.4 重组腺病毒AdOX40Ig 的感染效率
实验结果发现,普通光镜下只有200 MOI 剂量感染组细胞圆缩、脱落,呈现明显的细胞毒性,10、100 MOI 剂量病毒感染HL-7702 细胞后对细胞几乎无毒性,而且有很高的感染效率,可达90%以上,而1 MOI 剂量病毒感染HL-7702 细胞后虽然无细胞毒性但感染效率很低,提示10 MOI 为最佳感染剂量(图5)。

图5 重组腺病毒AdOX40Ig 的体外感染效率(×200)Fig 5 Infected efficiency of recombinant adenovirus AdOX40Ig in HL-7702 cells
2.5 人肝细胞中外源性OX40Ig 基因的表达
用AdOX40Ig 重组腺病毒和Ad 空载体腺病毒分别感染HL-7702 细胞,然后利用免疫荧光染色试剂盒-抗小鼠Cy3 进行间接免疫荧光检测,结果发现AdOX40Ig 感染组HL-7702 细胞能检测到Cy3 红色荧光,而Ad 空载体腺病毒感染组和未感染组则未出现红色荧光。这表明腺病毒介导的外源性OX40Ig基因能在HL-7702 细胞中成功表达(图6)。
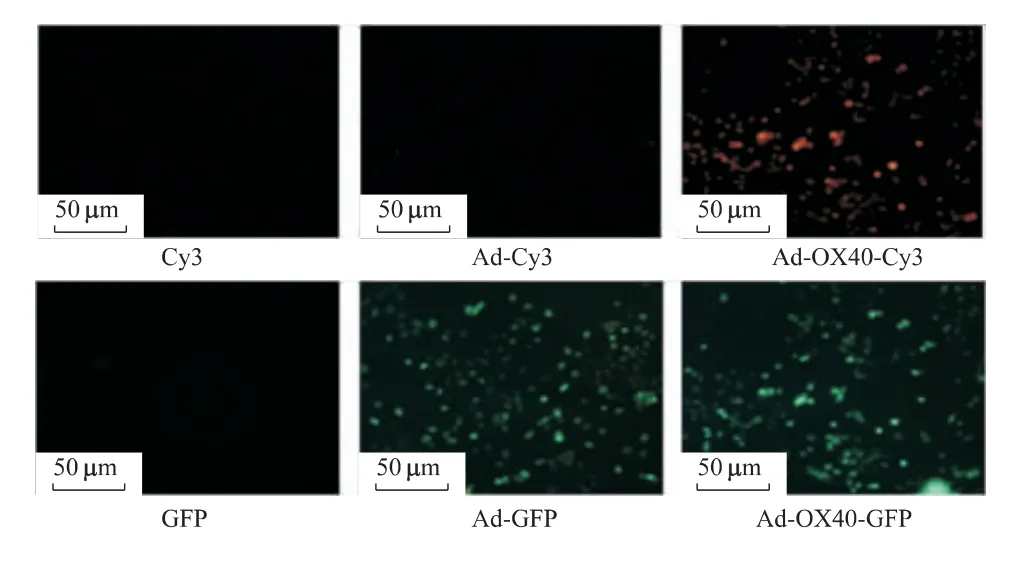
图6 OX40Ig 基因在HL-7702 细胞中的表达Fig 6 OX40Ig gene expression in HL-7702 cells wasdetected by indirect Immuno fluorescence assay
2.6 AdOX40Ig 转染的细胞上清中OX40Ig 蛋白的含量
ELISA 法测定结果经统计学软件SPSS 16.0 分析,空白对照组OX40Ig 蛋白含量为(2.33±2.52)μg/mL,AdGFP 组为(4.33 ±2.52)μg/mL,AdOX40Ig 处理组为(34. 00 ± 4.58)μg/mL,经方差分析,F=88.326,P=0.0001,组间差异具有统计学意义,可认为AdOX40Ig 处理组的OX40Ig 蛋白表达水平高于空白对照组和AdGFP 组。
3 讨论
T 细胞是介导免疫排斥反应的主要效应细胞,阻断T 细胞活化所需的共刺激信号,有可能诱导受体针对移植物抗原的特异性T 细胞失能,从而产生免疫耐受并抑制排斥反应的发生[8]。目前研究最为广泛的两条共刺激途径是CD28/B7 和CD40/CD154 途径,已证实同时阻断两条途径或其中之一可延长移植物存活[9-11]。另外还有一些新的介导移植物排斥的共刺激途径如OX40/0X40L 途径[12]。OX40 是一种跨膜糖蛋白,属于肿瘤坏死因子(TNF)受体家族,最早发现其表达于大鼠活化的T 细胞表面,后来证实也存在于小鼠和人活化的T 细胞表面。OX40 的配体(OX40L),属于2 型糖蛋白TNF家族,研究发现小鼠的B 细胞和人的内皮细胞、树突状细胞等抗原提呈细胞的表面均有OX40L 的表达[13]。两者结合形成的OX40/OX40L 是T 细胞活化后进一步增殖、分化,并最终形成效应T 细胞或者记忆细胞的关键共刺激信号。因此阻断OX40/OX40L 途径能够抑制T 细胞的活化和移植物排斥反应[14]。
有研究显示,各种IgG 中,IgG1 的Fc 段与OX40的胞外区融合所构建的融合蛋白与OX40L 亲和力最强 。本研究中,我们首先将hOX40 片段、hIgG1 Fc 片段和pAdTrack-CMV 的DNA 片段连接、转化并鉴定构建了转移质粒 pAdTrack-CMV-OX40Ig(pTOX40Ig),再与pAdeasy-1 在大肠埃希菌BJ5183中进行同源重组,构建成重组腺病毒质粒pAdOX40Ig,随后经包装、扩增、纯化及鉴定后感染肝HL-7702 细胞。经间接免疫荧光检测,结果显示腺病毒介导的外源性OX40Ig基因能在HL-7702 细胞中成功表达,又采用夹心酶联免疫吸附试验(ELISA)测定AdOX40Ig 感染的HL-7702 肝细胞上清中OX40Ig 的含量,结果发现AdOX40Ig 处理组高于空白对照组和AdEGFP 对照组,且差异有统计学意义。以上结果表明,我们已成功构建了重组腺病毒载体AdOX40Ig,并且OX40Ig基因及蛋白均可在HL-7702 肝细胞中成功表达。这就为肝移植时将目的基因OX40Ig导入肝细胞奠定了基础,同时使得通过阻断OX40/0X40L 途径抑制肝移植排斥反应成为可能。
近年来在诱导肝移植免疫耐受机制方面已取得了很大进展,但实际应用于临床的还很少。我们的研究旨在通过将OX40Ig基因转入移植物的途径诱导特异性免疫耐受,在此基础上进行相关体内实验及临床应用等更深入的研究,可能会在器官移植领域有很好的应用价值。
[1]Pascual M,Theruvath T,Kawai T,et al. Strategies to improve long-term outcomes after renal transplantation[J].N Engl J Med,2002,346(8):580-590.
[2]Bloom RD,Doyle AM. Kidneydisease after heart and lung transplantation[J]. Am J Transplant,2006,6(4):671-679.
[3]Croft M.Control of immunity by the TNFR-related molecule OX40(CD134)[J]. Annu Rev Immunol,2010,28:57-78.
[4]Cavanagh MM,Hussell T. Is it wise to target the late costimulatory molecule OX40 as a therapeutic target?[J].Arch Immunol Ther Exp,2008,56(5):291-297.
[5]Sugamura K,Ishii N,Weinberg A,et al.Therapeutic targeting of the effector T-cell co-stimulatory molecule OX40[J].Nat Rev Immunol,2004,4(6):420-431.
[6]Kinnear G,Wood KJ,Marshall D,et al. Anti-OX40 prevents effector T-cell accumulation and CD8+T-cell mediated skin allograft rejection[J]. Transplantation,2010,90(12):1265-1271.
[7]黄一虹,冯洒然,杜冰,等. 移植物化学修饰与阻断OX40-OX40L 途径预防异基因骨髓移植小鼠移植物抗宿主病的研究[J].中华血液学杂志,2009,30(11):735-740.
[8]Vincenti F. Chronic induction:what's new in the pipeline[J].Contrib Nephrol,2005,146:22-29.
[9]石向华,刘小友,孙煦勇,等. CD40 阻断剂对大鼠肾移植急性排斥反应的影响[J].南方医科大学学报,2011,31(12):2085-2086.
[10]Lunsford KE,Barbas AS,Brennan TV,et al. Recent advances in immunosuppressive therapy for prevention of renal allograft rejection[J]. Curr Opin Organ Transplant,2011,16(4):390-397.
[11]Sang W,Zhou C,Cheng N,et al. Control of mouse graftversus-hostdisease following allogeneic bone marrow transplantation by blocking the CD28/B7 signaling pathway with lentiviral vector-mediated RNA interference[J].Immunol Lett,2011,136 (2):194-202.
[12]Aqarwal A,Newell KA. The role of positive costimulatory molecules in transplantation and tolerance[J]. Curr Opin Organ Transplant,2008,13(4):366-372.
[13]Sugamura K,Ishii N,Weinberg AD,et al. Therapeutic targeting of the effector T-cell co-stimulatory molecule OX40[J].Nat Rev Immunol,2004,4(6):420-431.
[14]Honkanen-Scott M,Johnson J,Hering B,et al. Blockade of OX40 signals enhance survival of xenoislet grafts in spontaneouslydiabetic NOD mice[J].Transplant Proc,2008,40(2):483-485.
[15]Tavlor L,Schwarz H.Identification of a soluble OX40 isoform:development of a specific and quantitative immunoassay[J].J Immunol Methods,2001,255(1/2):67-72.
