鱼鳞冻热处理工艺优化及性质的研究*
2013-05-05顾杨娟李杰李富威包建强
顾杨娟,李杰,李富威,包建强
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海,201306)
据统计,2003年我国鱼类废弃物总量就达到200万t以上,其中鱼鳞约达30万t[1]。然而,鱼鳞中含有大量有价值的有机和无机成分,主要是胶原和羟基磷灰石[2],可用于功能食品、化妆品和生物医药行业[3-4]。由于环境和资源问题,鱼鳞的开发利用引起了大家广泛的关注。
鱼鳞中主要含Ⅰ型胶原,由2条α1-肽及1条α2-肽链组成,也有少量由3条α1-肽链组成。鱼鳞胶原通过不同的提取条件和方法可以得到不同产品,如胶原,明胶,胶原肽或胶原蛋白[5]。目前,关于鱼鳞胶原的研究报道较多,涉及的鱼鳞种类有南亚黑鲮鱼和喀拉鲃鱼鱼鳞[4],鲤鱼鳞[6],深海红鱼鳞[7],草鱼鳞[8],多须石首鱼和羊头鲷鱼鳞[3]等。而鱼鳞明胶的研究报道 仅限于蜥鱼鳞[9]、草鱼鳞[10]、罗非鱼鱼鳞[11]、淡水鱼混合鱼鳞[12-13]。鱼鳞冻是鱼鳞提取的明胶溶液低温冷却后形成的胶冻状食品,富含水溶性胶原蛋白,具有美容、保健的作用。鱼鳞冻和鱼鳞明胶的不同用途决定了鱼鳞冻热处理条件不同于鱼鳞明胶。
鱼鳞中的胶原可通过前处理转变成适合明胶提取的形式,通常在高于45℃的热水中提取。鱼鳞明胶的提取通常采用酸法[11]、碱法[9,11]、酶法[10-11]、酸盐法[11]、碱盐法[11]等方式进行前处理,也可直接用热水提取明胶[12]。草鱼是我国大宗养殖产品,其鱼鳞资源相当丰富,而且草鱼鱼鳞的胶原蛋白含量较高[14],适合鱼鳞冻的制备。因此,本研究以草鱼鱼鳞为研究对象,采用酸法、酶法对鱼鳞进行前处理以及不做前处理,用正交试验法确定不同前处理方式制备鱼鳞冻的最佳热处理工艺条件,并测定其鱼鳞冻的理化性质和质构特性。
1 材料与方法
1.1 材料及预处理
原料是浙江南浔新雅农产品开发有限公司提供的新鲜冷冻草鱼鱼鳞。鱼鳞在室温下自然解冻,挑除非鱼鳞杂质及小鱼鳞,鱼鳞直径在1.5~2.5 cm,用自来水将鱼鳞漂洗干净,然后用100 g/L的NaCl溶液浸泡24 h,以除去附在表面的鱼银、黏液及杂蛋白,再用自来水清洗干净,最后将鱼鳞自然晾干,并于-30℃下冷冻保藏备用。
羟脯氨酸,购自国药集团化学试剂有限公司。果冻,购自上海华联超市。本试验所用的所有试剂均为分析纯。
1.2 仪器设备
UV-1800PC型紫外可见分光光度计,上海美谱达仪器有限公司;TA-XT plus质构仪,英国Stable Micro System公司;Physica MCR301型高级旋转流变仪,奥地利安东帕有限公司;LRH-100CL低温培养箱,上海一恒科学仪器有限公司;DK-S28型电热恒温水浴锅,上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 基本成分分析
水分含量测定采用直接干燥法(105℃)(GB/T5009.3-2010);蛋白质含量测定采用凯氏定氮法(GB/T5009.5 -2010),转化系数取 5.55[15];脂肪含量测定采用索氏抽提法(GB/T5009.6-2003);灰分含量测定采用灼烧恒重法(550℃)(GB/T5009.4-2010);总糖含量测定时先对鱼鳞样品用HCl进行水解 (GB/T15672-2009),再采用苯酚—硫酸法[16]。
1.3.2 鱼鳞冻制备工艺
鱼鳞解冻复水→清洗→不同方式的前处理→热处理→抽滤→凝冻
鱼鳞在室温下自然解冻,复水,清洗,然后进行不同方式的前处理,再用流动的自来水清洗鱼鳞至其pH值在7.0左右,再用蒸馏水冲洗2次。将湿鱼鳞沥至不滴水,再将其放入烧杯中,加入一定比例的蒸馏水,用铝箔纸封口防止水分蒸发,在一定的温度、时间、pH值、料水比条件下,水浴加热提取鱼鳞胶液。用布氏漏斗真空抽滤,以尼龙滤布滤掉鱼鳞残渣。将鱼鳞胶液放入容器中于低温(10℃)下凝冻。
本试验用来提取胶液的鱼鳞均为湿鱼鳞,含水率为58.05%。
1.3.3 胶原蛋白提取率
羟脯氨酸是胶原蛋白的特异性氨基酸,含量比较稳定。因此,采用紫外可见分光光度计,测定羟脯氨酸含量,再乘以转换系数,得到胶原蛋白含量。
根据Woessner比色法[17],得到羟脯氨酸标准曲线的回归方程,再根据方程和样品的吸光度值计算出样品中羟脯氨酸的含量。一般哺乳动物胶原中羟脯氨酸的含量约为14.4%[18],鱼类胶原中羟脯氨酸含量较低,如Toshiyuki Ikoma等[19]测得淡水鱼鳞胶原中羟脯氨酸的含量约为11%。本试验采用的转换系数为9.09。

1.3.5 冻力测定
取鱼鳞胶液和液态果冻(水浴加热)120 mL置于冻力瓶(内径59 mm,高度85 mm)内,在低温培养箱(10℃)中凝冻18 h,压缩变形4 mm所需的最大应力为冻力,单位为g。采用质构仪测定冻力,用P/0.5探头,下压速度1 mm/s,下压高度4 mm。
1.3.6 鱼鳞冻热处理工艺的正交试验
影响鱼鳞冻热处理的主要因素有提胶温度、提胶时间、提胶用水pH值、提胶料水比。在单因素试验的基础上,对未经前处理的鱼鳞进行4因素3水平的热处理正交试验(表3),对经过酸处理、酶处理的鱼鳞进行3因素3水平的热处理正交试验(表6、表9)。
酸处理工艺条件为:HCl浓度0.4 mol/L,浸酸时间90 min,浸酸料液比1∶6[湿鱼鳞(g)∶HCl(mL)]。酶处理工艺条件为:Protease A 2G加酶量为湿鱼鳞质量的0.8%,在30℃下酶解5.5 h。在酶处理前,先用盐酸对鱼鳞进行脱钙处理,条件同酸处理条件。脱钙后鱼鳞再次清洗,加入1∶2(g∶mL)的蒸馏水,调溶液pH值为7,然后加入Protease A 2G进行酶解。鱼鳞酶解后需要再次清洗,然后在90℃水浴中灭酶10 min。
1.3.7 黏度测定
采用流变仪,测定最佳工艺条件下制备的鱼鳞胶液在60℃时的黏度(mPa·s),剪切速率为70(1/s)。
1.3.8 胶凝温度和熔化温度
采用流变仪,测定最佳工艺条件下制备的鱼鳞胶液在降温和升温过程中的G'(储存模量)和G″(损耗模量),振荡频率1Hz,蠕变应力3.0Pa,温度扫描5~30℃,采样温度间隔0.5℃ 。先进行降温过程,到达5℃时保持20 min再进行升温过程。
在降温过程中,G'和G″相交的点对应的温度就是胶凝温度;在升温过程中,G'和G″相交的点对应的温度就是熔化温度[20]。
1.3.9 质构特性测定
采用质构仪测最佳工艺条件下制备的鱼鳞冻和果冻样品的质构特性。鱼鳞胶液和液态果冻在10℃下凝冻18h后从玻璃杯中取出,得到圆柱形胶体,直径34 mm,高25 mm。测定前、测定时、测定后的探头速度都为1 mm/s,压缩变形30%,P/75探头,探头两次测定间隔3 s,触发力5 g。
1.4 统计分析
用SPSS软件进行描述统计,方差分析和差异显著性分析。每个指标的测定采用3次平行,差异显著性水平为0.05。
2 结果与讨论
2.1 基本成分分析
草鱼鱼鳞的基本成分如表1所示。可以看出,草鱼鱼鳞具有高蛋白、高矿物元素含量、低脂、低糖的特点。而且胶原蛋白含量丰富,占鱼鳞干重的54.45%,占总蛋白的89.19%。

表1 草鱼鱼鳞的基本成分Table 1 Proximate composition of fish scale from grass carp
2.2 鱼鳞冻热处理工艺优化
鱼鳞冻要满足直接食用的需求,所以和提取鱼鳞明胶相比提胶温度高,时间短,提胶用水pH值近中性,料水比也是主要影响因素。对于酸处理和酶处理鱼鳞冻,由于鱼鳞已经过浸酸处理,再在酸性条件下热处理可能使胶原结构稳定性更差,所以直接用蒸馏水提胶。鱼鳞冻的考察指标为胶原蛋白提取率和冻力。胶原蛋白提取率越大,鱼鳞的利用率越高,得到的胶原蛋白就越多,而冻力反映鱼鳞冻凝胶特性的能力,和鱼鳞明胶要求凝胶强度越大越好不同,本研究以常见品牌的普通果示型果冻冻力作为参考标准,如表2所示。
2.2.1 未前处理鱼鳞冻
未前处理鱼鳞冻热处理工艺正交试验结果如表3示。根据极差分析(表4)和方差分析(表5)得出,胶原蛋白提取率随着温度的升高、时间的增加、pH值的降低而增大,而料水比影响不显著;冻力随着温度的升高、时间的增加先增大后减小,在温度水平和时间水平为2时达到最大,而冻力随着pH值的增大而增大,随着料水比的减小而减小。温度越高,鱼鳞胶原热降解越剧烈,所以有更多的胶原转变成明胶溶出来,使胶原蛋白提取率增大,冻力也因胶液中的α肽链增加形成更密的网状结构而增大,但是温度的进一步升高使肽链的次级降解也增加,而短肽链不易交联形成网状结构,导致冻力降低。随着时间的延长,胶原溶出得更多,肽链的次级降解也会不断发生,从而引起冻力下降。有研究表明,不溶性胶原和盐析沉淀的酸溶性胶原的热稳定性随pH值的降低而降低[21]。所以,pH值越高,胶原结构越稳定,胶原溶出就越少,同时由于胶原热稳定性好,热降解度就低,冻力就越大。这与张丰香等得出温度、时间、pH值对鱼鳞明胶品质影响的结果较为一致[13]。水量在热处理过程中保持没过鱼鳞就不会对胶原蛋白提取率有影响,但料水比会影响鱼鳞胶液中的胶原蛋白浓度,从而影响冻力。

表2 不同品牌果冻的冻力Table 2 Gel strength of fruit jellies from different brands

表3 未前处理鱼鳞冻热处理正交试验设计及结果Table 3 Design and results of orthogonal experiment of heat treatment of fish scale jelly processed without pre-treatment
由表4可知,胶原蛋白提取率的因素主次是:提胶温度>提胶时间>提胶用水pH值>料水比。冻力的因素主次是:料水比>提胶温度>提胶时间>提胶用水pH值。料水比对胶原蛋白提取率影响不显著,而对冻力影响最大,考虑到总体冻力水平不高,所以料水比选择水平1。温度取水平3时,胶原蛋白提取率最大,冻力也能达到果冻冻力平均值水平,所以温度取水平3。时间和pH值考虑到冻力不能太低,所以都选择水平2。得出未前处理鱼鳞冻的最佳热处理工艺条件为:100℃提胶2 h,提胶用水的pH值为6,料水比为1∶4。经过验证试验,在该条件下制备鱼鳞冻,胶原蛋白提取率为(54.06±2.38)%,冻力为(48.98±2.45)g,与预期的结果较为一致。

表4 未前处理鱼鳞冻热处理正交试验极差分析Table 4 Analysis of graded difference of orthogonal experiment of heat treatment of fish scale jelly processed without pre-treatment

表5 未前处理鱼鳞冻热处理正交试验方差分析Table 5 ANOVA of orthogonal experiment of heat treatment of fish scale jelly processed without pre-treatment
2.2.2 酸处理鱼鳞冻
表6为酸处理鱼鳞冻热处理工艺的正交试验结果。根据表7和表8得出,胶原蛋白提取率随着温度的升高、时间的增加而增大,料水比无显著影响。冻力随着温度的升高、时间的增加、料水比的减小而减小。与未处理鱼鳞冻相比,冻力没有随着温度的升高,时间的增加先增大后减小,而是一直在减小,可能是因为鱼鳞经过酸处理,胶原的热稳定性变差了,热降解度高,使分子量减小。
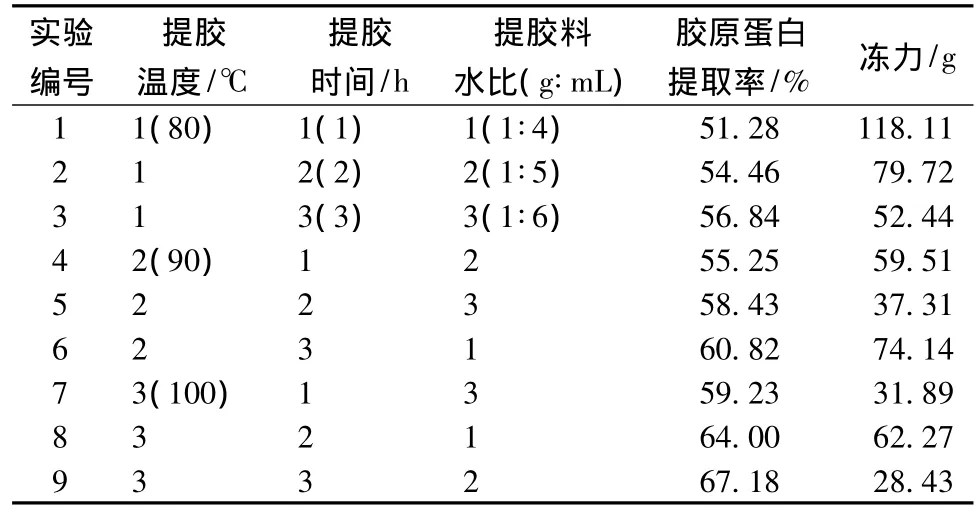
表6 酸处理鱼鳞冻热处理正交试验设计及结果Table 6 Design and results of orthogonal experiment of heat treatment of fish scale jelly processed with acid pre-treatment
从表7可知,胶原蛋白提取率因素主次是:提胶温度>提胶时间>提胶料水比。冻力因素主次是:提胶料水比>提胶温度>提胶时间。料水比由于对冻力影响最大,而对胶原蛋白提取率影响不显著,所以料水比的选择根据冻力大小来取舍。温度和时间的水平选择要使胶原蛋白提取率尽可能大,冻力又要达到冻力参考值的大小。所以综合考虑,酸处理鱼鳞冻的热处理最佳工艺条件为:100℃提胶2 h,料水比为1∶5。经过验证试验,在该条件下制备鱼鳞冻,胶原蛋白提取率为(64.59±2.53)%,冻力为(47.75±2.93)g,与预期结果较为符合。
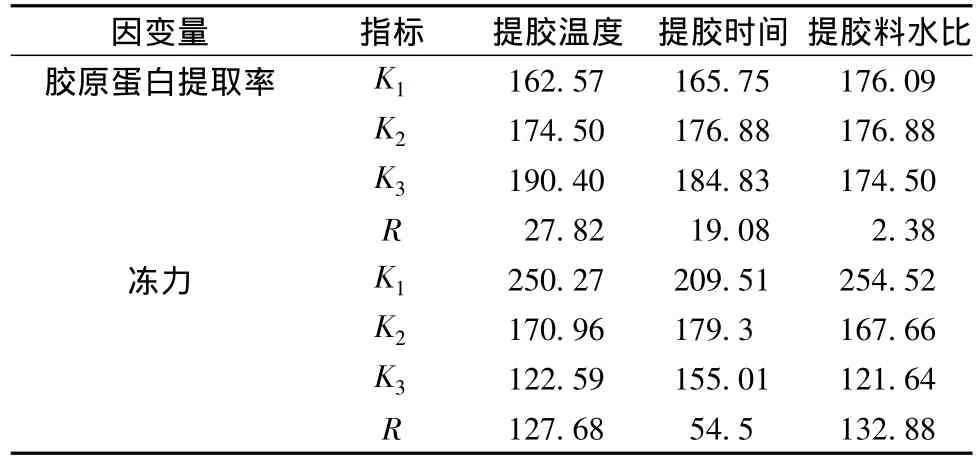
表7 酸处理鱼鳞冻热处理正交试验极差分析Table 7 Analysis of graded difference of orthogonal experiment of heat treatment of fish scale jelly processed with acid pre-treatment
2.2.3 酶处理鱼鳞冻
酶处理鱼鳞冻的热处理正交试验结果如表9所示。表10和表11的结果表明,酶处理鱼鳞冻胶原蛋白提取率和冻力的因素主次与酸处理鱼鳞冻一致,随因素水平变化的趋势也一致。考虑到相同热处理条件下酶处理鱼鳞冻的冻力比酸处理鱼鳞冻要小,所以料水比选择水平1。从而得出酶处理鱼鳞冻的热处理最佳工艺条件为:100℃提胶2 h,料水比为1∶4。在该条件下进行验证试验,鱼鳞冻胶原蛋白提取率为(81.88±3.92)%,冻力为(47.97±3.04)g,接近于预期结果。
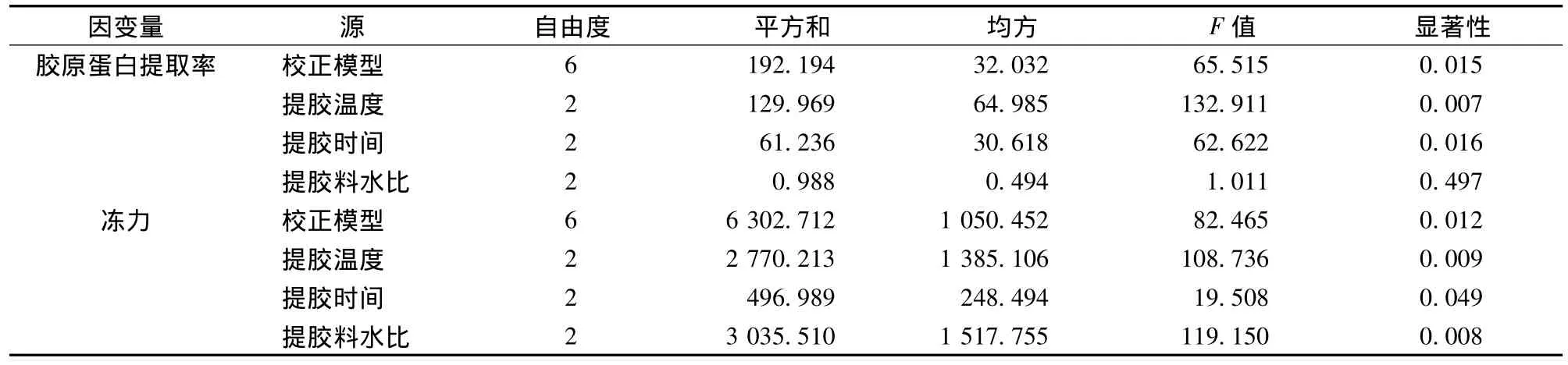
表8 酸处理鱼鳞冻热处理正交试验方差分析Table 8 ANOVA of orthogonal experiment of heat treatment of fish scale jelly processed with acid pre-treatment

表9 酶处理鱼鳞冻热处理正交试验设计及结果Table 9 Design and results of orthogonal experiment of heat treatment of fish scale jelly processed with enzymatic pre-treatment

表10 酶处理鱼鳞冻热处理正交试验极差分析Table 10 Analysis of graded difference of orthogonal experiment of heat treatment of fish scale jelly processedy with enzymatic pre-treatment

表11 酶处理鱼鳞冻热处理正交试验方差分析Table 11 ANOVA of orthogonal experiment of heat treatment of fish scale jelly processed with enzymatic pre-treatment
2.3 鱼鳞冻冻力和黏度
根据上述优化工艺制备的鱼鳞冻,其冻力和黏度如表12所示。3种鱼鳞冻的冻力都略大于果冻冻力(表2),但远远低于鱼鳞明胶的凝胶强度,如草鱼鳞明胶凝胶强度(276±12)g[10],蜥鱼鳞明胶凝胶强度(252 ±1.21)g[9]。同样,鱼鳞冻的黏度也远远低于鱼鳞明胶的黏度,如混合鱼鳞明胶8.16(mPa·s)[13]。这是因为鱼鳞明胶的凝胶强度和黏度都是用6.67%的明胶溶液来测定的,而鱼鳞冻的胶原蛋白质量浓度相对较低(表13),所以相应地鱼鳞冻的冻力和黏度也较低。而且由于鱼鳞冻的提胶温度大大高于鱼鳞明胶的提胶温度,鱼鳞胶液中的肽链容易断裂降解,也会引起鱼鳞冻的冻力和黏度降低。由于鱼鳞冻是直接食用的食品,其冻力和黏度显然是要低于鱼鳞明胶的。经过酶处理,鱼鳞冻的胶原蛋白浓度增加46%,冻力没有增加,黏度降低,这说明酶处理对鱼鳞冻的冻力和黏度有很大影响。酸处理鱼鳞冻胶原蛋白浓度和冻力与未前处理鱼鳞冻相当,黏度较低,说明酸处理对鱼鳞冻的黏度有显著影响。

表12 优化工艺制备的鱼鳞冻理化指标Table 12 Physicochemical properties of fish scale jellies processed in the optimum processing conditions

表13 优化工艺制备的鱼鳞冻胶原蛋白质量浓度Table 13 Collagen mass concentration of fish scale jellies processed in the optimum processing conditions
2.4 鱼鳞冻胶凝温度和熔化温度
鱼鳞冻的胶凝温度和熔化温度是通过监测鱼鳞胶液在降温和升温过程中动态黏弹性的变化情况,计算G'(储存模量)和G″(损耗模量)相交点对应的温度得到的。在降温开始时,G'小于G″,表明此时体系弹性小于黏性,鱼鳞胶液呈黏性流动状态,随着温度降低到某一点,两者相交,此后G'大于G″,表明此时体系弹性大于黏性,鱼鳞胶液呈固态胶体状态。升温过程中,G'和G″的变化情况正好与降温过程相反。表12列出了3种鱼鳞冻的胶凝温度和熔化温度,这些结果表明鱼鳞冻适合在10℃以下凝冻,在20℃以下保存。Zhang[10]等得到的鱼鳞明胶的胶凝温度和熔化温度分别为20.8℃和26.9℃,要高于鱼鳞冻的胶凝温度和熔化温度。这同样与鱼鳞胶液的胶原蛋白浓度、肽链结构有关。三者相比,未前处理鱼鳞冻的胶凝温度和熔化温度最高,说明其热稳定性最好。
2.5 鱼鳞冻质构特性
鱼鳞冻和喜之郎果味型果冻的质构特性如表14所示。鱼鳞冻的硬度、黏性、胶着性、咀嚼性比喜之郎果冻的这些指标小(P≤0.05),而弹性、黏弹性、回弹性要比喜之郎果冻的这些指标大(P≤0.05)。这些表明鱼鳞冻的口感要比果冻松软、爽滑,更有弹性。3种鱼鳞冻之间,酸处理鱼鳞冻除黏性最大外,其他参数都是最小。酶处理鱼鳞冻的质构特性参数与未前处理鱼鳞冻相比,硬度、黏性、弹性、回弹性相当,而粘弹性、胶着性、咀嚼性要小。可见,未前处理鱼鳞冻质构特性最好。
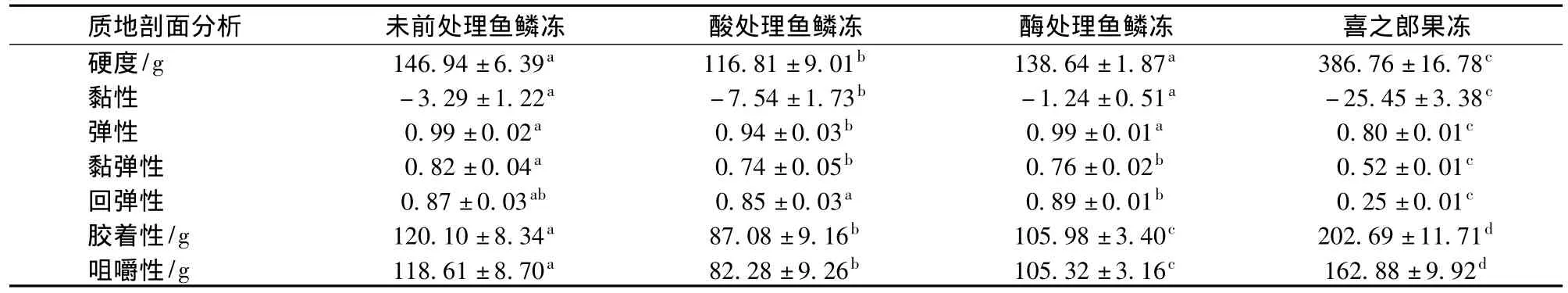
表14 优化工艺制备的鱼鳞冻和喜之郎果冻的质构特性Table 14 TPA of fish scale jellies processed in the optimum processing conditions
3 结论
对于未前处理、酸处理、酶处理3种不同的前处理方式,以胶原蛋白提取率和冻力作为考察指标,鱼鳞冻热处理工艺最佳条件的提胶温度都为100℃,提胶时间都为2 h,除酸处理鱼鳞冻料水比为1∶5外,其余都为1∶4,未前处理鱼鳞冻的提胶用水pH值为6。由此推断,不同种类的鱼鳞制备鱼鳞冻可采用此提胶温度和提胶时间,但由于原料中胶原蛋白含量不同,需要调整料水比以满足冻力要求。
优化工艺制备的3种鱼鳞冻冻力相当,质构上都要比普通果味型果冻松软、爽滑,更有弹性;胶凝温度和熔化温度表明鱼鳞冻适合在10℃以下凝冻,在20℃以下保存。未前处理鱼鳞冻,质构特性好,工艺简单,还含有钙等矿物元素,不足之处是胶原蛋白浓度低。酶处理鱼鳞冻,最大的优点是胶原蛋白浓度高,但质构特性较未前处理鱼鳞冻差一些,且成本高、工艺复杂。酸处理鱼鳞冻,因料水比小,胶原蛋白浓度和未前处理鱼鳞冻相当,质构特性较差,最大的优点是鱼鳞冻产量高。这些试验结果为鱼鳞冻产品的实际研发提供了理论参考。
[1] 郭庆,艾春香.鱼鳞资源的开发利用[J].福建畜牧兽,2005,27(5):32-33.
[2] Holá M,Kalvoda J,Nováková H,et al.Possibilities of LA-ICP-MS technique for the spatial elemental analysis of the recent fish scales:Line scan vs.depth profiling[J].Applied Surface Science,2011,257(6):1 932-1 940.
[3] Ogawa M,Portier R J,Moody M W,et al.Biochemical properties of bone and scale collagens isolated from the subtropical fish black drum(Pogonia cromis)and sheepshead seabream(Archosargus probatocephalus)[J].Food Chemistry,2004,88(4):495 -501.
[4] Pati F,Adhikari B,Dhara S.Isolation and characterization of fish scale collagen of higher thermal stability[J].Bioresource Technology,2010,101(10):3 737-3 742.
[5] 蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006:256-271.
[6] Duan R,Zhang J,Du X,et al.Properties of collagen from skin,scale and bone of carp(Cyprinus carpio)[J].Food Chemistry,2009,112(3):702-706.
[7] Wang L,An X,Yang F,et al.Isolation and characterisation of collagens from the skin,scale and bone of deep-sea redfish(Sebastes mentella)[J].Food Chemistry,2008,108(2):616-623.
[8] Li C M,Zhong Z H,Wan Q H,et al.Preparation and thermal stability of collagen from scales of grass carp(Ctenopharyngodon idellus)[J].European Food Research and Technology,2008,227(5):1 467-1 473.
[9] Wangtueai S,Noomhorm A.Processing optimization and characterization of gelatin from lizardfish(Saurida spp.)scales[J].LWT-Food Science and Technology,2009,42(4):825-834.
[10] Zhang F,Xu S,Wang Z.Pre-treatment optimization and properties of gelatin from freshwater fish scales[J].Food and Bioproducts Processing,2011,89(3):185 -193.
[11] 位绍红,许永安,吴靖娜.罗非鱼鱼鳞提取明胶的工艺研究[J].渔业科学进展,2010(3):66-76.
[12] 李闻欣,杨明来,王润辰,等.鱼鳞水法制胶的研究[J].食品科学,2006(11):346-348.
[13] 张丰香,王璋,许时婴.鱼鳞明胶的提胶工艺[J].食品与发酵工业,2008,34(9):96-100.
[14] 刘庆慧,刘从力,王采理.鱼鳞营养成分的分析及对高脂饲料大鼠血脂水平的影响[J].中国水产科学,2000(4):56-59.
[15] Harris P.Food Gel[M].London:Elsevierapplied science,2001:250.
[16] 徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005(8):342-346.
[17] Woessner J F.The determination of hydroxyproline in tissue and protein samples containing small properties of this imino acid[J].Archives of Biochemistry and Biophysics,1961(93):440-447.
[18] A G沃德,A考茨.明胶的科学与工艺学[M].李文渊等译.北京:中国轻工业出版社,1982:80.
[19] Ikoma T,Kobayashi H,Tanaka J,et al.Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J].International Journal of Biological Macromolecules,2003,32(3 -5):199 -204.
[20] Gudmundsson M.Rheological properties of fish gelatins[J].Journal of Food Science,2002(67):2 172 -2 176.
[21] Russell A E.Effect of pH on thermal stability of collagen in the dispersed and aggregated states[J].The Biochemical Journal,1974,139(1):277 -280.
