树脂法分离纯化荔枝核黄酮*
2013-05-05江敏胡小军林彩霞梁树尧
江敏,胡小军,林彩霞,梁树尧
(湛江师范学院化学科学与技术学院广东高校新材料工程技术开发中心,广东湛江,524048)
荔枝核是无患子科植物荔枝(Litchi chinensis Sonn).的成熟种子,味甘、微苦,归肝、肾经,具有行气散结、祛寒止痛功效。荔枝核的化学成分有甾类、皂苷、挥发油、鞣质、脂肪酸、聚合花色素、糖类、蛋白质、无机盐以及黄酮[1-3]。黄酮是其主要成分之一,荔枝核黄酮在Hep-2细胞中对呼吸道合胞病毒有抑制作用[4],还具有抗氧化[5]、抗流感病毒[6]、抗乙型肝炎病毒[7]、抗 SARS 病毒[8]等多种药理作用。目前荔枝核黄酮主要采用乙醇提取[9-10],所得粗提物含有其他醇溶性杂质,需要进一步分离、纯化。大孔吸附树脂是一种具有多孔立体结构和选择性吸附功能的高分子材料,目前已经广泛用于天然活性成分如黄酮[11]、生物碱[12]、皂苷[13]等成分的分离和纯化。本文就大孔吸附树脂对荔枝核黄酮的吸附性能进行了研究。
1 材料与方法
1.1 实验材料
荔枝核,购于湛江正德医药有限公司。
芦丁标准品,购于中国药品生物制品检定所。
亚硝酸钠、硝酸铝、氢氧化钠、体积分数95%乙醇等,均为国产分析纯。
HPD600、HPD700、HPD750、HPD800 大孔树脂,购于沧州宝恩吸附材料科技有限公司。
1.2 仪器与设备
SHZ-D(Ⅲ)循环水式真空泵,巩义市英峪仪器厂;ZS-HA水浴振荡器,中国哈尔滨市东联电子技术开发有限公司;MP1100电子天平,上海济成分析仪器有限公司;DHG-9240型电热恒温鼓风干燥器,上海精宏实验设备有限公司;BT-100恒流泵,上海青浦泸西仪器厂;BSZ-100自动部分收集仪,上海青浦泸西仪器厂;756M紫外可见分光光度计,上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 荔枝核黄酮分析方法
采用NaNO2-Al(NO)3比色法测定[14],以芦丁为标准品建立回归方程为:y=0.338 4x+0.003 3,R2=0.999 2;其中 x,吸光度,y,芦丁含量,mg。
1.3.2 吸附样品的制备
荔枝核粉碎、烘干,用体积分数95%乙醇,料液比1∶10(g∶mL)回流提取2次,离心提取液,备用。
1.3.3 大孔树脂的预处理
先用体积分数95%乙醇浸泡树脂24 h,抽滤、醇洗,至洗出液加水稀释不浑浊(取1.0 mL乙醇洗出液加5 mL水不混浊)为止,然后用蒸馏水洗涤至无醇,即可使用。
1.3.4 静态吸附实验
1.3.4.1 树脂的筛选
准确称取经预处理后抽干的树脂各3.0 g装入具塞磨口三角瓶中,分别加入浓度为23 mg/mL荔枝核黄酮溶液80 mL,于水浴振荡器中,在室温25℃以100 r/min的频率回旋振荡,每隔2.5 h量取5 mL过滤,测定滤液中剩余荔枝核黄酮浓度,分别按(1)式计算各种树脂室温下的静态吸附量,直到树脂吸附饱和为止。
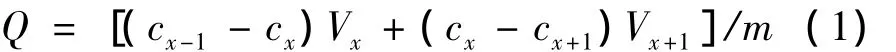
式中:Q,吸附量,mg/g;cx,第x次测得荔枝核黄酮溶液浓度,mg/mL;Vx,第x次的荔枝核黄酮溶液体积,mL;m,树脂的质量,g。
1.3.4.2 树脂解吸量和解吸率的测定
将1.1中4种已吸附饱和的树脂分别称取3份0.60 g的树脂分别用70%的乙醇与吸附相同的条件下振荡,每隔1.5 h量取5 mL溶液过滤,测定此时滤液中荔枝核黄酮浓度,根据式(2)计算解吸量,直到解吸平衡。根据(3)式计算各树脂的解吸率。通过吸附和解吸选择合适的树脂。
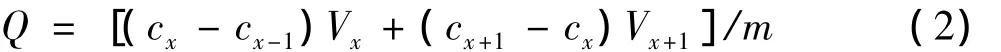
式中:Q,解吸量,mg/g;cx,第x次测的荔枝核黄酮溶液浓度,mg/mL;Vx,第x次的荔枝核黄酮溶液体积,mL;m,树脂的质量,g。
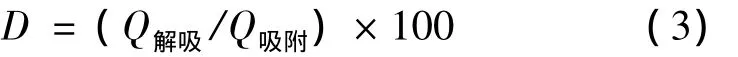
式中:D,解吸率,%;Q解吸,每克树脂解吸平衡后得到最大荔枝核类黄酮的量,mg;Q吸附,每克树脂吸附平衡后吸附荔枝核黄酮的最大量,mg。
1.3.4.3 吸附等温线的绘制[15]
分别称取抽干的树脂2.0 g,置于200 mL具塞磨口三角瓶中,依次向三角瓶中加入不同浓度的荔枝核黄酮溶液,在25℃下于频率100 r/min水浴振荡器上振荡。经过一定时间,待吸附达到平衡后,测其荔枝核黄酮的浓度,计算其静态吸附量;以静态吸附量和对应的平衡浓度作图,即为该温度下吸附树脂对荔枝核黄酮的吸附等温线。
1.3.4.4 吸附液pH值的选择
准确称取抽干的树脂2.0 g,置于200 mL具塞磨口三角瓶中,再依次加入不同pH值的荔枝核黄酮溶液,测定其荔枝核黄酮的静态吸附量,研究其对荔枝核黄酮吸附性能的影响,确定适宜上柱的pH值。
1.3.5 动态吸附实验
树脂湿法装柱,在pH5,25℃条件下,荔枝核黄酮提取液50 mL以一定的流速通过树脂柱,测定流出液中荔枝核黄酮浓度,以流出液与上样液的荔枝核黄酮的浓度差为纵坐标,以上样液浓度为横坐标作图,为树脂的动态吸附曲线。研究上柱液流速、浓度等因素对树脂动态吸附性能的影响。
2 结果与分析
2.1 静态吸附实验结果
2.1.1 树脂的筛选
2.1.1.1 不同树脂静态吸附性能比较
由图1可以看出,0~12 h内随着吸附时间的增加4种树脂吸附黄酮量也随着增加,12.5 h后达到饱和,HPD800吸附速度最快,10 h已经基本达到吸附饱和。HPD700只需要5 h达到饱和,但HPD800吸附对黄酮的吸附量最多,此条件下,最多可达470.250 7 mg/g,而HPD700吸附黄酮的量最少为186.724 4 mg/g。从中可以看出弱极性、中极性和极性树脂的吸附能力较强,而非极性树脂的吸附能力较差。其原因可能是由于荔枝核类黄酮物质含有酚羟基,呈现一定的极性和弱酸性,因此选择具有一定极性和碱性的大孔树脂有利于荔枝核类黄酮物质的吸附。
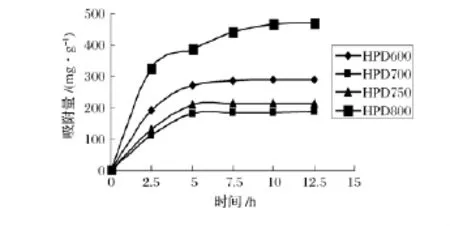
图1 不同树脂静态吸附性能比较Fig.1 Comparison of static adsorption performance of different resins
2.1.1.2 不同树脂静态解吸性能比较
在吸附饱和的条件下,采用体积分数70%乙醇溶液对4种树脂吸附荔枝核黄酮的解吸结果见图2和表1。

表1 不同树脂解吸率比较Table 1 Comparison of desorption rate of different resins
从图2可看出,0~4.5 h内,随着解吸时间的增加,解吸黄酮的量增加,都在4.5 h后达到最高解吸量。其中解吸HPD800树脂的黄酮,解吸量最高达到466.726 0 mg/g,最小的为解吸HPD700树脂的黄酮,解吸量为118.934 8 mg/g。由表1可知,HPD800树脂的解吸率最大,达到99.25%。
在4种大孔树脂中,HPD800大孔树脂分离荔枝核黄酮吸附量和解吸量以及解吸率都比较高,均大于HPD600、HPD700、HPD750树脂。因此综合上述指标,选用HPD800树脂用于分离、纯化荔枝核黄酮。
2.1.2 HPD800大孔树脂吸附等温线的绘制
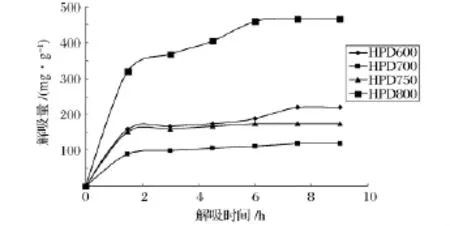
图2 不同树脂解吸性能比较Fig.2 Comparison of desorption performance of different resins
HPD800大孔树脂的吸附等温线见图3。可以看出,在25℃下HPD800树脂对荔枝核类黄酮的吸附平衡过程。用Langmuir公式和Freundlich公式进行拟合。根据Langmuir等温方程:
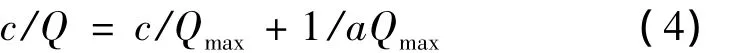
式中:Qmax,每克湿树脂的最大吸附量,mg/g;Q,平衡树脂吸附量,mg/g;c,平衡浓度,mg/mL;a,常数。以c/Q对C作图得一直线,斜率为1/Qmax,截距为1/aQmax,进行方程回归并计算R12值。根据Freundlich等温方程:

式中:n,K为常数。
在双对数坐标下作图,LnQ=nLnc+LnK,得线性方程,进行回归并计算值。结果见表2,由表2可知:Langmuir模型比Freundlich模型能够更好的描述荔枝核黄酮在HPD800树脂上的吸附平衡过程,其相关系数R大于0.99。
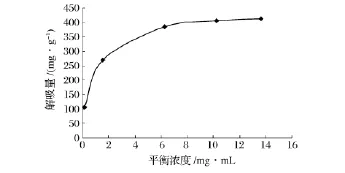
图3 HPD800树脂吸附等温线Fig.3 Adsorption isotherm of HPD800 macroporous resin
2.1.3 pH值对吸附的影响
分别测定荔枝核黄酮溶液在不同pH值3.0、4.0、5.0、6.0、7.0 时的静态吸附量,结果如图 4 所示。可以看出,一定的酸性条件有利于荔枝核类黄酮的吸附。其原因可能是类黄酮化合物含有酚羟基,在酸性条件下以分子状态存在,主要以范德华力与树脂进行物理吸附。因此确定吸附pH值5.0为宜。

表2 模拟方程参数计算结果Table 2 Calculated results of model parameters

图4 pH值对吸附特性的影响Fig.4 Effect of pH on adsorption performance
2.2 HPD800大孔树脂动态吸附的特性
2.2.1 流速对HPD800大孔树脂动态吸附的影响
荔枝核黄酮浓度32.0 mg/mL,温度25℃,pH值为5.0,控制不同吸附流速,收集流出液,测定黄酮含量,计算浓度差,绘制不同流速对浓度差的动态吸附曲线,结果见图5。吸附流速对吸附效果的影响显著,流速过快会导致树脂不能充分吸附,而造成吸附效果不佳,流速过慢时可能会造成部分已吸收的类黄酮被重新洗脱下来,也会使得吸附效果下降。从图5可以看出,3.0 mL/min为HPD800树脂对荔枝核黄酮提取液最适宜的吸附流速。
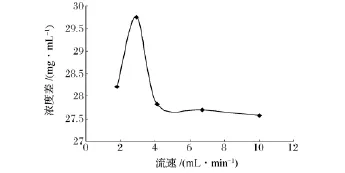
图5 吸附流速对树脂吸附特性的影响Fig.5 Effect of flowing velocity on adsorption performance
2.2.2 黄酮浓度对HPD800动态吸附的影响
将50mL不同浓度,pH值为5.0的荔枝核黄酮溶液在树脂柱高为20 cm,流速为3.0 mL/min分别进行吸附,收集流出液,测定黄酮含量,计算浓度差,绘制不同浓度对浓度差的动态吸附曲线,结果见图6。由图6可知,随着样品浓度的增加,吸附量逐渐增加,但是当浓度增加到30.8106 mg/mL后,吸附量随着浓度的提高,反而下降,可能因为荔枝核类黄酮浓度太高,溶解性降低不利于树脂对其吸附。综合考虑,适宜吸附的荔枝核类黄酮溶液浓度30.81 mg/mL。
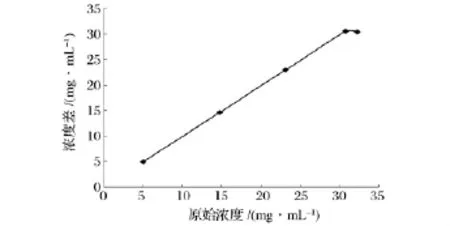
图6 黄酮浓度对树脂吸附特性的影响Fig.6 Effect of flavone concentration on adsorption performance
3 结论
(1)大孔树脂HPD800是吸附荔枝核黄酮较为理想的树脂。静态吸附平衡时间为10 h;吸附溶液适宜的pH值为5.0。
(2)通过吸附等温线,Langmuir模型比Freundlich模型能够更好的描述荔枝核黄酮在HPD800树脂上的吸附平衡过程,所得回归方程为:c/Q=c/434.78+1/1.35×434.78(R2=0.999 3),其相关系数R>0.99。
(3)树脂柱的较佳操作条件为:流速3.0 mL/min,荔枝核黄酮浓度30.81 mg/mL。
[1] 屠鹏飞,罗青,郑俊华.荔枝核的化学成分研究[J].中草药,2002,,3(4):300 -303.
[2] 郭洁文,潘竞锵.荔枝和荔枝核的化学成分、生物活性及药理作用研究[J].中国新药杂志,2006,15(8):585 -588.
[3] 任珅.荔枝核的化学成分及其降血糖活性研究[D].长春:长春中医药大学,2011:8-17.
[4] 梁荣感,刘卫兵,唐祖年,等.荔枝核黄酮类化合物体外抗呼吸道合胞病毒的作用[J].第四军医大学学报,2006,27(20):1 881 -1 883.
[5] 胡小军,江敏,陈晓林,等.荔枝核提取物抗氧化活性及红外光谱特性[J].食品工业科技,2011,32(10):170-172.
[6] 罗伟生,龚受基,梁荣感,等.荔枝核黄酮类化合物体外抗流感病毒作用的研究[J].中国中药杂志,2006,31(16):1 379-1 380.
[7] 徐庆,宋芸娟,李丽亚,等.荔枝核总黄酮的抗鸭乙型肝炎病毒作用[J].世界华人消化杂志,2005,13(17):2 082-2 085.
[8] 龚受基,苏小建,虞海平,等.荔枝核黄酮类化合物对SARS-CoV 3CL蛋白酶抑制作用的研究[J].中国药理学通报,2008,24(5):699 -700.
[9] 孙哲浩,李宝珍,赵谋明,等.响应面分析法优化荔枝核总黄酮提取工艺的研究[J].食品与机械,2006,22(1):30-32.
[10] 汤建萍,周春山,涂秋云,等.荔枝核黄酮类化合物的提取工艺研究[J].应用化工,2007,36(2):109 -113.
[11] Wei Han,Ruan Jin-lan,Lei Yong-fang,et al.Enrichment and purification of flavones from rhizomes of Abacopteris penangiana by macroporous resins[J].Chinese Journal of Natural Medicines,2012,10(2):119 -124.
[12] 朱华旭,刘小辉,唐于平,等.中药复方溶液环境对黄连生物碱大孔树脂吸附的动力学比较研究[J].离子交换与吸附,2011,27(5):416 -423.
[13] 候如燕,宛晓春,黄继轸.采用大孔树脂法纯化油茶皂苷的工艺条件[J].食品与发酵工业,2005,31(2):130-132.
[14] 徐青,卢莹莹,辛建美,等.大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J].食品科学,2011,32(2):115-118.
[15] 田徽,阮期平,赖恩阳,等.大孔树脂纯化马兰总黄酮树脂吸附特性及工艺的研究[J].食品与发酵工业,2012,38(1):224-227.
