南极磷虾粉中虾青素的提取*
2013-05-05孙来娣高华刘坤孙伟红邢丽红苗钧魁冷凯良
孙来娣,高华,刘坤,孙伟红,邢丽红,苗钧魁,冷凯良
1(中国水产科学研究院黄海水产研究所,山东青岛,266071)2(青岛大学医学院,山东青岛,266021)
南极磷虾粉是以南极磷虾为原料,经蒸煮、压榨、烘干、粉碎等工序制成的具有独特营养功能和质量属性的水产动物饲料[1]。由于含有丰富的优质蛋白、氨基酸、天然色素虾青素、矿物质元素以及低脂肪等,其在水产饲料中的应用越来越广泛,并发挥着不可比拟的优势[2-5]。有资料显示,南极磷虾粉中虾青素含量在100~300 mg/kg[6],其对水产动物可以起到强免疫、着色、保鲜的作用,是1种重要的鱼类生长调节剂[7-8]。目前有关虾青素提取测定方法的研究主要集中在红球藻和红发夫酵母菌上,而有关南极磷虾虾青素的提取测定的研究报道甚少。
目前提取虾青素最常用的方法是溶剂萃取法,该法工艺提取条件简单。本课题以南极磷虾粉为原料,研究了溶剂浸提法提取虾青素的实验条件,考察了提取溶剂、提取温度、料液比、提取时间等因素对虾青素含量的影响,并结合响应曲面法优化了虾青素提取方法,以期为南极磷虾的产业化开发利用提供科学依据。同时,本实验采用分光光度法测定磷虾粉中的虾青素,通过借鉴美国FDA法计算虾青素含量。FDA公式计算法由于具有操作简便、无需标准对照品、数据真实可靠等优点,与外标一点法和标准曲线法相比具有明显的优势,这为快速简便地测定磷虾粉中的虾青素提供了基础[9-11]。
1 实验材料与方法
1.1 试验材料
UV-2000紫外-分光光度计,尤尼柯仪器有限公司;BSA224S-CW分析天平,赛多科斯科学仪器有限公司;CR22G高速冷冻离心机,日本Hitachi公司;N-EVAP112氮吹仪,美国 Organomation公司;ISRDS3恒温振荡器,美国精湛有限公司;涡旋混合器,无锡活信仪器有限公司;甲醇、乙腈、乙酸乙酯、二氯甲烷、二甲基亚砜(DMSO)、丙酮、2,6-二叔丁基对甲酚(BHT)等有机试剂。
南极磷虾粉样品,由辽宁远洋渔业有限公司提供。
1.2 实验方法
1.2.1 提取测定方法
将南极磷虾粉粉碎并过100目筛网,得到粗细均匀的粉末。准确称取上述粉末0.5 g,按一定料液比(mL∶g)加入二氯甲烷-甲醇(体积比 1∶3)溶液,于设定温度下恒温浸提一定时间。取出流水冷却后,5℃、8 000 r/min离心5 min,取5 mL上清液氮气吹干,然后用DMSO溶解并定容至5 mL,以DMSO为参比溶液,于489 nm下测定吸光度值。
1.2.2 含量计算方法[9]
南极磷虾粉中虾青素的含量计算采用美国食品药品监督管理局(FDA)提供的方法,其具体计算公式为:

式中:X为虾青素的总含量,%;A489为489 nm下的吸光度值;V为提取样品的体积,mL;f为稀释倍数;1908为消光系数;m为所称取的南极磷虾粉质量,g。
1.3 试验设计
1.3.1 单因素实验
在保持其他条件不变的情况下,分别考察提取溶剂、提取温度、提取时间、料液比等主要因素对虾青素提取效果的影响,具体的单因素实验设计见表1。

表1 南极磷虾粉中虾青素提取单因素试验Table 1 Univariate experiments for extracting astaxanthin from Antarctic krill powder
1.3.2 响应曲面优化法实验设计[12-13]
在单因素实验基础上,采用Box-Behnken设计数学模型,确定二氯甲烷-甲醇(体积比1∶3)为提取溶剂,选取提取温度、料液比、提取时间3个对虾青素提取效果影响显著的因素,分别以A、B和C为代表,每个自变量的低、中、高试验水平分别以-1、0、1进行编码。以虾青素的含量(Y)为响应值,对南极磷虾粉中虾青素的提取方法进行三因素三水平优化实验设计,利用Design-Expert 7.0软件进行数据处理和回归分析。具体的试验因素与水平设计见表2。
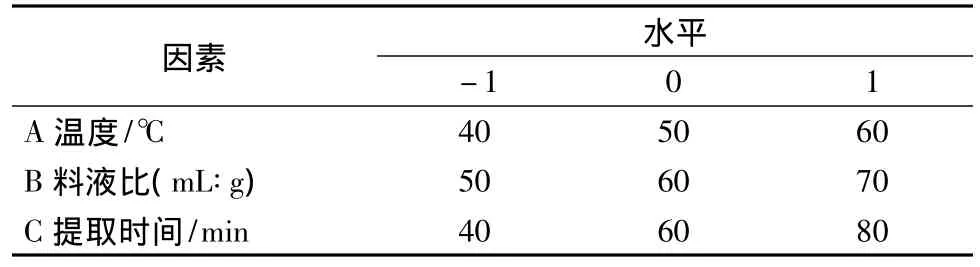
表2 响应面分析因素与水平Table 2 Variables and levels in response surface design
2 结果与分析
2.1 单因素试验结果
2.1.1 提取溶剂对虾青素提取效果的影响
由图1可知,以混合试剂二氯甲烷-甲醇(体积比1∶3)为提取溶剂,所得样品溶液的含量最大,而以乙酸乙酯、二氯甲烷、二甲基亚砜(DMSO)为提取溶剂的提取效果相当。这是因为虾青素是弱极性化合物,根据相似相容原理其在弱极性溶剂二氯甲烷中的溶解度较大;另外,较单一溶剂而言,复合溶剂则更易深入虾粉组织细胞内将结合在组织细胞中的虾青素充分浸提出来,从而使得提取效果显著。
同时,本实验还考察了不同配比的二氯甲烷和甲醇对提取效果的影响。结果发现,随着二氯甲烷比例的增加,虾青素含量变化并不明显,高比例的二氯甲烷反而使样品中的脂质成分被不同程度地浸提出来,导致溶液的浑浊度增加,这给样品溶液的浓缩、测定带来干扰。因此,综合考虑各因素,实验选择二氯甲烷-甲醇(体积比1∶3)为提取溶剂进行后续研究。
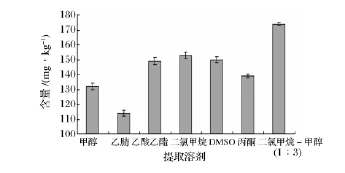
图1 提取溶剂对虾青素提取效果的影响(n=3)Fig.1 Effect of extraction solvent on the extraction result of astaxanthin(n=3)
2.1.2 提取温度对虾青素提取效果的影响
由图2可知,在20~50℃内,随着提取温度的升高,虾青素含量呈逐渐上升的趋势,在50℃时虾青素含量达到最高;随后,随着提取温度的升高,虾青素受热易被氧化降解,致使其含量呈缓慢下降的趋势。实验在综合考虑各因素的条件下,选择50℃作为最佳提取温度。

图2 提取温度对虾青素提取效果的影响(n=3)Fig.2 Effect of extraction temperature on the extraction result of astaxanthin(n=3)
2.1.3 提取时间对虾青素提取效果的影响
由图3可知,在恒温浸提60 min之前,虾青素未能充分地转移到溶液中,随着提取时间的增加,虾青素含量呈逐渐上升的趋势,在60 min时虾青素含量达到最高;之后,随着浸提时间的增加,虾青素含量呈明显下降的趋势。实验在综合考虑各因素的条件下,选择60 min作为最佳提取时间。
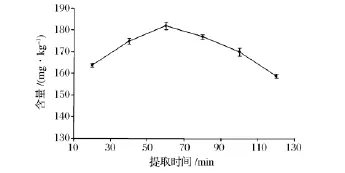
图3 提取时间对虾青素提取效果的影响(n=3)Fig.3 Effect of extraction time on the extraction result of astaxanthin(n=3)
2.1.4 料液比对虾青素提取效果的影响
由图4可知,在30~60 mL/g内,随着提取溶剂的增加,虾青素含量呈逐渐增高,这是因为溶剂与原料间的浓度差越大,就越有利于目标物虾青素的溶出,其提取效率也就越高,当料液比为60∶1(mL∶g)时虾青素含量达到最大;随后,虾青素含量略有下降,表明提取基本完全。在综合考虑各因素的条件下,选择60∶1(mL∶g)作为适合的料液比。
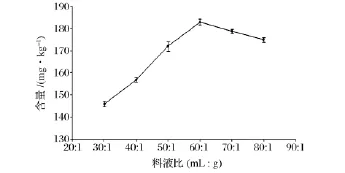
图4 料液比对虾青素提取效果的影响(n=3)Fig.4 Effect of liquid/soild ratio on the extraction result of astaxanthin(n=3)
2.2 响应曲面实验结果及方差分析
利用软件Design-Expert 7.0进行试验设计,本次试验共有17个试验点,分为两类:其一是析因点,自变量取值在各因素所构成的三维顶点,共有12个析因点;其二是零点,为区域的中心点,零点试验重复5次,用以估计试验误差,并以虾青素含量为响应值。Box-Behnken方案设计与响应曲面法实验结果见表3。

表3 Box-Behnken方案设计与响应曲面法实验结果Table 3 Design of Box-Behnken experiment and results of response surface methodology
利用Design-Expert 7.0软件对表3实验数据进行多元回归拟合,得到南极磷虾虾青素含量(Y)对提取温度(A)、料液比(B)和提取时间(C)的二次回归模型为:Y= -473.30+5.54A+14.11B+2.11C+0.007 9AB-0.006 3AC-0.008 3BC-0.055A2-0.11B2-0.010C2。
2.3 模型显著性检验
对上述回归模型进行显著性检验,结果见表4。
由表4可知,模型的P<0.01,表明回归模型极显著,可以用模型分析、预测南极磷虾虾青素提取方法结果;A、B、C、BC对虾青素含量有着显著影响,A2、B2、C2对虾青素含量的影响达到极显著水平。由F值可知,各因素对虾青素含量的影响次序为:料液比二次项>料液比一次项>温度二次项>时间二次项>温度一次项>时间一次项;此外,从方差分析结果可知,R2=0.990 3,表明该模型与试验拟合较好。提取温度、料液比、提取时间之间的相互作用见图5~图7。
通过软件分析,得到虾青素提取的最佳条件为:提取温度51.41℃、料液比63.13∶1(mL∶g)、提取时间61.15 min。在此条件下,虾青素理论含量为179.00 mg/kg。为检验响应曲面法所得结果的可靠性,采用上述优化条件提取虾青素,考虑到实际操作的便利,将提取参数修正为:提取温度51℃、料液比63 mL/g、提取时间61 min。在此修正条件下提取得到的虾青素平均含量为179.21 mg/kg,与理论预测值相比,其相对误差小于l%。因此,基于响应曲面法所得的优化提取方法参数准确可靠,具有实用价值。
2.4 优化条件下提取不同南极磷虾粉样品中的虾青素
实验分别以市售南极磷虾粉产品以及大连辽渔集团、山东科芮尔公司、青岛福卡公司提供的南极磷虾粉样品为材料,在上述优化条件下分别提取虾青素,测得的虾青素含量见表5。
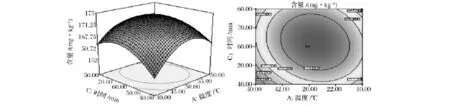
图6 提取温度与提取时间对虾青素含量影响的响应面图Fig.6 Response surface and contour plots for the interactive effect of extraction temperature and extraction time onastaxanthin content
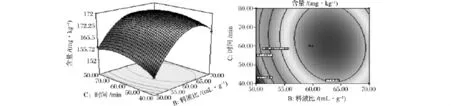
图7 料液比与提取时间对虾青素含量影响的响应面图Fig.7 Response surface and contour plots for the interactive effect of liquid/soild ratio and extraction time onastaxanthin content
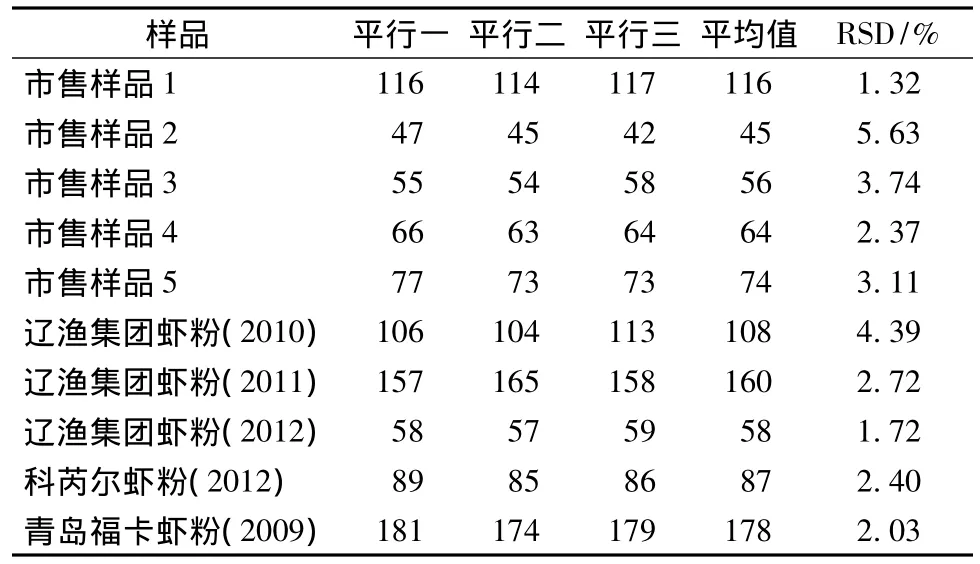
表5 优化条件下提取所得南极磷虾粉样品中的虾青素含量Table 5 Astaxanthin content of Antarctic krill powder samples under optimized extraction conditions
由表5可以看出,磷虾粉样品中的虾青素含量在42~181 mg/kg,大多数样品中的虾青素含量低于100 mg/kg,分析原因可能是因为磷虾粉在生产贮运过程中常暴露于空气、光照下,其中的虾青素已被不同程度地氧化降解,致使含量减少[14-15];同时从检测的结果还可以看出:即使是同一生产企业,其不同生产年限的磷虾粉中的虾青素含量也有显著差异,分析原因可能是生产原料和加工工艺不同而使然。
3 结论
通过单因素实验优化南极磷虾虾青素的提取条件,根据Box-Behnken设计法进行试验设计并分析处理数据,最终通过响应面的分析得出最佳的虾青素提取条件为:提取温度51.41℃、料液比63.13∶1(mL∶g)、提取时间61.15 min,得到的理论含量为179.00 mg/kg。将方法条件修正后,实验所得的虾青素含量为179.21 mg/kg。通过响应面的分析结果可知,影响虾青素含量的提取因素依次为:料液比>提取温度>提取时间。同时,采用分光光度测定法和美国FDA提供的公式计算法能够快速准确地测定、计算出虾青素含量,适合于探索性试验的大批量快速进行。
[1] 徐吟梅,邱卫华,余丽萍,等.南极磷虾粉的营养与功能[J].现代渔业信息,2010,25(8):14 -16.
[2] 孙雷,周德庆,盛晓风.南极磷虾营养评价与安全性研究[J].海洋水产研究,2008,29(2):57 -64.
[3] Bunji Yoshitomi,Hideaki Yamaguchi.Chemical composition of dried eyeballs from Euphausia superba and Euphausia pacifica[J].Fisheries Science,2007,73:1 186 - 1 194.
[4] Fricke H,Gercken G,Schreiber W,et al.Lipid,sterol and fatty acid composition of antarctic krill(Euphausia superba Dana)[J].Lipids,1984,19(11):821 -827.
[5] Caroli S,Senofonte O,Caimi S,et al.Kramer,G NA pilot study for the preparation of a new Reference Material based on Antarctic krill[J].Fresenius'Journal of Analytical Chemistry,1998,360:410 -414.
[6] Ali-Nehari A,Kim S,Lee Y,et al.Characterization of oil including astaxanthin extracted from krill(Euphausia superba)using supercritical carbon dioxide and organic solvent as comparative method[J].Korean Journal of Chemical Engineering,2012,29(3):329 -336.
[7] 温为庚,林黑着,吴开畅,等.饲料中添加虾青素对斑节对虾生长和免疫指标的影响[J].中山大学学报:自然科学版,2011,50(3):144 -146.
[8] 李艳艳,翟占军,张银花,等.虾青素在水产养殖上的应用[J].北京农学院学报,2009,24(2):78 -80.
[9] Analysis of total Astaxanthin in algae meal prepared from Haematococcus pluvialis[R].USA:Aquasearch Inc.,1999.
[10] 许培雅,郑裕国,沈寅初.分光光度法测定红发夫酵母中虾青素含量[J].浙江工业大学学报,2001,29(2):120-135.
[11] 王灵昭.雨生红球藻中虾青素提取方法的比较研究[J].食品研究与开发,2008,29(7):16 -19.
[12] 杨建远,周筱玲,王萍兰,等.响应曲面法优化庐山楼梯草多糖的提取工艺[J].食品研究与开发,2011,32(12):48-52.
[13] 李光,余霜,邓银,等.响应曲面法优化红薯叶多酚提取工艺研究[J].广东农业科学,2011,22:80-82.
[14] 魏东,严小君.天然虾青素的超级抗氧化活性及其应用[J].中国海洋药物,2001,82(4):45 -50.
[15] Martin G,Mark E H,Miguel O.Haematococcus astaxanthin:applications for human health and nutrition[J].Trends Biotechnol,2003,(21):210 -216.
