胶束增敏荧光光度法测定兔血样中阿霉素
2013-05-03付玉丽程秀梅廖秀林杨秀培
钱 帆,付玉丽,程秀梅,廖秀林,杨秀培
(西华师范大学化学化工学院,四川 南充 637000)
0 引 言
阿霉素(DOX)是一种有效的抗癌药物,被广泛用于癌症的化疗,且已被美国药典收录[1]。在化疗过程中,DOX有严重的副作用,当用量超过550mg/m2时,就会有大于18%的概率出现不可逆的心脏毒性[2];因此,DOX在临床上应正确使用并严格控制用量。应用一种简单、快速且灵敏的方法进行监控及其药物代谢研究也是非常必要的。图1显示了DOX的化学结构,其本身具有一定的紫外吸收及荧光性能。目前,测定DOX的方法有光谱法[3]、伏安法[4]、差示极谱法[5]、毛细管电泳法[6]及液相色谱法[7]等,其中,荧光法具有方便、快速的特点,被广泛应用于众多实验室及医疗院所[8]。尽管荧光法测定阿霉素已有文献报道[9-10],但一般荧光法的灵敏度不能满足临床监测的实际需求;因此,许多学者对提高阿霉素荧光检测的灵敏度进行了研究[11-12]。本文首次提出利用十六烷基三甲基溴化铵(CTAB)对阿霉素荧光强度的增敏作用,建立胶束增敏荧光光度法测定DOX的新方法,并应用于兔血样的分析。

图1 阿霉素结构
1 实验部分
1.1 仪 器
RF-5301PC荧光分光光度计(日本岛津公司),Waters液相色谱仪-荧光检测器(美国沃特斯公司),pH酸度计(美国奥豪斯公司),电子天平(美国奥豪斯公司),智能超声波清洗器(上海之信仪器有限公司),离心机(上海卢湘仪)。
1.2 试 剂
盐酸阿霉素(Sigma公司,USA),十六烷基三甲基溴化铵(CTAB)、四丁基溴化铵、十二烷基磺酸钠、磷酸盐、乙腈、甲醇、无水乙醇(成都科龙化工试剂厂),十二烷基硫酸钠(天津滨海科迪化学试剂有限公司),硼酸(上海外岗化工二厂),所用试剂均为分析纯或以上,实验用水均为三次水。
1.3 标准溶液及兔血样的制备
标准溶液的配制:配制质量浓度为1.0mg/mL的阿霉素储备液,放置于4℃下保存。每次实验前准确移取适量的储备液,配制所需阿霉素标准溶液。
兔血样的制备:将1.2mL兔血清移入5mL离心管中,加入一定量的阿霉素标准溶液,再加入1.2mL乙腈,于高速离心机中离心去蛋白。取离心后的上层清液,再加入CTAB和硼酸缓冲溶液-乙醇混合液定容,随后进行测定。
1.4 实验步骤
将一定量的阿霉素标准溶液、一定量的CTAB溶液和硼酸缓冲溶液加至10mL容量瓶中,定容至刻度,摇匀后测定其荧光强度。用1mL的石英比色皿,以480 nm的波长激发,测定发射光谱的荧光强度。
2 结果与讨论
2.1 荧光波长的选择
分别测定浓度为75ng/mL的阿霉素在硼酸缓冲溶液及CTAB-乙醇-硼酸缓冲液混合体系中的荧光光谱,如图2所示。阿霉素的最大激发波长与最大发射波长分别为480 nm和593 nm。两种体系看来,CTAB及乙醇的加入对最大发射波长没有多少影响,但对阿霉素的荧光强度有明显增强。本实验选择的激发波长与发射波长分别为480nm和593 nm。

图2 阿霉素在不同体系中的荧光光谱
2.2 表面活性剂种类的选择
分别比较了十六烷基三甲基溴化铵(CTAB)、四丁基溴化铵、十二烷基硫酸钠和十二烷基磺酸钠等表面活性剂对阿霉素(5.0 ng/mL)荧光强度的影响,如图3所示。几种表面活性剂中,CTAB对阿霉素荧光有增强作用,故选CTAB作为增敏剂。
2.3 CTAB浓度的优化
详细考察了0~2.5mmol/L CTAB的浓度对阿霉素(7.5 ng/mL)荧光强度的影响,其他条件均为优化值。如图4所示,当CTAB的浓度小于1.9mmol/L,阿霉素的荧光强度随着浓度的增加先剧烈增大然后变缓,当CTAB的浓度大于1.9mmol/L,阿霉素的荧光强度随着浓度的增加而降低。这可能是因为CTAB浓度在小于1.1mmol/L达到其胶束浓度值时,溶液中的游离氧对荧光强度有一定的猝灭作用,随着CTAB浓度的增加,溶液中的游离氧则逐渐下降,从而减小了溶解氧对荧光的猝灭作用;浓度大于1.1mmol/L后,CTAB浓度大于其临界胶束浓度而在溶液中形成胶束,降低了阿霉素分子活动的自由度,从而减少了与其他溶剂或溶质分子的碰撞猝灭作用;但当CTAB浓度大于1.9mmol/L时,可能体系过高的黏性导致荧光强度反而下降。因此,CTAB的最佳浓度确定为1.9mmol/L。

图3 不同表面活性剂对阿霉素荧光强度的影响
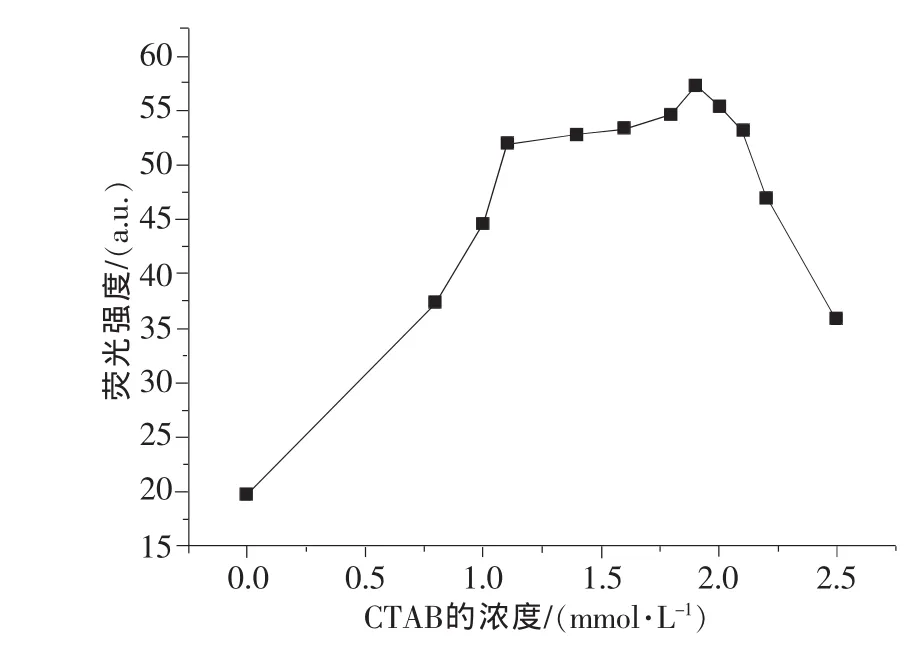
图4 CTAB的浓度对阿霉素荧光强度的影响
2.4 缓冲溶液的pH值及浓度对阿霉素荧光强度的影响
本实验对硼酸缓冲液的pH值及浓度作了考察。图5和图6分别显示了硼酸缓冲液pH值及浓度对阿霉素(5.0 ng/mL)荧光强度的影响,其他条件均为优化值。当pH值小于6.0时,荧光强度随着pH的增大而增大,当pH值大于6.0时,荧光则逐渐的降低。这是因为阿霉素在碱性及过酸条件下不稳定,碱性过强时甚至结构会被破坏,因此,在随后的实验中,6.0作为缓冲溶液的最佳pH值。从图6可以看出,缓冲液浓度为17mmol/L时可以得到最大荧光强度;因此,选择17mmol/L pH为6.0的硼酸缓冲溶液进行实验。
2.5 乙醇含量的影响
实验中发现添加一定的乙醇会增强阿霉素的荧光,随后考察了乙醇含量(0%~80%,v/v)对阿霉素(10.0 ng/mL)荧光强度的影响,其他条件为优化值,如图7所示。在含量为60%以下时,阿霉素的荧光随乙醇含量的增加而增强,然而当大于60%时,阿霉素荧光急剧减弱;因此,乙醇含量确定为60%(v/v)较为适宜。
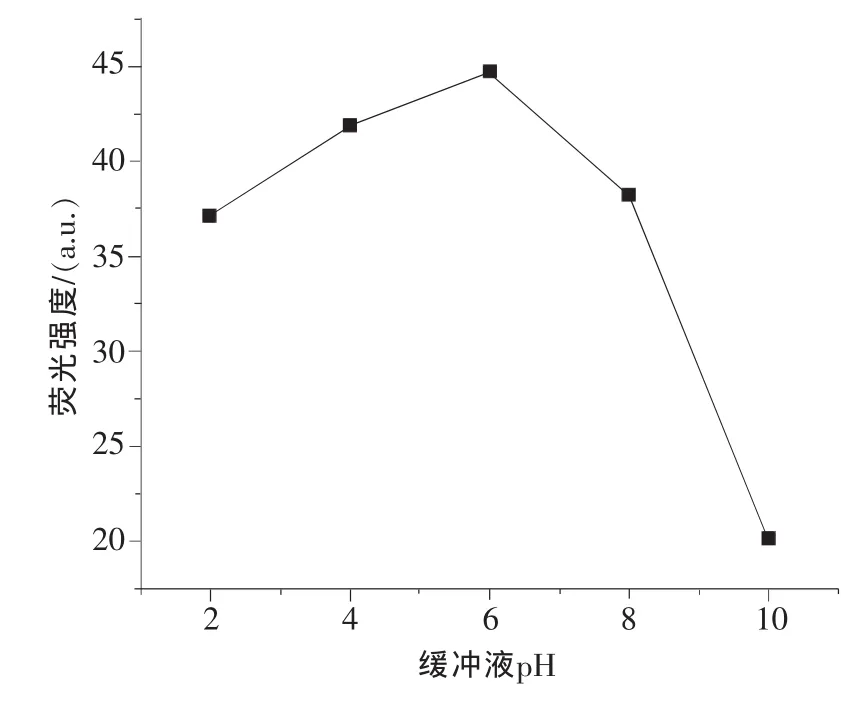
图5 缓冲液pH对阿霉素荧光强度的影响

图6 缓冲液浓度对阿霉素荧光强度的影响
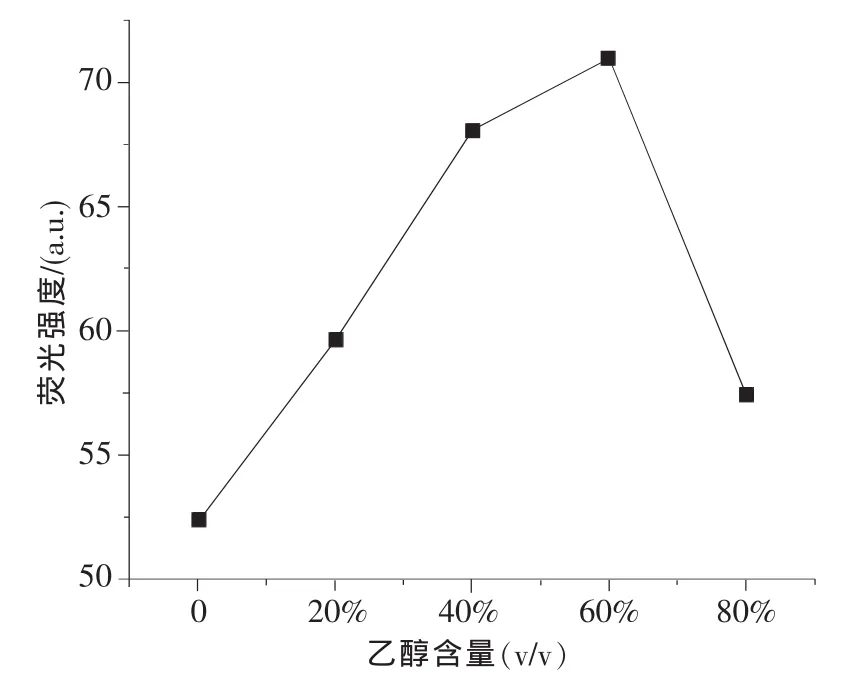
图7 乙醇含量对阿霉素荧光强度的影响
2.6 线性范围与检出限
在480nm的激发波长下,测定不同浓度的阿霉素混合体系(pH=6.0,17mmol/L硼酸缓冲液含60%乙醇(v/v)、1.9mmol/L CTAB)。得到标准曲线方程为
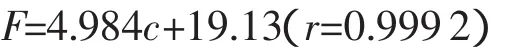
式中:F——体系荧光强度;
c——阿霉素浓度,ng/mL。
线性范围为0.5~120 ng/mL,测得检出限为0.161ng/mL(3S/N,n=10)。该灵敏度比同类文献[13]报道的6.3×10-8mol/L约提高了两个数量级。
2.7 加标回收率的测定
兔血取于市场上健康的家兔,在实际兔血样中没有检出阿霉素,因此将不同阿霉素加标量的兔血样品进行去蛋白处理后,采用如上荧光法进行回收率测定试验,结果如表1所示。其回收率在93.7%~105.6%之间,相对标准偏差RSD为1.1%~1.5%,说明该方法具有较高的准确度。

表1 加标回收率测定结果(n=5)
2.8 与高效液相色谱法对比
药典[14]中收录的阿霉素检测方法为高效液相色谱-紫外检测法,该方法灵敏度较低,其线性范围的下限要大于新方法线性范围的上限,无法很好准确的进行方法对比,因此本工作采用文献[7]中报道的高效液相色谱-荧光检测法(HPLC-FLD)来测定加标兔血样品来对比验证新方法的准确度。色谱柱为反相Nucleosil C18柱,流动相为甲醇与0.01mol/L磷酸盐缓冲液的混合液(65∶35,v/v;pH 2.96),流速为2mL/min,检测的激发波长与发射波长分别为480nm和593nm,进样量为20μL。表2中给出了所提新方法及HPLC-FLD法对加标兔血样的测定结果,证明了新方法可替代HPLC法用于临床阿霉素含量的快速测定。

表2 CE及HPLC法测定加标兔血样结果(n=5)
3 结束语
本文研究了硼酸缓冲液pH值及浓度、有机溶剂和CTAB浓度等条件对体系荧光强度的影响,建立了兔血清中阿霉素表面活性剂增敏荧光光谱测定方法。结果显示,在硼酸缓冲液pH=6.0、浓度为17mmol/L且含 60%乙醇(v/v)、1.9mmol/L CTAB 的条件下,体系荧光强度在0.5~120 ng/mL有良好的线性关系,且检测限为0.161ng/mL,测定实际样品的相对标准偏差为1.1%~1.5%,回收率在93.7%~105.6%,该法可用于临床阿霉素含量的快速测定。
[1]De B E L,Bottone A E,Voest E E.Doxorubicin and mechanical performance of cardiac trabeculae after acute and chronic treatment:a review[J].Eur J Pharmacol,2001,415(1):1-11.
[2]Herman A H,Rahman H,Ferrans V J,et al.Prevention of chronic doxorubicin cardiotoxicity in beagles by liposomal encapsulation[J].Cancer Res,1983,43(11):5427-5432.
[3]Trevisan M G,Poppi R J.Determination of doxorubicin in human plasma by excitation-emission matrix fluorescence andmulti-way analysis[J].Anal Chim Acta,2003,493(1):69-82.
[4]杨志洁,刘盛辉,叶建农,等.浸蜡石墨电极伏安法测定抗癌药物盐酸阿霉素[J].分析化学,1996,24(4):471-474.
[5]谭学才,李启隆,尚军.阿霉素的示波极谱法[J].分析化学,1996,24(7):764-767.
[6]Anderson A G,Gergen J,Arriaga E A.Detection of doxorubicin and metabolites in cell extracts and in single cells by capillary electrophoresis with laser-induced fluorescence detection[J].J Chromatogr B,2002,769(1):97-106.
[7]Álvarez-Cedrón L,Sayalero M L,Lanao J M.Highperformance liquid chromatographic validated assay of doxorubicin in rat plasma and tissues[J].J Chromatogr B,1999,721(2):271-278.
[8]许金钩,王尊本.荧光分析法[M].3版.北京:科学出版社,2006:1-2.
[9]赵刚,胡增华,黄力明,等.荧光光谱法测定人血浆中国产阿霉素浓度及临床药代动力学观察[J].云南医药,1994,15(5):377.
[10]闫继东,辛华,郑雅娟,等.应用荧光分光光度法测定血清及组织中阿霉素含量[J].中国实验诊断学,2007,11(5):596-597.
[11]赵一兵,马学芳,郭祥群,等.阿霉素的荧光测定研究[J].厦门大学学报:自然科学版,1993,32(6):753-757.
[12]李凤云,陈浩然,赵凤欣,等.荧光法测定阿霉素的血药浓度[J].应用化学,2011,28(3):343.
[13]张跃华,王南平,张其平,等.β-环糊精与阿霉素相互作用荧光光谱[J].黑龙江医药,1996,9(5):243.
[14]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:693-694.
