酪氨酸钆配合物的合成、表征及其与DNA的作用方式
2013-04-30尹江龙陈巧飞刘梦云王志航
尹江龙,刘 磊,陈巧飞,刘梦云,王志航,张 祎,孙 彦,赵 地,武 文
(周口师范学院 化学系,河南 周口466001)
近些年来,稀土金属配合物作为DNA结构和构象的探针,一直是较活跃的研究领域.稀土金属元素是一种重要的生化试剂,具有特殊的电子结构.稀土金属元素与配体配位,不仅会降低金属元素的毒性,还可表现出其特殊的生理活性,并在化学和生物化学催化系统中起着很关键的作用[1].以氨基酸和稀土金属形成的配合物作为抗癌药物也可能会产生协同效应[2],从而能够提高药物与人体的生物抗癌活性和相容性.目前,欧阳泽英等[3]采用紫外光谱法、荧光光谱法和黏度法研究了2-苯并咪唑亚甲基配合物与DNA的作用,认为它是以静电和部分插入模式与DNA发生相互作用的.曹惠平、杨立荣等[4,5]采用荧光、紫外光谱、黏度等方法分别探讨了酚氧桥联型双核Eu(Ⅲ)配合物和DNA之间的相互作用以及铕(Ⅲ)-牛磺酸席夫碱配合物与DNA的作用方式,认为它们和DNA之间存在插入作用.吴惠霞等[6]采用电化学方法研究了铈氨基酸配合物与小牛胸腺DNA之间的相互影响和相互作用,并探讨了他们之间的相互作用方式.目前,稀土与氨基酸、肽、蛋白质等生物分子的作用研究吸引了大批的科研工作者.特别是近三十年来,稀土氨基酸二元配合物的研究[7]已经进行得比较全面,研究内容涉及配合物的组成、合成方法、溶解性、红外和应用等.关于酪氨酸 钆配合物与DNA作用的研究还很少.为此,本文作者通过紫外光谱法、荧光光谱法对酪氨酸 钆(Ⅲ)稀土配合物与小牛胸腺DNA的作用进行较全面、系统的研究.舍弃了原有毒性较强的EB探针[8],采用了相对比较环保的甲基橙作为探针,渴望对抗癌药物的抗癌机理提供有价值的信息.
1 实验部分
1.1 仪器与试剂
V-530紫外分光光度计;WQF-510红外光谱仪;FP-750荧光光谱仪(日本分光公司);微量计量计;恒温磁力搅拌器;电子天平等.
小牛胸腺DNA;L-酪氨酸;硝酸钆;Tris;盐酸;无水乙醇;甲基橙;蒸馏水等.
1.2 试验方法
1.2.1 合成Gd(Ⅲ)-酪氨酸配合物
(1)称取一定量的硝酸钆,配制Gd(Ⅲ)溶液.
(2)用无水乙醇溶解Tyr,并加入1~2滴浓盐酸,使氨基酸溶解完全并配制成溶液.
(3)把一定物质的量配比的Tyr与Gd(Ⅲ)溶解在无水乙醇中并反应.
(4)水浴加热并搅拌,调pH=3~5,反应2~4 h.
(5)浓缩,静置结晶,洗涤,干燥.
1.2.2 配制DNA溶液
(1)称取一定量的DNA,配成浓度为10-7的DNA溶液.
(2)称取一定量的钆 酪氨酸配合物,使其溶解.
(3)把DNA溶液加入到配合物中,使其反应一段时间.
1.2.3 配制甲基橙溶液
称取一定分析纯的甲基橙,配成浓度为10-5的溶液.
2 结果与讨论
2.1 钆酪氨酸及配合物的红外光谱
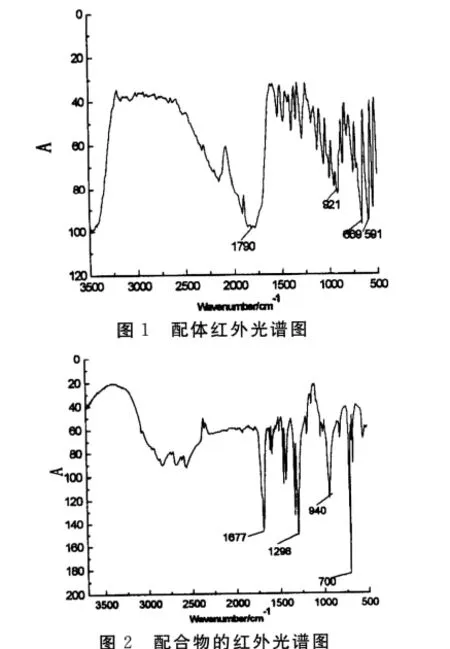
酪氨酸的红外光谱如图1所示.通过反应合成得到的酪氨酸 钆配合物的红外光谱图如图2所示.由图2可知:配合物羧基的特征吸收峰位置为1 677cm-1,与单纯的氨基酸的峰值[9]发生了变化,可以说明配体氨基酸与金属离子发生了一定的配位作用.
2.2 钆酪氨酸及配合物的紫外光谱
配体酪氨酸与钆 酪氨酸配合物的紫外光谱图如图3所示.由图3可知:配合物的紫外吸收强度与配体酪氨酸的紫外吸收强度[10]发生了比较明显的变化,可以说明酪氨酸与稀土金属离子发生了配位作用,生成了配合物.
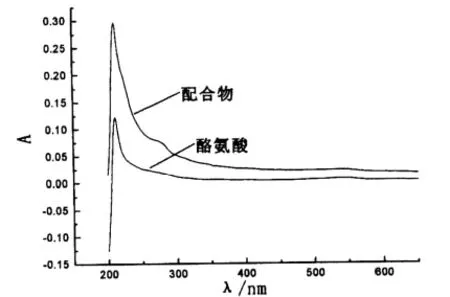
图3 酪氨酸与钆 酪氨酸配合物的紫外光谱图
2.3 Gd(Ⅲ)对Tyr荧光光谱的影响及其结合比
金属离子Gd(Ⅲ)对酪氨酸荧光光谱的影响如图4所示.由图4可知:固定Gd的浓度,随着金属离子物质量的增加,酪氨酸在波长为545nm处的荧光值逐渐降低,可以表明酪氨酸与钆之间发生了进一步的相互作用[11,12].
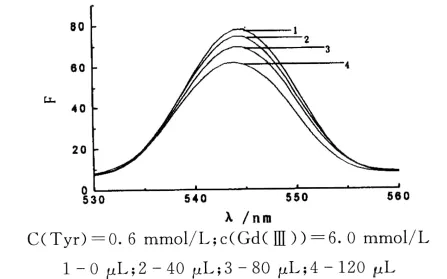
图4 钆对酪氨酸配合物荧光光谱的影响图
2.4 以甲基橙为探针研究 Gd(Ⅲ)(Tyr)3 与DNA的作用方式
甲基橙对DNA Gd(Tyr)3体系的荧光吸收强度的影响如图5所示.由图5可知:向DNA Gd(Ⅲ)(Tyr)3溶液中逐渐滴加甲基橙溶液,随着甲基橙体积的增加[13-15],DNA-Gd(Ⅲ)(Tyr)3体系在551nm处的荧光强度逐渐降低,可以说明甲基橙对此体系产生了一定的影响,很可能是与该体系中的 DNA 发生了相互作用[16,17].
3 结论
(1)测得在生理pH=7.40时,配合物 Gd(Ⅲ)(Tyr)3与DNA形成一定結合力的复合物.
(2)配合物 Gd(Ⅲ)(Tyr)3与 DNA 的结合能力没有甲基橙与DNA的结合能力强.
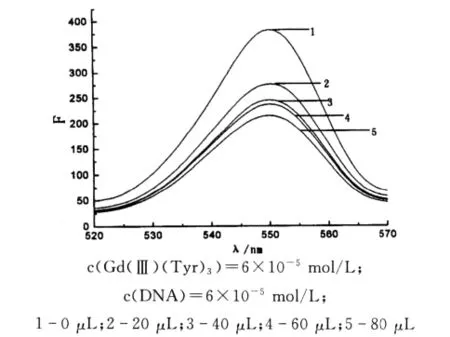
图5 甲基橙对DNA-Gd(Tyr)3体系的荧光光谱图
[1]曹惠平,高飞.酚氧桥联型双核Eu(Ⅲ)配合物的合成、表征及与DNA作用研究 [J].化学研究与应用,2009,21(7):1019-1023.
[2]杨立荣,邵彩云,毕彩丰,等.铕(Ⅲ)牛磺酸席夫碱配合物的合成、表征及其与DNA的作用模式 [J].应用化学,2009,26(8):913-917.
[3]吴惠霞,吴霞琴,沈鹤柏,等.铈(Ⅲ)-氨基酸二元配合物与 DNA 的相互作用 [J].稀土,1999,20(6):1-3.
[4]Zhang G W,Guo J B,Pan J H,et al.Spectroscopic studies on the interaction of morin Eu(III)complex with calf thymus DNA [J].Biochem Biophys Methods,2009(923):114-119.
[5]宋玉民,杨培菊,王流芳,等.全反式维甲酸合钐配合物与DNA 作用的研究 [J].化学学报,2003,61(16):1266-1270.
[6]Dutta S,Basu S.Interaction of phenazine with water and DNA basis [J].Chemical Sciences Division,SahaInstitu te of Nuclear Physics,India,2004,71(10):333-354.
[7]陈季武,胡天喜,朱大元.11种黄酮类化合物清除超氧阴离子的构效关系研究 [J].中国药学杂志,2002,37(1):57-58.
[8]费丹,王兴明,黎泓波,等.亚甲基蓝与鲱鱼精DNA相互作用的光谱法研究 [J].化学学报,2008,66(4):443-448.
[9]彭斌,巢晖,计亮年.含萘环结构的手性SalenMn(Ⅲ)配合物与DNA的相互作用 [J].中国科技论文在线,2008,3(9):698-702.
[10]钟地长,张淑凤,陈振锋,等.天然产物黄酮类化合物的提取、纯化及其金属配合物的研究进展 [J].化学世界,2006,9(10):561-573.
[11]Yamashita Y,Kawada S Z.Induction of mammalian topoisomerase II dependent DNA cleavage bynonintercalative flavonoids,genistein and orobol[J].Biochemical Pharmacology,1990,39(4):737-744.
[12]Comard J P,Merlin J C.Comparison of chelating power of hydroxyl flavones[J].Journal of Molecular Structure,2003,651-653:381-387.
[13]文镜,贺素华,杨育颖,等.保健食品清除自由基作用的体外测定方法和原理 [J].食品科学,2004,25(11):190-195.
[14]Zhou J,Wang L F,Wang J Y,et a1.Antioxi dativeand antitumour activities of solid quereetin metal(II)complexes[J].Transh Metal Chem,2001,26(10):57-63.
[15]Bravo A,Anacona J R.Metal complexes of the flavonoid quercetin:antibacterial properties [J].Transit Metal Chem,2001,26(10):20-23.
[16]咸会朵,刘建风,赵国良.十一烯酸邻菲咯啉铜髤配合物的合成、表征、晶体结构及与DNA作用 [J].无机化学学报,2009,25(11):2066-2069.
[17]杨昌英,刘义,曾芳,等.两种荧光探针法研究三种非甾体抗炎药与DNA的相互作用 [J].化学学报,2007,65(18):2076-2080.
