利用扫频畸变产物耳声发射实现听力损失的快速检测
2013-04-29陈世雄李光林
陈世雄 邓 军,2 李光林
1(中国科学院深圳先进技术研究院 深圳 518055)
2(重庆大学通信工程学院 重庆 400044)
1 引 言
耳声发射(Otocoustic Emissions)是耳蜗主动向外释放的一种微弱的声音能量[1-3]。这种振动的能量来源于健康内耳中的外毛细胞(Outer Hair Cells)。外毛细胞的活动能增强基底膜的机械振动并释放多余的能量,通过卵圆窗、听骨链及鼓膜传至外耳道[4]。这种在外耳道记录到的、源自内耳的声音称为耳声发射(Otoacoustic Emissions)。如果毛细胞遭到破坏,耳声发射信号就会减小甚至消失[3],因此耳声发射检测提供了一种直接了解内耳毛细胞活动和功能状况的窗口。同时,内耳不同位置的毛细胞发出不同频率的耳声发射信号,因而测量不同频率的耳声发射信号就可以了解不同位置的毛细胞的健康状况。耳声发射检测具有快速、简便、无创、灵敏的特点,只需要在外耳道放置集成了耳机和麦克风的探头,播放刺激声并记录人耳的反馈即可[1,2]。耳声发射检测对人体无任何损害,也不需要受试者的任何主观反应,因此它已经被广泛用于新生儿听力筛选和成人听力检测[2,3,5]。
畸变产物耳声发射 DPOAE 采用两个固定频率的纯音(f1, f2, f1< f2)刺激内耳毛细胞[6]。由于耳蜗的非线性特征,诱发的耳声发射信号频率为刺激声频率的组合mf1+nf2(m, n为整数)。对于人耳,频率为 2f1-f2的立方差异音(Cubic Different Tone, CDT)幅度最大,所以临床上的 DPOAE 检测大多测量立方差异音成分[7]。与其他类型的刺激声诱发的耳声发射信号相比,DPOAE 信号检测更加简单,只需要对外耳道记录到的反馈信号进行快速傅立叶变换(Fast Fourier Transform,FFT ),然后取出 2f1-f2处的频谱信息即可。DPOAE 信号的幅度和相位可以精确的反映内耳外毛细胞的非线性特征和耳蜗的健康状况[8,9],同时 DPOAE 具有很好的频率特性和较宽的频谱范围,因此 DPOAE 检测已经成为临床上的一项标准的测试项目。
然而,目前临床 DPOAE 检测方法受频率固定的纯音的限制,存在一定的不足。这些不足主要表现在:(1)采用频率固定的纯音诱发 DPOAE,一次只能完成对单一频率点的检测,整个听力区域检测耗时长,因此效率极低,且受试者因长时间测量感到疲劳,由此引入的人为噪声也会随之加大,长时间测量对于一些好动的儿童并不可行;(2)临床上 DPOAE检测只测量离散的频率点,且频率点相距较大(临床上一般测量 0.5, 1, 2, 3 ,4, 5, 6, 8 kHz 等标准频率),频率检测的分辨率不够,因而对于听力损失的频率定位不够精确,不能客观准确反映受试者的听力损失状况[10]。
针对以上不足,本文提出了一种利用扫频信号检测 DPOAE 耳声发射的方法。扫频信号的优势在于其频率可随时间连续变化,因此可在短时间内完成对多个频率的测量。扫频技术广泛应用于机械结构、自动控制系统、电子线路以及声学系统的动态特性测试[11]。利用扫频信号取代纯音信号进行 DPOAE 检测,可以使测量时间大大缩短,同时提高耳声发射结果的分辨率。本文将围绕扫频 DPOAE 耳声发射的生成、提取和应用展开具体介绍。
2 实验方法
2.1 受试者
本实验共招募受试者 15 人(6 男 9 女,年龄在23~31 岁之间)。在进行本实验前,每人都参加了标准的听力图测试。听力图测试结果显示,12 名受试者具有正常的听力功能,在每个标准测量频率点的听力阈值低于 20 dB HL(Hearing Loss),另外三名受试者由于存在长期的噪声暴露史,在高于 5 kHz 的频率处具有轻微的听力损失(5 kHz 以上的听力阈值高于20 dB HL)。本实验安排所有的受试者躺在一张舒服的床上,在相对安静的环境下进行耳声发射检测,每次实验时间持续时长约 15~20 分钟。整个实验过程符合中国科学院深圳先进技术研究院人体伦理道德规范(SIAT-IRB-130124-H0015)。
2.2 数据采集系统
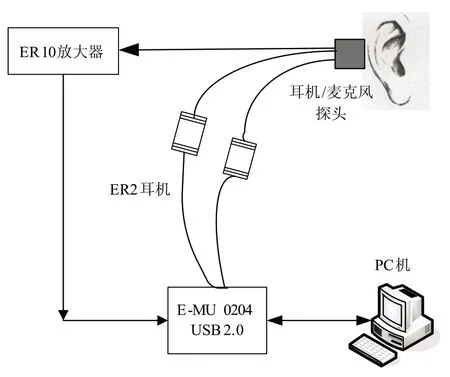
图1 实验数据采集系统
本实验数据采集系统如图1 所示。信号的发生与采集采用的是创新 E-MU 0204 USB 2.0 声卡,该声卡提供两个甲级前置放大器,支持全双工 24 bit/192 kHz的录制和回放,性噪比高达 113 dB。声卡输出的电平通过 ER-2 耳机(Etymotic Research, Inc.)发出设计的扫频刺激声、经放置在外耳道的耳机/麦克风探头播放。同时,麦克风将人耳的反馈信号转换成电平,通过耳声发射实验专用的放大器 ER-10、经 L-Line 输入口接回声卡完成数据采集功能。信号采样频率为 48 kHz,采集到的数据最后由 Matlab 软件进行离线分析。
2.3 实验步骤
本研究的扫频刺激声在频域产生,基本思路是首先构建期望的幅度谱和相位谱,其中幅度谱根据需求可以构建任意函数形式的幅度-频率曲线,相位谱根据扫频信号频率-时间曲线,利用群延迟积分得到,最后通过反傅里叶变换(iFFT)得到时域的扫频信号[12]。由于鼓膜的反射作用,声音在耳道的传播过程中会产生驻波现象,从而造成鼓膜处的声压幅度与设计的声压值存在较大的差异[13,14]。本文采用了声压反馈技术来避免这一问题。首先将幅度谱初始化,形成频率的常函数,合成并播放扫频信号。然后将外耳道记录到的声压频谱与期望频谱的差值作为反馈,调整扫频信号各频率分量的幅度,然后重新合成扫频信号。以上反馈调整过程不断循环,直至实际和期望响应的差值分贝数达到误差允许范围[15]。经过这一校准过程的扫频刺激声,进入耳朵时各频率成分的幅度相等,并等于期望的分贝数,保证了扫频 DPOAE 结果用于听力损失检测的可靠性。
扫频 DPOAE 检测采用两个具有一定频率比和幅度比关系的扫频信号(a 和 b)作为刺激声。其中信号 a的频率在 1 s 的时间内从 400 Hz 线性增加到 10 kHz,信号强度取校准后对应频率段的强度值。两个信号的强度频率比固定[7]( fb/fa=1.2,La-Lb=5 dB,其中 fa、fb分别为 a、b 的实时信号频率,La、Lb为信号a、b 的强度),两个扫频刺激声和其诱发得到的 CDT信号的时频关系如图2(a)所示。在实验过程中,两个扫频刺激声同时在耳朵同一侧播放,并用麦克风记录内耳的反馈信号。刺激声组合方式如图2(b)所示:信号 a 在第 1、3 段播放,信号 b 在第 2、3 段播放。
信号 a 的强度在 40~60 dB 之间以步长 5 dB 进行变化,一共可以测得 5 组不同刺激声幅度的数据。每组幅度下重复播放三段刺激声 20 次。即在同一次刺激实验中,固定刺激声频率范围(400 Hz~10 kHz)和频率强度比(fb/fa=1.2,La-Lb=5 dB),刺激声每段时长为 1 s,改变主次刺激声强度(La、Lb)进行扫频DPOAE 测试。为了验证非人耳能否产生扫频 DPOAE耳声发射信号,本文除了在 15 个受试者上进行测试以外,还在 1 段塑料试管中进行了非人耳的 DPOAE耳声发射测试。塑料试管的长度为 2.5 厘米,接近正常人的耳道长度。
2.4 数据分析
扫频 DPOAE 检测采集的数据包含了刺激声伪迹(fa,fb)、耳声发射信号(mfa+nfb)和背景噪声,进一步的听力损失分析需要从这种复杂的背景提取出纯净 CDT(2fa-fb)信号。数据分析流程如图3 所示,实验数据的预处理主要分为刺激声伪迹消除和环境噪声的初步消除。如图2(b)的“三段式”组合方式播放的刺激声,实验得到的数据也可以分成三段(用 m1,m2,m3分别表示第 1、2、3 段)。由于耳声发射信号具有非线性特性,而刺激声干扰呈线性特性,对实验记录信号做线性变化 p=m3-m2-m1可以初步消除刺激声的干扰。实验过程中,受试者基本在相对安静的环境下进行,但仍然无法避免实验过程中吞咽、身体挪动引入的脉冲噪声以及实验环境噪声。本文主要采用了高通滤波、阈值拒绝和相关平均来提高信噪比。将差值 p 通过一个 400 Hz 的高通滤波器,可以滤除低频环境噪声。上面实验步骤中提到,在每组刺激幅度下,共采集 20 次数据,脉冲噪声会造成信号时域上某一处的幅度值特别大,本文取出每次数据的最大值,根据数理统计学中的阈值拒绝准则,将最大值落在 95% 的置信区间(μ-2σ,μ+2σ)外的数据拒绝(μ,σ 为均值和标准差),剩下的数据相干平均。经过预处理的数据可以初步消除刺激声伪迹和环境噪声的影响,提高数据的信噪比。将预处理过后的数据通过一个动态跟踪滤波器[16],可以提取出纯净的 CDT信号,最后经过短时傅立叶变换,同时观察 CDT 信号不同时间段的频率和幅度特征。

图2 刺激声参数设定和组合方式图
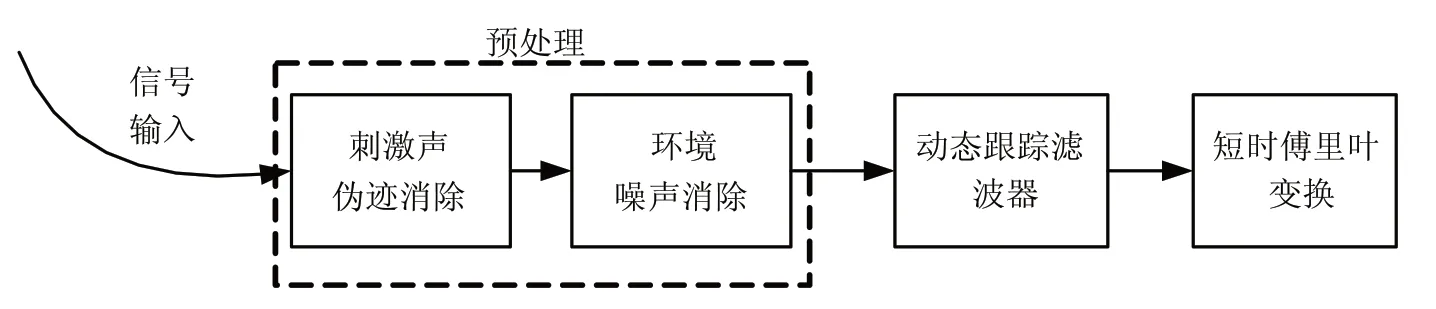
图3 数据分析流程图
3 实验结果
3.1 预处理消除噪声结果
本文提出的扫频 DPOAE 检测虽然在相对安静的环境下进行实验,但是仍然避免不了在采集数据中引入不同类型的噪声,环境低频噪声可以利用高通滤波器滤除,但是仍存在受试者实验过程中引入的脉冲噪声,如图4(a)所示,实验数据中有很明显的脉冲噪声,本文根据脉冲噪声时域幅度冲激特性,选用数理统计学的阈值拒绝准则,取出 20 组测量数据的最大值,构成一个数据集合,根据 95% 的置信区间,将数据集中落在(μ-2σ,μ+2σ)外的数据删除。如图4(b)中,红色圆形表示原始数据每组的最大值,两条黑色的虚线表示的是 95% 的置信区间,很明显可以看出,第 10 组的采集数据存在脉冲噪声干扰,实验数据应该被拒绝,蓝色‘+’表示被接受的数据组。图4(c)表示的是去除脉冲噪声干扰数据后的信号。很明显看出,利用数理统计学中的置信阈值拒绝准则可以很好地去除脉冲噪声的干扰。本文中简单的预处理机制可以大大减小实验过程中噪声的影响,并提高信号的信噪比与实验数据的可靠性。
3.2 扫频 DPOAE 检测结果

图4 预处理结果图
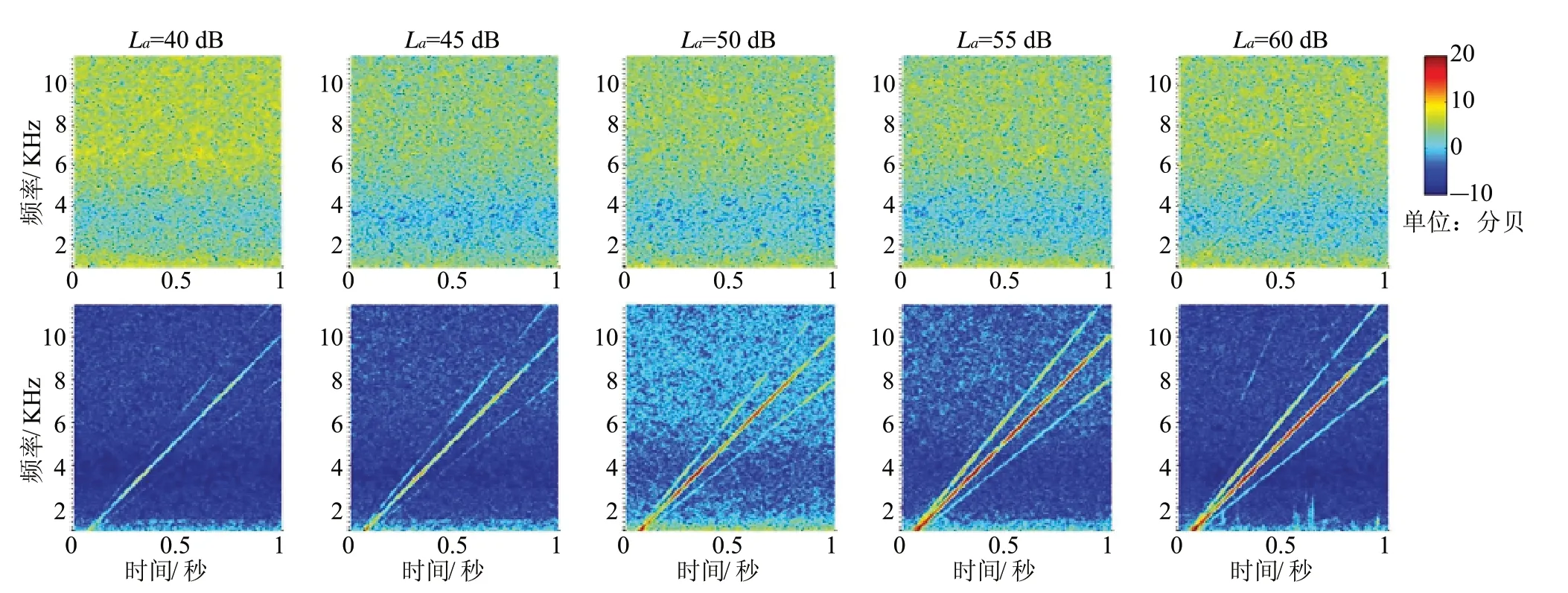
图5 五组刺激条件下的试管和人耳的扫频 DPOAE 检测结果对比。
本文一共测量了 15 名受试者在 5 组幅度刺激下的扫频 DPOAE,同时在相同的实验条件下,将耳机/麦克风探头放置在长度为 2.5 cm 的封闭试管内测量。图5 表示的是试管和一名典型受试者的检测数据经过预处理后的结果图,其中第一排数据为试管的检测结果。从图中明显可以看出,在刺激声强度较低的情况下(La<55 dB),经过“三段式”预处理后的数据基本上消除了刺激声伪迹,只剩下了环境噪声。随着刺激声强度的增加,在 La=55 dB 和 La=60 dB 的情况下,可以看到微弱的主刺激信号 a 没有被“三段式”的线性组合消除,即出现了轻微的信号畸变。这种情况主要是由于高强度的刺激声在长度很短的试管内反射产生驻波现象,加强或者抑制了刺激声某些频率点的幅度,同时,耳机/麦克风探头与试管口接触是否紧密都会对刺激声强度造成影响。图5 的第二排表示的是一名受试者在 5 组幅度刺激下的扫频 DPOAE 检测结果图。从图中由上至下可以看见三根直线,分别表示刺激声伪迹(fb,fa)和 CDT 信号(2fa-fb)。在强度较低的情况下(La=40 dB),CDT 信号强度较弱,而随着刺激声的幅度逐渐加大,诱发得到的 CDT 信号幅度也会随着刺激声幅度的增加而增加,在刺激声幅度较大的情况下(La=60 dB),能看到一条微弱的直线,即出现了其他的信号成分。这种现象只出现在刺激声幅度较大的情况,表明这些信号成分是高强度刺激声在耳道的传播中出现的轻微的尖峰失真,对比试管在 60 dB 下的结果图,这种失真并不会对CDT 信号产生影响。
图6(a) 是经预处理的信号频谱图,从图中可以清晰看出两条刺激声伪迹(fa,fb)和 CDT 信号(2fafb)。在 60 dB 刺激声幅度下,采集数据中会多出现一条信号成分fa+fb,与图5 受试者的结果相同。图6(b)是经过动态跟踪滤波器处理后的结果,从图中明显看出滤波器完整的保留了 CDT 信号成份,并最大程度抑制了其他干扰噪声。
3.3 听力正常与听力损失受试者检测结果

图6 一名典型受试者扫频 DPOAE 滤波前后结果对比(La=60 dB)

图7 听力正常与听力损失受试者扫频 DPOAE 结果对比(La=60 dB)
本文实验招募到 3 名具有轻微听力损失的受试者,图7 显示的是一名听力损失受试者和一名听力正常受试者的扫频 DPOAE 结果(La=60 dB),为了方便对比分析,其中图7(a) 与图6(b) 结果来源于同一名听力正常受试者。从图中可以看到,听力正常受试者在实验检测听力频域内(1 kHz~8 kHz)都能观察到很强幅度的 CDT 信号,说明这名受试者在频率1 kHz~8 kHz的范围内没有听力损失。图7(b)表示的是一名听力损失受试者的扫频 DPOAE 检测结果,在 1 kHz~5 kHz 处能清晰地观察到 CDT 信号,在频率高于 5 kHz 的时候,CDT 信号幅度减弱,在某些频率点上根本观察不到 CDT 信号。说明该受试者在5 kHz 以上具有一定程度的听力损失,与临床标准听力图检测结果一致。在另外四组刺激声幅度下具有相同的实验结果。
4 讨 论
4.1 扫频 DPOAE 检测的可靠性
本研究最重要的发现就是扫频刺激声能够成功诱发 DPOAE 信号。如图5 第二排所示,5 组刺激声强度都能诱发并记录到 CDT 信号,说明扫频 DPOAE可以在临床上用于听力损失检测。与其他类型的耳声发射信号检测方法相比,如 TEOAE 检测方法[17],DPOAE 信号具有更好的频谱特性,在很低的刺激声强度下仍然可以成功诱发 DPOAE 信号。将和成年人耳道长度接近的封闭试管(2.5 cm)接入数据采集系统,在同等的实验条件下,麦克风并没有记录到 CDT信号,说明图5 第二排信号是来源于受试者的内耳外毛细胞的正常活动,并不是数据采集系统产生的系统畸变。目前临床选用的 DPOAE 检测,依靠纯音诱发耳声发射信号,记录到的数据中刺激声伪迹幅度一般比 CDT 信号大 40 dB 左右,信噪比极低。本文提出“三段式”刺激声播放顺序,并据此对采集数据进行三段线性运算的预处理,记录到的刺激声伪迹基本上被消除或者减弱(图5 第一排)。而且根据数理统计中的阈值拒绝准则,数据自动调整阈值范围,与传统的手动设定阈值相比,数据处理方法机动性更强,经过预处理后的数据,信噪比显著提高(图4)。数据经过动态跟踪滤波器处理后,CDT 信号被完整保留,其他噪声都最大程度被抑制(图6),说明动态跟踪滤波器能从复杂的背景噪声出提取出纯净的 CDT 信号,并用于临床上进一步的听力损失研究。与目前的临床DPOAE 检测方法简单的处理机制相比,本文提出的扫频 DPOAE 检测结果更可靠。
4.2 扫频 DPOAE 检测的优越性
目前临床 DPOAE 依靠纯音诱发 CDT 信号,一次只能测量一个频率点的听力损失情况,需要极长的测试时间才能得到较好的频率分辨率。扫频 DPOAE检测利用频域随时间线性变化的扫频信号诱发 CDT信号,测试时长只需要 1~2 分钟,频率分辨率却可以精确到 1 Hz。表1 给出了两种检测方法的测试时长和频率分辨率[18]。如图7(b) 所示的听力损失受试者,纯音 DPOAE 检测只得出受试者在 5 kHz 以上有轻微的听力损失,而 5 kHz 以上只检测了 6 kHz 和 8 kHz 两个频率点的听力阈值,其他频率的听力损失情况并不清楚。扫频 DPOAE 检测结果显示,听力损失者在高强度刺激声的诱发下(La=60 dB),在 5 kHz 以下能观察到较明显的 CDT 信号,在 5 kHz 以上基本只能观察到断断续续微弱的 CDT 信号,如在 6 kHz、7 kHz 附近频率处还能观察到微弱的 CDT 信号,表明受试者在这两段范围的内的听力损失程度较轻,而完全观察不到 CDT 信号的频率处则具有明显的听力损失。说明扫频 DPOAE 检测方法的频率分辨率更高,听力损失程度和位置的定位更精确。图7(a) 的结果也同样可以表明这一结论。而且两名受试者的扫频 DPOAE 检测结果与目前临床听力图检测结果保持着高度一致,表明扫频 DPOAE 的检测结果是正确可靠的。扫频DPOAE 不仅可以高效率的诱发耳声发射信号、精确检测受试者整个听力范围的听力损失情况,还能准确定位听力损失对应的频率位置。相对于纯音 DPOAE检测,扫频 DPOAE 具有明显的优越性,临床应用前景更可观。

表1 纯音 DPOAE 和扫频 DPOAE 两种检测方法对比
5 结论与展望
本文研究利用频率随时间线性变化的扫频刺激声诱发畸变产物耳声发射信号,同时根据耳声发射信号的非线性优化刺激声播放的组合方式。通过本文的初步研究表明:“三段式”线性相减组合能消除刺激声伪迹、提高实验数据的信噪比;同时扫频 DPOAE 检测方法能大幅度缩短耳声发射信号的测量时间、提高检测结果的分辨率,并能灵敏反映受试者的听力损失的频率范围。本文的研究尚处于初步研究阶段,在未来的研究中还需要进行更多的听力损失受试者的实验。我们相信,在未来的临床应用方面,扫频 DPOA E检测方法可以作为一种听力损失检测、协助医生进行准确听力诊断和治疗的有效工具。
[1]Mountain D, Hubbard A. Rapid force production in the cochlea [J].Hearing Research, 1989, 42: 195-202.
[2]Kemp D T. Stimulated acoustic emissions from within the human auditory system [J]. The Journal of the Acoustical Society of America, 1978, 64(5): 1386-1391.
[3]Kemp D. Otoacoustic emissions, travelling waves and cochlear mechanisms [J]. Hearing Research, 1986, 22: 95-104.
[4]Probst R, Lonsbury M B L, Martin G K. A review of otoacoustic emissions [J]. Journal of the Acoustical Society of America, 1991, 89: 2027-2067.
[5]Whitehead M L, Lonsbury-Martin B L, Martin G K, et al.Otoacoustic emissions: animal models and clinical observations [J].Clinical Aspects of Hearing, Springer, 1996, 7: 199-257.
[6]Telischi F F, Widick M P, Lonsbury-Martin B L, et al.Monitoring cochlear function intraoperatively using distortion product otoacoustic emissions [J]. Otology & Neurotology,1995, 16:597-608.
[7]Johnson T A, Neely S T, Garner C A, et al. Inf luence of primarylevel and primary-frequency ratios on human distortion product otoacoustic emissions [J]. The Journal of the Acoustical Society of America, 2006, 119(1): 418-428.
[8]Bian L, Chertoff M E, Miller E. Deriving a cochlear transducer function from low-frequency modulation of distortion product otoacoustic emissions [J]. The Journal of the Acoustical Society of America, 2002, 112(1): 198-210.
[9]Bian L. Cochlear compression: effects of low-frequency biasing on quadratic distortion product otoacoustic emission [J]. The Journal of the Acoustical Society of America, 2004, 116(6):3559-3571.
[10]刘韵, 谢丽京, 刘永祥. 听力正常人畸变产物耳声发射的幅值分析 [J]. 听力学及言语疾病杂志, 2003, 11: 47-47.
[11]石晶, 侯国屏, 赵伟. 线性调频脉冲 (chirp) 信号扫频 [J]. 测控技术, 2003, 22: 11-13.
[12]Müller S, Massarani P. Transfer-function measurement with sweeps [J]. Journal of the Audio Engineering Society, 2001, 49:443-471.
[13]Stinson M R. The spatial distribution of sound pressure within scaled replicas of the human ear canal [J]. The Journal of the Acoustical Society of America, 1985, 78: 1596-1602.
[14]Siegel J, Hirohata E. Sound calibration and distortion product otoacoustic emissions at high frequencies [J]. Hearing Research,1994, 80: 146-152.
[15]Scheperle R A, Neely S T, Kopun J G, et al. Influence of in situ, sound-level calibration on distortion-product otoacoustic emission variability [J]. The Journal of the Acoustical Society of America, 2008, 124: 288-300.
[16]Chen S X. A new method of hearing loss screening using otoacoustic emissions evoked by swept tones [C]// 1st Annual IEEE Healthcare Innovation Conference of the IEEE EMBS Houston, Texas USA, 2012, 240-243.
[17]Martin G K, Probst R, Lonsbury M B L. Otoacoustic emissions in human ears: normative f indings [J]. Ear and Hearing, 1990,11: 106-120.
[18]Shaffer L A, Withnell R H, Dhar S, et al. Sources and mechanisms of DPOAE generation: implications for the prediction of auditory sensitivity [J]. Ear and Hearing, 2003, 24:367-379.
