帕金森病大鼠CD4+CD25highFoxP3+调节性T细胞的变化☆
2013-04-25沈楠赵永波黄东雅
沈楠赵永波黄东雅
·论 著·
帕金森病大鼠CD4+CD25highFoxP3+调节性T细胞的变化☆
沈楠*赵永波△黄东雅*
目的研究帕金森病(Parkinson’s disease,PD)大鼠外周血中调节性T细胞(regulatory T cells,Treg)的改变,并探讨其与脑内免疫炎症反应的相关性。方法SD大鼠随机分为对照组、假手术组、PD 4周组、PD 2周组。PD 4周组和2周组定向注射6-羟多巴建立PD大鼠模型,假手术组注射PBS缓冲液,PD 2周组于术后第2周,其他组于术后第4周时,应用免疫荧光染色法观察各组大鼠黑质处酪氨酸羟化酶(Tyrosine hydroxylase,TH)阳性神经元、离子钙接头蛋白分子-1(Ionized calcium bindingadaptor molecule-1,iba-1)和胶原纤维酸性蛋白(Glial fibrillary acid protein,GFAP)阳性细胞数量及形态的改变,并通过流式细胞术(Flow cytometry,FCM)检测其外周血中CD4+CD25highFoxP3+Treg占T淋巴细胞比例的变化。结果PD4周组TH阳性神经元偏侧毁损率(91.33%±8.53%)较对照组和假手术组增加(P<0.01),且较PD2周组(64.56%±17.94%)毁损更为严重(P<0.05)。PD4周组iba-1阳性细胞增加率(82.60%±11.52%)和GFAP阳性细胞增加率(86.62%±6.80%)较对照组及假手术组均增加(P<0.01),但PD 4周组较2周组iba-1阳性细胞增加率(104.89%±13.39%)和GFAP阳性细胞增加率(117.92%±15.34%)均减少(P<0.05)。FCM示PD4周组大鼠外周血中CD4+CD25highFoxP3+Treg占T淋巴细胞的比例(0.64%±0.08%)较对照组、假手术组及PD2周组均降低(P<0.01)。另外,外周血T淋巴细胞中Treg比例变化与TH阳性神经元毁损率(r=-0.59,P<0.01)、iba-1阳性细胞增加率(r=-0.87,P<0.01)和GFAP阳性细胞增加率(r=-0.89,P<0.01)均呈负相关。结论PD大鼠外周血中Treg比例减少且可能与脑内免疫炎症反应相关。
CD4+CD25highFoxP3+调节性T细胞 星形胶质细胞 小胶质细胞 帕金森病
帕金森病(Parkinson’s disease,PD)是最常见的神经系统退行性疾病之一,现已有研究证实免疫因素在其中发挥重要作用,如外周血中CD4+CD25+调节性T细胞(regulatory T cells,Treg)减少易引起PD或加重PD程度[1],但是目前尚无研究表明PD疾病本身是否反之也会影响外周免疫功能。故本研究拟通过检测不同病期PD大鼠外周血中Treg,观察中枢神经系统胶质细胞的激活情况,初步了解PD是否会引起Treg的改变,并研究这种变化与中枢神经系统免疫炎症反应间的相关性,以期为PD的早期诊断、早期治疗提供新的靶点。
1 材料与方法
1.1 动物分组与模型制备健康雄性SD大鼠,体质量250~270 g(同济大学实验动物中心提供),随机分为对照组、假手术组、PD 4周组、PD 2周组,每组8只。
10%水合氯醛麻醉PD 4周组和PD 2周组大鼠后,固定于大鼠脑立体定位仪上(美国ASI公司),参照Paxinos《The Rat Brain》图谱,选取右侧黑质致密部(坐标:前囟后5.3 mm,中缝旁开2.0 mm,硬膜下7.7 mm)和前脑内侧束(坐标:前囟后3.5 mm,中缝旁开2.0 mm,硬膜下8.6 mm)两点为注射位点,每点注射3μL浓度为2μg/μL的6-羟多巴(6-hydmxydopamine,6-OHDA,美国sigma公司),注射速度为1 μL/min,留针10 min后退针。PD 4周组和PD 2周组大鼠分别于术后第4周及第2周组进行后续实验。假手术组在同部位注射等体积的PBS缓冲液,并于术后第4周进行后续实验。对照组大鼠正常饲养,不注射任何试剂,与假手术组及PD 4周组同时进行后续实验。
1.2 行为学检测PD 4周组和PD 2周组大鼠分别于注射6-OHDA后第4周及第2周腹腔注射0.5 mg/kg阿扑吗啡(美国sigma公司)观察并记录30 min的旋转圈数;对照组及假手术组大鼠于相应处理后第4周注射等量阿扑吗啡并观察记录。
1.3 外周血CD4+CD25highFoxP3+Treg流式细胞术检测所有大鼠各采集外周血1.5 mL,肝素抗凝摇匀。全血样品应用密度梯度离心法分离出单个核细胞后分别加入抗大鼠FITC-CD4、PerCP eFluor 710-CD25抗体(美国eBioscience公司)各1.5 μL,经孵育、洗涤和破膜固定后再加入PE-FoxP3抗体(美国eBioscience公司)5 μL,孵育洗涤后上流式细胞仪(美国BD公司)检测。
1.4 TH与iba-1、TH与GFAP免疫荧光双标染色4%多聚甲醛灌注固定大鼠后断头取脑,将脑组织脱水后冰冻连续冠状切片(片厚40 μm)。通过免疫荧光染色法对脑片黑质部位进行酪氨酸羟化酶(tyrosine hydroxylase,TH)与离子钙接头蛋白分子-1(ionized calcium bindingadaptor molecule-1,iba-1)阳性细胞、TH与胶原纤维酸性蛋白(glial fi⁃brillary acid protein,GFAP)阳性细胞的双标染色,具体步骤如下:柠檬酸钠修复液抗原热修复5min,加入1:20000的鼠源性TH(美国sigma公司)和1:2000的兔源性iba-1(日本Wako公司)一抗,室温孵育60 min后4℃过夜;加入DAM488(美国invitrogen公司)和生物素标记的抗鼠源性的二抗(美国vector实验室),室温避光孵育3 h;加入Hoechst和Avi-cy3,室温避光孵育60 min;描片、晾干、封片后镜下观察。另取脑片行TH和GFAP双标染色,加入1:20000的鼠源性TH和1:1000的兔源性GFAP(丹麦Dako公司)一抗,余步骤同上。
1.5 结果判定每只大鼠的每个检测指标选用6张切片,在同一光强度下分别计数脑片两侧的TH、iba-1、GFAP阳性细胞数。偏侧TH阳性神经元的毁损率=(健侧TH阳性神经元数-毁损侧阳性神经元数)/健侧阳性细胞数×100%;偏侧iba-1、GFAP阳性细胞数的增加率=(毁损侧iba-1、GFAP阳性细胞数-健侧阳性细胞数)/健侧阳性细胞数×100%。
1.6 统计学方法采用SPSS17.0进行统计学分析。多组间外周血中CD4+CD25highFoxP3+Treg比例的比较直接采用方差分析。多组间TH阳性神经元偏侧毁损率、iba-1和GFAP阳性细胞增加率比较时发现各样本总体方差不齐,故将所有数据进行平方根转换,验证方差齐性后使用方差分析,进一步两两比较均应用LSD-t检验分析。Treg比例变化与TH阳性神经元毁损率及iba-1、GFAP阳性细胞增加率的相关性分析采用Pearson相关分析。检验水准α=0.05。
2 结果
2.1 行为学观察部分PD大鼠腹腔注射阿扑吗啡后可诱导出旋转行为,表现为向健侧旋转,呈首尾相接。对照组及假手术组注射阿扑吗啡后无旋转行为发生(见表1)。
2.2 大鼠黑质TH阳性神经元染色结果对照组及假手术组黑质两侧TH阳性神经元分布较多且密集,PD 4周组和PD 2周组毁损侧TH阳性神经元均明显减少(见图1、2)。四组大鼠TH阳性神经元偏侧毁损率有统计学差异(F=218.83,P<0.01)。其中,PD 4周组TH阳性神经元偏侧毁损率较对照组和假手术组均增加(P<0.01),且较PD 2周组毁损也更为严重(P<0.05)(见表2)。
2.3 大鼠黑质iba-1、GFAP阳性细胞染色结果对照组黑质两侧iba-1阳性细胞分布均匀而GFAP阳性细胞则较少,假手术组iba-1和GFAP阳性细胞都在针道附近聚集激活,其它部位分布尚均匀。PD4周组和PD2周组大鼠iba-1和GFAP阳性细胞则均在毁损侧黑质处聚集激活且数量增加,激活后的细胞染色加深,突起变短增粗(见图1、2)。四组大鼠iba-1阳性细胞增加率(F=159.40,P<0.01)和GFAP阳性细胞增加率(F=178.32,P<0.01)有统计学差异。其中,PD 4周组iba-1和GFAP阳性细胞增加率较对照组及假手术组均增加(P<0.01),但是PD 4周组较2周组这两种胶质细胞的增加率均减少(P<0.05)(见表2)。
2.4 大鼠外周血中CD4+CD25highFoxP3+Treg占T淋巴细胞比例四组大鼠外周血中CD4+CD25highFoxP3+Treg占T淋巴细胞的比例分别为对照组(1.27%±0.06%),假手术组(0.88%±0.04%),PD 4周组(0.64%±0.08%),PD 2周组(0.85%±
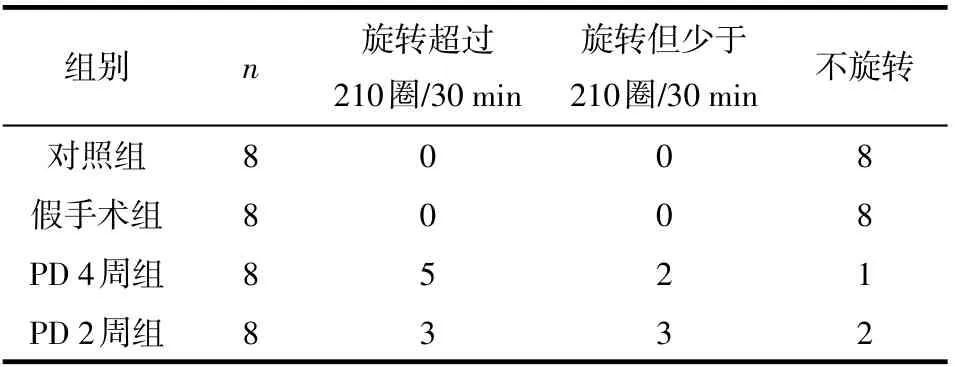
表1 大鼠阿扑吗啡诱导旋转运动的情况(只)

表2 各组TH、iba-1、GFAP阳性细胞变化率
0.12 %)。四组间差异有统计学意义(F=63.20,P<0.01)。其中,PD 4周组CD4+CD25highFoxP3+Treg占T淋巴细胞的比例比对照组、假手术组及PD 2周组均降低(P<0.01)。PD 2周组和假手术组CD4+CD25highFoxP3+Treg占T淋巴细胞的比例均比对照组低(P<0.01),PD 2周组与假手术组相比无统计学差异(P>0.05)(见图3)。
2.5 Treg比例变化与TH阳性神经元毁损率及iba-1、GFAP阳性细胞增加率的相关性外周血中Treg占T淋巴细胞比例的变化与TH阳性神经元毁损率(r=-0.59,P<0.01)、iba-1阳性细胞增加率(r=-0.87,P<0.01)和GFAP阳性细胞增加率(r=-0.89,P<0.01)均呈负相关。
3 讨论
Treg具有免疫调节、免疫抑制功能,在维持机体外周免疫耐受、预防自身免疫性疾病的发生发展中发挥重要作用[2],近期有研究表明Treg与神经系统疾病密切相关[3-5]。CD4+CD25highTreg是Treg的主要组成部分并能特异性地表达叉头样转录因子FoxP3[6]。本研究发现PD大鼠外周血中CD4+CD25highFoxP3+Treg占T淋巴细胞比例明显低于对照组及假手术组,且TH(多巴胺能神经元特异性标志物)阳性神经元损伤越严重Treg降低越明显。
小胶质细胞和星形胶质细胞均参与脑内的免疫炎症反应,既往有研究表明PD动物甚至患者脑内都存在小胶质细胞和星形胶质细胞增生和激活的情况[7-9]。本研究结果也证实了这一现象,并进一步发现多巴胺能神经元损伤时间及程度不同,胶质细胞激活情况也不同。多巴胺能神经元损伤早期较晚期,iba-1(小胶质细胞特异性标志物)阳性细胞和GFAP(星形胶质细胞特异性标志物)阳性细胞增生激活更为明显。

图1 黑质处TH阳性神经元和iba-1阳性细胞染色结果(4×)(iba-1/TH双标)(绿色箭头示TH阳性神经元减少区域,红色箭头示iba-1阳性细胞增加激活区域)。A:对照组;B:假手术组;C:PD2周组;D:PD4周组
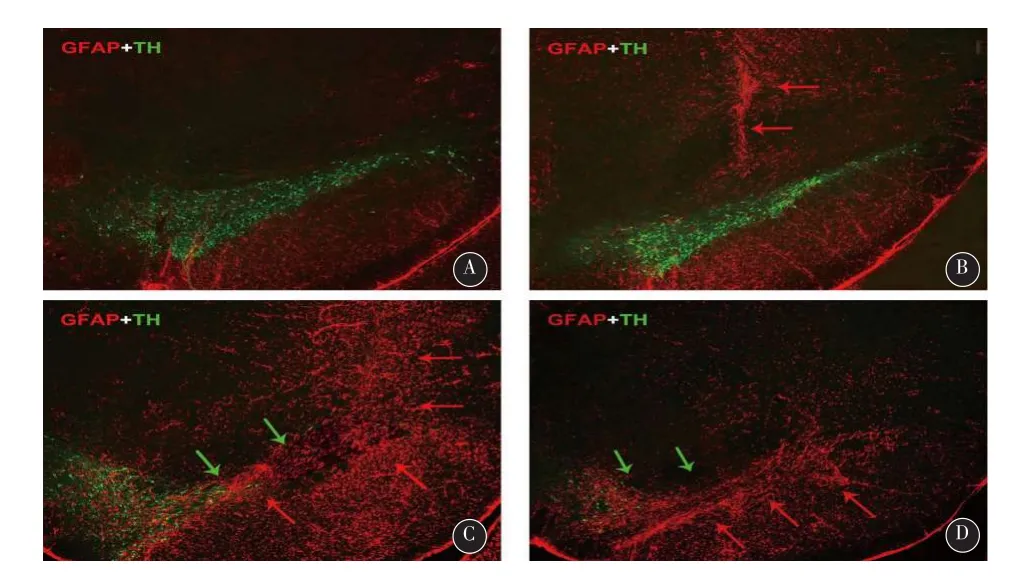
图2 黑质处TH阳性神经元和GFAP阳性细胞染色结果(4×)(GFAP/TH双标)(绿色箭头示TH阳性神经元减少区域,红色箭头示GFAP阳性细胞增加激活区域)。A:对照组;B:假手术组;C:PD2周组;D:PD4周组
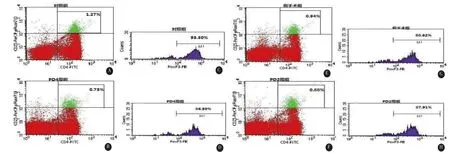
图3 CD4+CD25highFoxP3+Treg流式细胞检测图,A、B、E、F为CD4+CD25highTreg在外周血T淋巴细胞中所占比例,C、D、G、H为FoxP3在CD4+CD25highTreg中所占比例
Chi等[1]研究显示,基因敲除水通道蛋白-4 (Aquaporin-4,AQP4)可引起小鼠体内CD4+CD25+Treg的减少,这些小鼠腹腔注射能够引起PD的药物1-甲基-4-苯基-1、2、3、6-四氢吡啶(1-Meth⁃yl-4-Phenyl-1,2,3,6-etrahydropyridine,MPTP)后,黑质多巴胺能神经元的损伤程度较正常小鼠注射后更为严重,因而提出Treg可能是PD的保护性因素。由此,我们尝试研究PD疾病本身是否也能够引起Treg的改变,并进一步探索引起Treg改变的原因。
我们的研究发现,PD大鼠脑内胶质细胞增生激活的同时,外周血中CD4+CD25highFoxP3+Treg的比例在降低,且二者发生具有相关性。这提示PD发生发展过程中,CD4+CD25highFoxP3+Treg的比例的降低可能与脑内免疫炎症反应有关。我们猜测,PD大鼠多巴胺能神经元的损伤引起了小胶质细胞和星形胶质细胞的增生激活,增生激活后的胶质细胞会分泌IL-1、IL-6及TNF-α等多种炎症因子[10,11],这些炎症因子通过破损的血脑屏障入血干扰Treg的增殖和活性[12],从而引起Treg比例的降低。另外本研究发现,PD2周组大鼠胶质细胞增生激活较4周组显著,而PD4周组大鼠外周血中CD4+CD25highFoxP3+Treg比例降低则更为明显。我们推测,这是由于胶质细胞激活分泌的多种炎症因子入血后主要是干扰Treg的增殖,对现已存在的Treg比例影响不大,所以Treg的改变在PD病程中相对于胶质细胞表现有滞后性。
本研究也具有一定的局限性,我们只是观察了PD大鼠外周血中Treg数量的变化,并未涉及Treg功能状态的检测,所以我们将在进一步的研究中检测PD大鼠体内CD4+CD25highFoxP3+Treg的功能状态及血清和脑脊液中多种炎症因子的水平,并在体外实验中将胶质细胞激活后的培养液与CD4+CD25highFoxP3+Treg共培养,观察Treg的存活及增殖情况,这将有助于进一步阐明PD引起CD4+CD25highFoxP3+Treg比例减少的基本机制。
[1]Chi Y,Fan Y,He L,et al.Novel role of aduaporin-4 in CD4+ CD25+T regulatory cell development and severity of Parkinson’s disease[J].Aging Cell,2011,10(3):368-382.
[2]Maloy KJ,Salaun L,Cahill R,et al.CD4+CD25+T(R)cells sup⁃press innate immune pathology through cytokine-dependent mechanisms[J].J Exp Med,2003,197(1):111-119.
[3]Beers DR,Henkel JS,Zhao W,et al.Endogenous regulatory T lymphocytes ameliorate amyotrophic lateral sclerosis in mice and correlate with disease progression in patients with amyo⁃trophic lateral sclerosis[J].Brain,2011,134(5):1293-1314.
[4]Reynolds AD,Banerjee R,Liu J,et al.Neuroprotective activi⁃ties of CD4+CD25+regulatory T cells in an animal model of Parkinson's disease[J].J Leukoc Biol,2007,82(5):1083-1094. [5]Rosenkranz D,Weyer S,Tolosa E,et al.Higher frequency of regulatory T cells in the elderly and increased suppressive ac⁃tivity in neurodegeneration[J].J Neuroimmunol,2007,188(1-2):117-127.
[6]Hori S,Sakaguch S.Foxp3:a critical regulator of the develop⁃ment and function of regulatory T cells[J].Microbes Infect, 2004,6(8):745-751.
[7]Zhang W,Phillips K,Wielgus AR,et al.Neuromelanin acti⁃vates microglia and induces degeneration of dopaminergic neu⁃rons:implications for progression of Parkinson’s disease[J]. Neurotox Res,2011,19(1):63-72.
[8]Perry VH,Nicoll JAR,Holmes C.Microglia in neurodegenera⁃tive disease[J].Nat Rev Neurol,2010,4(6):193-201.
[9]Zhang ZJ,Xia CL,Dong YL,et al.Astrocyte reactivity in relat⁃ed brain regions in a mouse model of MPTP-induced Parkin⁃son’s disease[J].Neural Regen Res,2009,4(2):129-134.
[10]Long-Smith CM,Sullivan AM,Nolan YM.The influence of mi⁃croglia on the pathogenesis of Parkinson's disease[J].Prog Neu⁃robiol,2009,89(3):277-287.
[11]Watkins LR,Milligan ED,Maier SF.Glial activation:a driving force for pathological pain[J].Trends Neurosci,2001,24(8): 450-455.
[12]Pasare C,Medzhitov R.Toll pathway-dependent blockade of CD4+CD25+T cell-mediated suppression by dendritic cells[J]. Science,2003,299(5609):1033-1036.
The changes of CD4+CD25highFoxP3+regulatory T cells in peripheral blood of Parkinson's disease rats.
SHEN Nan,ZHAO Yongbo,HUANG Dongya.Department of Neurology,First People's Hospital Affiliated to Shanghai Jiaotong University,Shanghai 200080,China.Tel:021-63240090.
ObjectiveTo investigate the changes of regulatory T cells(Treg)in peripheral blood in the rat model of Parkinson’s disease(PD)and to study the correlation between the T cell changes and inflammation in the brain.Meth⁃odsSprague-Dawley rats were randomly divided into four groups:control group,sham-operated group,PD 4-week group and PD 2-week group.PD model was induced by 6-hydroxydopamine(6-OHDA).Immunofluorescence staining was used to detect the morphological and number of tyrosine hydroxylase(TH),ionized calcium bindingadaptor molecule-1(iba-1)and glial fibrillary acid protein(GFAP)positive cells in the substantia nigra.Flow cytometry(FCM)was used to examine CD4+CD25highFoxP3+Treg in the peripheral blood.ResultsThe relative neuronal loss of TH-positive cells in PD 4-week group was(91.33%±8.53%),which was significantly higher than that in control group and sham-operated group(P<0.01).The relative neuronal loss of TH-positive cells was more severe in PD 4-week group than that in PD 2-week group(64.56%±17.94%vs.91.33%±8.53%)(P<0.05).Meanwhile,in PD 4-week group,both iba-1-positive cells (82.60%±11.52%)and GFAP-positive cells(86.62%±6.80%)increased significantly,comparing with control group and sham-operated group(P<0.01).Interestingly,the increase in iba-1-positive cells(104.89%±13.39%)and GFAP-posi⁃tive cells(117.92%±15.34%)was more obvious in PD 2-week group than in PD 4-week group(P<0.05).Furthermore, FCM showed that the proportion of CD4+CD25highFoxP3+Treg in the peripheral blood in PD 4-week group was 0.64%± 0.08%,which was significantly lower than that in control group,sham-operated group and PD 2-weeks group(P<0.01). In addition,the changes of Treg in peripheral blood was negatively correlated with the neuronal loss of TH-positive cells (r=-0.59,P<0.01),and with the increase in iba-1 positive cells(r=-0.87,P<0.01)and GFAP positive cells(r=-0.89, P<0.01).Conclusions The present study have detected a decrease in Treg cell numbers in the peripheral blood in the rat model of PD,which may be related with the inflammation in the brain.
CD4+CD25highFoxP3+regulatory T cells Astrocyte Microglia Parkinson’s disease
R392
A
2012-12-12)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2013.08.008
☆ 上海市科委基础研究重点项目(编号:11JC1411402)
* 上海市同济大学附属东方医院神经内科(上海 200120)
△上海交通大学附属第一人民医院神经内科
