早期大剂量氨基酸对小早产儿生长发育和代谢的影响
2013-04-21周于新
刘 颖,张 珍,樊 娟,周于新
为满足小早产儿追赶生长发育的高营养素需求,近年来肠外营养(PN)方案不断更新和发展,现多主张早期使用大剂量氨基酸,国外报道多从>2.0 g·kg-1·d-1开始,国内相关文献报道较少。本研究为前瞻性研究,旨在探讨早期大剂量氨基酸(2.5 g·kg-1·d-1)对小早产儿生长发育和代谢的影响。
1 对象与方法
1.1 研究对象 选择2010年1月—2013年3月在我院分娩的小早产儿62例为研究对象。本研究经北京大学深圳医院伦理委员会批准,小早产儿家属均签署了知情同意书。入选标准:出生后24 h入住我院儿科,胎龄≤32周,出生体质量≤1 800 g,住院时间>14 d,出院时达足量经口喂养,生命体征稳定。排除标准:先天性消化道畸形,严重肝肾功能不全及遗传代谢性疾病患儿。采用随机数字表法将62例小早产儿分为观察组32例和对照组30例,两组小早产儿性别、胎龄、出生体质量、头围、身长及宫内发育迟缓(IUGR)、新生儿宫内感染、新生儿窒息、新生儿呼吸窘迫综合征(NRDS)、新生儿坏死性小肠结肠炎(NEC)发生率比较,差异均无统计学意义(P>0.05,见表1),具有可比性。
1.2 方法
1.2.1 氨基酸补充方案 观察组小早产儿在出生后2 h内补充小儿氨基酸(8.5%乐凡命,华瑞制药有限公司,生产批号H10980027),剂量从2.5 g·kg-1·d-1开始,第2天增加至3.5 g·kg-1·d-1,体质量<1 000 g的小早产儿第3天增加至4.0 g·kg-1·d-1;对照组小早产儿采用国内现行常用方案:出生后2 h内补充小儿氨基酸,剂量从1.0 g·kg-1·d-1开始,第2天起按1.0 g·kg-1·d-1递增,直至3.5 g·kg-1·d-1(最高剂量)。
1.2.2 静脉营养方案 两组小早产儿均在补充小儿氨基酸的基础上给予静脉营养,采用“全合一”静脉营养方案,静脉营养液经外周静脉穿刺中心静脉导管(PICC)输入,具体如下:出生后24 h内给予20%中长链脂肪乳剂0.5 g·kg-1·d-1,24 h后按0.5 g·kg-1·d-1递增,直至3.0 g·kg-1·d-1;根据小早产儿胃肠道耐受情况,于出生后24~72 h内通过奶瓶或管饲喂养早产儿配方乳,当早产儿配方乳喂养量达到75 ml·kg-1·d-1时20%中长链脂肪乳剂输入量减半,当早产儿配方乳喂养量超过100~120 ml·kg-1·d-1,即足量经口喂养时停止静脉营养。早产儿配方乳喂养方法及喂养量参照中国新生儿营养支持临床应用指南[1]。
1.2.3 观察指标 (1)生长发育指标:体质量下降幅度〔(出生体质量-出生后体质量最低值)/出生体质量〕、体质量增加速度〔(出生第14天体质量-出生体质量)/出生体质量/14〕、头围增加速度〔(出生第14天头围-出生头围)/出生头围/2〕、身长增加速度〔(出生第14天身长-出生身长)/出生身长/2〕、恢复出生体质量时间、达足量经口喂养时间、宫外发育迟缓(EUGR)发生率。(2)代谢指标:两组小早产儿均于出生时、出生第7、14天检测血清前清蛋白(Pre-ALB)水平;出生第14天抽取静脉血2 ml,离心半径r=16 cm,3 500 r/min离心5 min,分离血清并置于-20 ℃冰箱保存,检测血清肌酐(Cr)、尿素氮(BUN)、直接胆红素(DBiL)、总胆汁酸(TBA)、钙、磷、钾水平及剩余碱(BE)、二氧化碳结合力(CO2CP)。(3)并发症情况。

2 结果
2.1 生长发育指标 观察组小早产儿体质量下降幅度、EUGR发生率低于对照组,体质量增加速度、身长增加速度大于对照组,恢复出生体质量时间、达足量经口喂养时间短于对照组,差异均有统计学意义(P<0.05);两组小早产儿头围增加速度比较,差异无统计学意义(P>0.05,见表2)。
2.2 代谢指标 两组小早产儿出生时血清Pre-ALB水平比较,差异无统计学意义(P>0.05),观察组小早产儿出生第7、14天血清Pre-ALB水平高于对照组,差异均有统计学意义(P<0.05);两组小早产儿出生第14天血清Cr、BUN、DBiL、TBA、钙、磷、钾水平及BE、CO2CP比较,差异均无统计学意义(P>0.05,见表3)。
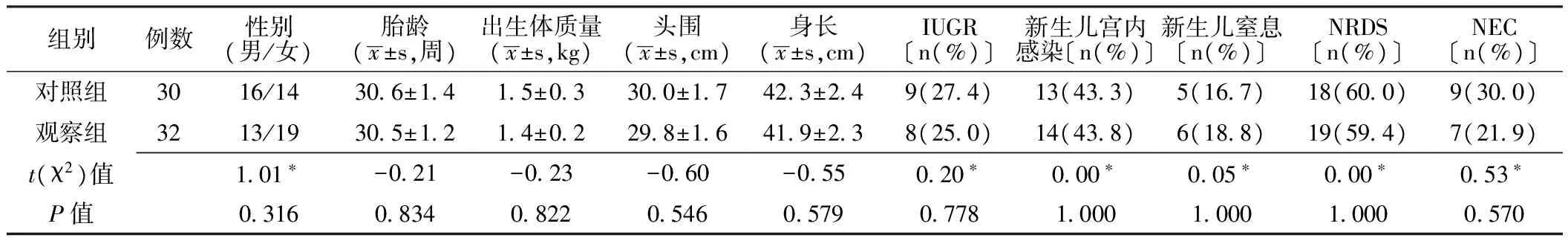
表1 两组小早产儿一般情况比较
注:*为χ2值;IUGR=宫内发育迟缓,NRDS=新生儿呼吸窘迫综合征,NEC=新生儿坏死性小肠结肠炎

表2 两组小早产儿生长发育指标比较
注:*为t值;△为u值;▲为χ2值;EUGR=宫外发育迟缓
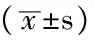
表3 两组小早产儿代谢指标比较
注:△为u值;Pre-ALB=前清蛋白,Cr=肌酐,BUN=尿素氮,DBiL=直接胆红素,TBA=总胆汁酸,BE=碱剩余,CO2CP=二氧化碳结合力
2.3 并发症情况 对照组和观察组中均有3例早产儿出现肠外营养相关性胆汁淤积症(PNAC),两组PNAC发生率(9.4%和10.0%)比较,差异无统计学意义(χ2=0.01,P=1.000);观察组中10例、对照组中17例早产儿出现败血症,观察组败血症发生率低于对照组(31.3%和56.7%),差异有统计学意义(χ2=4.07,P=0.039);观察组中2例、对照组中8例早产儿出现高钾血症,观察组高钾血症发生率低于对照组(6.3%和26.7%),差异有统计学意义(χ2=4.77,P=0.032)。
3 讨论
早产儿由于提前离开母体,胃肠功能及代谢系统尚未发育成熟而又要尽早承担“营养重任”以满足其快速生长的需求,较足月儿面临更大的生长发育挑战,因此,合理有效的肠外营养十分重要。英国营养学专家Lucas等[2]曾提出“营养程序化”的概念,即婴幼儿生长发育关键期或敏感期的营养状况将对机体或各器官功能产生长期乃至终生的影响。
由于担心小早产儿的代谢能力和耐受能力,以往的肠外营养支持方案比较保守,致使小早产儿EUGR发生率较高。一项包括696例早产儿的多中心研究结果显示,我国小早产儿出院时的体质量、身长、头围分别有60.0%、58.9%、29.5%低于标准的第10百分位,其中238例极低出生体质量儿若以体质量为评价指标,EUGR发生率达82.9%[3]。因此,为满足小早产儿的营养需求,近年多主张采用积极的肠外营养支持方案。本研究观察组小早产儿与对照组比较,体质量下降幅度更小,恢复出生体质量时间更短,体质量增加速度及身长增加速度更快,达足量经口喂养时间更短,EUGR发生率更低,说明早期使用大剂量氨基酸进行肠外营养有利于小早产儿的生长发育;但两组小早产儿头围增加速度无明显差异,考虑与婴儿头围增长速度相对缓慢、本研究观察时间较短有关。
te Braake等[4]在小早产儿出生后2 h内采用氨基酸起始剂量为2.4 g·kg-1·d-1的肠外营养支持方案,Ibrahim等[5]采氨基酸起始剂量为2.7 g·kg-1·d-1的肠外营养支持方案,均证实早期使用大剂量氨基酸进行肠外营养有利于改善小早产儿营养状况,提高其喂养耐受性,改善负氮平衡,且其血清必需氨基酸和大部分非必需氨基酸水平明显提高,与健康胎儿或母乳喂养的足月儿氨基酸参考值基本一致。本研究结果与以上研究所得结果相似。早期使用大剂量氨基酸进行肠外营养还有助于特殊蛋白质的合成,增加小早产儿血清谷氨酸水平及合成率,而谷氨酸为小早产儿主要的细胞内抗氧化因子[6]。因此,对于小早产儿来说,推荐的肠外营养支持方案是在出生后2 h内开始应用氨基酸,2.0~2.5 g·kg-1·d-1,1.0 g·kg-1·d-1递增,直至3.5 g·kg-1·d-1(极低出生体质量儿可增加至4.0 g·kg-1·d-1),且在肠内营养供给量未达到总能量的90%之前不能停止肠外营养[7]。
Pre-ALB是蛋白电泳时位于清蛋白之前的一种转运蛋白,由肝脏合成,是甲状腺素和视黄醇的结合蛋白,负责转运甲状腺素和维生素A,其t1/2较短,仅1.9 d。当机体蛋白质-热量缺乏时,血清Pre-ALB水平迅速下降;而当蛋白质-热量摄取增加时,其可在3 d内明显回升。因此,血清Pre-ALB水平能较准确、及时地反映小早产儿营养状况,可作为评价小早产儿营养状况的敏感指标[8-9]。本研究结果显示,观察组小早产儿出生第 7、14天血清Pre-ALB水平明显高于对照组,说明早期使用大剂量氨基酸进行肠外营养能有效避免小早产儿由于早期蛋白质补充不足而导致的负氮平衡,促进机体蛋白质合成。
部分早期肠外营养方案在早产儿出生后就给予相对高剂量的葡萄糖及脂肪乳,结果是早产儿营养液补充量超过其能量消耗量,导致早产儿身体脂肪含量过高,而肌肉组织生长发育较差;大剂量氨基酸及蛋白质则有助于促进早产儿肌肉和骨骼的生长发育[10-11]。Vlaardingerbroek等[12]通过总结文献得出结论,认为氨基酸不单用于蛋白质的合成,还可氧化供能,在机体能量供应充足的前提下,蛋白质是重要的生长促进因素,常以蛋白质-能量比例(P/E)判断蛋白质摄入情况。欧洲儿科胃肠肝病学和营养学会(ESPGHAN)指出,当早产儿蛋白质摄入量为3.0~4.5 g·kg-1·d-1时,其体质量增加速度与蛋白质摄入量成线性增长关系;当蛋白质摄入量<3.0 g·kg-1·d-1,但碳水化合物或脂肪摄入量很高时,早产儿仍能保持和宫内一样的体质量增加速度,但其身体脂肪组织比例较高[13]。略高于需求量的蛋白质摄入不会对早产儿产生不利影响,但轻微蛋白质摄入不足则会影响早产儿的生长发育。因此,对于出生体质量<1 000 g的早产儿,推荐蛋白质摄入量为4.0~4.5 g·kg-1·d-1或 3.6~4.1 g/100 kcal;对于出生体质量介于1 000~1 800 g的早产儿,推荐蛋白质的摄入量为3.5~4.0 g·kg-1·d-1或3.2~3.6 g/100 kcal。
值得注意的是,早期使用大剂量氨基酸进行肠外营养的安全性也应考虑。De Curtis等[14]研究认为,早产儿出生后应用大剂量氨基酸(>2.0 g·kg-1·d-1)进行肠外营养不仅安全有效,还可以降低高血糖发生率和发病程度,且未发现其与氨基酸超负荷引起的酸中毒、高氨血症、血清尿素氮水平升高等相关;小早产儿出生后尽早使用大剂量氨基酸(2.5~3.5 g·kg-1·d-1)是合理有效和值得推荐的。本研究结果显示,两组小早产儿出生第14天血清Cr、BUN、DBiL、TBA、钙、磷、钾水平及BE、CO2CP均无明显差异,表明早期使用大剂量氨基酸对机体代谢影响小,安全性较高,与文献报道基本一致。观察组有3例小早产儿出现PNAC,其中1例因伴有严重感染,TBA最高达98.4 μmol/L,DBiL达56.8 mmol/L而不得不在后期减少小儿氨基酸用量,但观察组PNAC发生率与对照组无明显差异。李卉等[15]研究表明,氨基酸的累积用量、感染是极低出生体质量儿发生PNAC的独立危险因素,但氨基酸的累积用量主要与肠外营养时间有关,而与氨基酸起始用量及浓度无关,强调要通过缩短肠外营养时间以积极防治感染,大部分PNAC可自愈。本研究结果还显示,观察组小早产儿败血症发生率明显低于对照组,考虑与其营养状况得到改善、经外周静脉穿刺PICC置管时间较短有关。因此,早期使用大剂量氨基酸进行肠外营养有利于改善小早产儿营养状况,提高其喂养耐受性,减少败血症发生率。
另外,小早产儿断脐后一些必需氨基酸水平开始下降,如同成人胰岛素分泌依靠血糖水平一样,小早产儿胰岛素分泌依靠必需氨基酸水平,小早产儿必需氨基酸缺乏可导致胰岛素及胰岛素样生长因子分泌减少,从而限制葡萄糖的转运和能量代谢,引起细胞内能量减少,导致Na+-K+-ATP酶活性下降,直接引发细胞内钾漏出细胞外,造成非少尿性高钾血症。早期使用大剂量氨基酸进行肠外营养可降低极低出生体质量儿电解质紊乱发生率,可明显减少早产儿早期非少尿性高钾血症,预防致命性高血钾的发生[16-17]。本研究结果显示,观察组小早产儿高钾血症发生率明显低于对照组,与以上研究结果一致。
综上所述,早期使用大剂量氨基酸进行胃肠外营养可改善小早产儿营养状况,促进其生长发育且耐受性良好,对机体代谢影响小。但本研究样本量较小,观察时间仅14 d,且小早产儿出生后的最初几天病情多不稳定,需限制液体量或应用其他药物,可能对本研究结果造成一定影响,早期大剂量氨基酸的应用效果仍有待于进一步研究验证。
1 中华医学会肠外肠内营养学分会儿科协作组,中华医学会儿科学分会新生儿学组,中华医学会小儿外科学分会新生儿学组,等.中国新生儿营养支持临床应用指南[J].中国实用儿科杂志,2006,21(9):715-718.
2 Lucas A,Fewtrell MS,Davies PS,et al.Breastfeeding and catch-up growth in infants born small for gestational age[J].Acta Paediatr,1997,86(6):564-569.
3 早产儿营养调查协作组.新生儿重症监护病房中早产儿营养相关状况多中心调查974例报告[J].中华儿科杂志,2009,47(1):12-17.
4 te Braake FW,van den Akker CH,Wattimena DJ,et al.Amino acid administration to premature infants directly after birth[J].J Pediatr,2005,147(4):457-461.
5 Ibrahim HM,Jeroudi MA,Baier RJ,et al.Aggressive early total parental nutrition in low-birth-weight infants[J].J Perinatol,2004,24(8):482-486.
6 Te Braake FW,Schierbeek H,de Groof K,et al.Glutathione synthesis rates after amino acid administration directly after birth in preterm infants[J].Am J Clin Nutr,2008,88(2):333-339.
7 Ziegler EE.Meeting the nutritional needs of the low-birth-weight infant[J].Ann Nutr Metab,2011,58(Suppl 1):8-18.
8 芦惠,薛辛东,张家骧,等.早产儿间断十二指肠喂养和鼻胃管喂养时血清前白蛋白的变化[J].中国当代儿科杂志,2003,5(6):519-522.
9 孙琦,诸宏伟,台晓燕.早期肠内外营养对早产儿生长发育的影响及意义[J].中国全科医学,2012,15(8):2773.
10 Uthaya S,Thomas EL,Hamilton G,et al.Altered adiposity after extremely preterm birth[J].Pediatr Res,2005,57(2):211-215.
11 Ziegler EE,Thureen PJ,Carlson SJ.Aggressive nutrition of the very low birthweight infant[J].Clin Perinatol,2002,29(2):225-244.
12 Vlaardingerbroek H,van Goudoever JB,van den Akker CH.Initial nutritional management of the preterm infant[J].Early Hum Dev,2009,85(11):691-695.
13 Agostoni C,Buonocore G,Carnielli VP,et al.Enteral nutrient supply for preterm infants:commentary from the European Society for Paediatric Gastroenterology,Hepatology and Nutrition Committee on Nutrition[J].J Pediatr Gastroenterol Nutr,2010,50(1):85-91.
14 De Curtis M,Rigo J.The nutrition of preterm infants[J].Early Hum Dev,2012,88(Suppl 1):S5-S7.
15 李卉,冯琪,王颖,等.极低出生体重儿肠道外营养相关性胆汁淤积的临床研究[J].新生儿科杂志,2005,20(2):57-61.
16 陈春,崔银珠,张谦慎.早期胃肠外营养方案对超低出生体重儿电解质的影响[J].中国新生儿科杂志,2012,27(6):394-397.
17 Blanco CL,Falck A,Green BK,et al.Metabolic responses to early and high protein supplementation in a randomized trial evaluating the prevention of hyperkalemia in extremely low birth weight infants[J].J Pediatr,2008,153(4):535-540.
