头孢曲松钠预处理对局灶性脑缺血大鼠缺血周围脑组织白介素1β和白介素6表达的影响
2013-04-21巴晓红闵连秋刘学文
刘 畅,巴晓红,闵连秋,刘学文
炎症机制是脑缺血再灌注损伤的重要机制。炎性细胞在脑缺血过程中的激活和炎性递质的释放在脑缺血损伤中占有重要的地位。因此,有效抑制炎性细胞激活及炎性递质释放,从而阻断炎性损伤是控制缺血性脑损伤的关键环节。本课题组前期研究表明,头孢曲松具有抑制脑缺血后大鼠脑组织核因子κB (NF-κB)表达的作用,从而起到了神经保护作用[1]。而NF-κB不但参与炎性反应,其激活更与白介素1(IL-1)、白介素6(IL-6)等炎性递质的表达密切相关。本研究通过制备大鼠局灶性脑缺血模型,研究头孢曲松钠对缺血周围脑组织白介素1β(IL-1β)和IL-6表达的影响,以进一步探讨其抑制脑缺血损伤的机制。
1 材料与方法
1.1 实验动物 选用健康雄性SD大鼠24只,体质量280~320 g(由辽宁医学院动物实验中心提供),许可证号:SCXK(辽)2003-1007。应用随机数字表法将大鼠随机分为假手术组、模型组、预处理组,每组8只。
1.2 方法
1.2.1 给药方法 预处理组大鼠每日腹腔注射头孢曲松钠(上海新先锋药业有限公司提供,规格1.0 g,批号080560)200 mg/kg,共5 d。假手术组和模型组大鼠分别给予等量的0.9%氯化钠注射液腹腔注射,给药方法及疗程同预处理组。
1.2.2 大脑中动脉闭塞(MCAO)动物模型制备 参照文献[2],各组大鼠MCAO术前12 h禁食,以防手术时误吸,不禁水。以10%水合氯醛3 ml/kg行腹腔麻醉,沿颈部正中行2~3 cm切口,分离右侧颈总动脉、颈外动脉、颈内动脉及翼腭动脉。结扎颈总动脉近心端及翼腭动脉,在颈总动脉分叉处结扎颈外动脉远心端。于颈内动脉近心端置动脉夹夹闭,距颈总动脉分叉处近心端0.5 cm处将颈总动脉剪一小口,插入备好的尼龙线栓,去除动脉夹,沿颈内动脉轻轻向前推进至大脑前动脉(深18 mm左右),结扎颈内动脉并固定线栓。假手术组大鼠术中不插入线栓,其余过程与上述相同。MCAO模型制备成功的判断标准为大鼠即刻出现同侧Horner征。
1.3 观察指标
1.3.1 神经功能评分 参考文献[3]的方法进行神经功能评分:(1)0分,无神经缺损症状;(2)1分,轻微神经缺损症状,不能完全伸展对侧前爪;(3)2分,中度局灶性神经缺损症状,爬行时向对侧转圈;(4)3分,重度局灶性神经缺损症状,行走时向对侧倾斜;(5)4分,不能自发行走,意识改变。于大鼠MCAO术后约2 h清醒至24 h内进行3次神经功能评分,取平均值。
1.3.2 大脑皮质IL-1β和IL-6阳性表达的细胞数 MCAO术后24 h,用水合氯醛腹腔注射麻醉大鼠后,于颈正中偏右切开,以4%多聚甲醛约50 ml局部灌流内固定后,断头取脑。乙醇脱水,石蜡包埋,制成约5 μm厚的连续切片。将其进行免疫组化SABC法染色:脱蜡水化;热修复;山羊血清封闭;滴加一抗(1∶100)、二抗;滴加试剂SABC;DAB显色;苏木素复染;脱水、透明及封片。于每张切片右侧顶叶皮质和海马CA1区各取5个高倍镜视野(10×40),阳性表达为细胞质内呈现棕黄色(IL-1β及IL-6均为细胞质染色),按照阳性细胞数/(阳性细胞数+阴性细胞数)×100%计算阳性表达率。IL-1β和IL-6试剂盒均购自武汉博士德生物工程有限公司。

2 结果
2.1 头孢曲松钠预处理对局灶性脑缺血大鼠神经功能评分的影响 MCAO术后,3组大鼠神经功能评分间差异有统计学意义(P<0.05);其中模型组、预处理组大鼠神经功能评分与假手术组比较,预处理组大鼠神经功能评分与模型组比较,差异均有统计学意义(P<0.01,见表1)。
2.2 头孢曲松钠预处理对大鼠脑缺血周围组织中IL-1β、IL-6表达的影响 光学显微镜下发现:假手术组大鼠脑缺血周围组织可见少量IL-1β阳性细胞;模型组大鼠IL-1β阳性细胞较则明显增加;而预处理组大鼠IL-1β阳性细胞较模型组则明显减少(见图1)。假手术组大鼠脑缺血周围组织可见少量IL-6阳性细胞;模型组大鼠IL-6阳性细胞增多,主要分布于缺血半暗带皮质和海马组织;而预处理组大鼠IL-6阳性细胞较模型组则明显减少(见图2)。
统计检验结果显示,3组大鼠脑缺血周围组织中IL-1β、IL-6阳性表达率间差异有统计学意义(P<0.05);其中模型组、预处理组大鼠IL-1β、IL-6阳性表达率与假手术组比较,预处理组大鼠IL-1β、IL-6阳性表达率与模型组比较,差异均有统计学意义(P<0.01,见表1)。
3 讨论
在脑缺血后数小时到数天都可以观察到显著的白细胞浸润,其数量与脑梗死容积直接相关[4]。脑缺血时,血流速度减慢使中性粒细胞更易黏附于血管内皮细胞,启动炎性反应[5],同时引起氧自由基等物质释放,加重组织水肿。研究表明,抑制中性粒细胞浸润可以降低缺血再灌注损伤和改善预后[6]。在大鼠脑缺血模型中,应用中性粒细胞抑制因子可发挥明显的神经保护作用,减少中性粒细胞浸润和脑梗死容积[7]。
有研究发现,在缺血再灌注损伤后,炎性递质大量表达,如IL-1β、IL-6、白介素8(IL-8)、白介素10(IL-10)、肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白等,这些炎性递质的表达与脑组织损伤预后密切相关[7-8]。白介素在脑缺血性损伤中扮演着重要的角色。其中IL-1β对组织损伤至关重要。IL-1β是 IL-1家族成员之一,能够诱导炎性反应,激活内皮细胞的活化,增加一氧化氮、谷氨酸和过氧化物的释放,介导脑组织的损伤[9]。IL-1β的 mRNA已经被证实在大脑皮质、纹状体、海马、丘脑等部位表达,并在大脑缺血后迅速激活并持续分泌,直到第7天[10]。相关实验进一步确认外源性 IL-1β可以引起缺血性脑损伤的恶化,而在对小鼠行MCAO后,缺乏IL-1β的小鼠与野生型小鼠比较,明显具有更小的脑梗死体积。在 MCAO术后急性期抑制IL-1β的表达,可以使脑梗死体积明显减少[11]。本研究结果显示,在 MCAO术后24 h,头孢曲松钠预处理的大鼠脑缺血周围组织中IL-1β的阳性表达率较MCAO模型大鼠明显下降,提示头孢曲松钠可以显著降低大鼠缺血脑组织中IL-1β的表达水平,抑制炎症的发生,可能是其神经元保护作用的重要机制之一。

Table1 Comparison of neurological scores and positive expression rate of IL-1β and IL-6 around ischemic tissue in the three groups
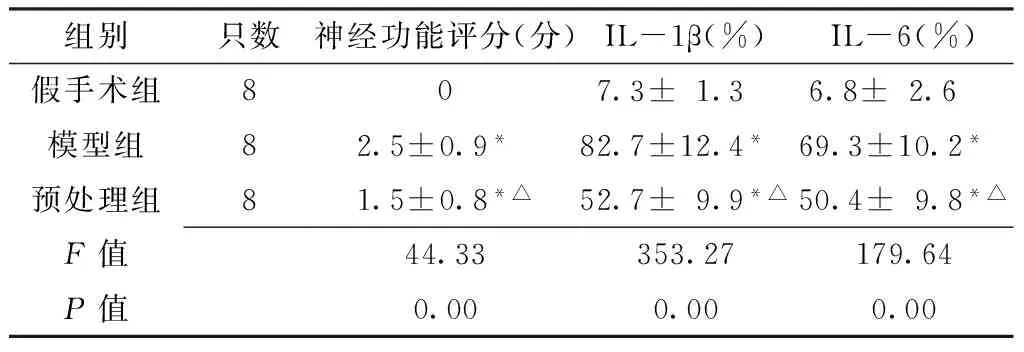
组别只数神经功能评分(分)IL-1β(%)IL-6(%)假手术组80 7.3±1.3 6.8±2.6 模型组82.5±0.9* 82.7±12.4* 69.3±10.2* 预处理组81.5±0.8*△52.7±9.9*△50.4±9.8*△F值44.33353.27179.64P值0.000.000.00
注:IL-1β=白介素1β,IL-6=白介素6;与假手术组比较,*P<0.01;与模型组比较,△P<0.01

图1 3组大鼠局灶性脑缺血周围组织中IL-1β的表达(SABC,×200)
Figure1 Expression of IL-1β around focal cerebral ischemia tissue in the three groups
图2 3组大鼠局灶性脑缺血周围组织中IL-6的表达(SABC,×400)
Figure2 Expression of IL-6 around focal cerebral ischemia tissue in the three groups
IL-6在脑缺血急性期是重要的炎性递质,可导致脑炎性损伤[12];且外周血中的IL-6水平是反映脑缺血损伤早期的敏感性指标。有研究显示,MCAO模型中IL-6在外周血2 h即开始上升,早于脑组织开始上升时间(24 h)[13]。已经有研究表明,缺血再灌注损伤发生后,脑内IL-6的水平上升,IL-6 mRNA在局灶性脑梗死后同样表达上调。IL-6 的快速表达在时间上与其他炎性递质相似,在缺血后6 h已经有明显上升,并考虑与脑梗死容积有一定相关性[14]。本研究结果显示,假手术组大鼠皮质仅有基础水平的IL-6表达,而MCAO模型大鼠IL-6阳性表达率则显著增加,提示IL-6参与了脑缺血损伤过程。与MCAO模型大鼠比较,头孢曲松钠预处理大鼠脑缺血周围组织中IL-6阳性表达率显著降低,提示头孢曲松钠可以抑制脑缺血后IL-6的表达。
总之,本研究结果提示IL-1β、IL-6均参与了缺血性脑损伤的病理生理过程,而头孢曲松钠具有抑制脑缺血后大鼠脑组织IL-1β、IL-6表达的作用,通过抑制损伤后炎性反应来发挥神经保护作用。
1 刘畅,贾玉洁,姜兴千,等.头孢曲松钠对局灶性脑缺血大鼠脑组织Fas和NF-κB表达的影响[J].中国老年学杂志,2012,32(19):4210-4212.
2 陈佳俊,石岩殊,韩雪梅,等.线拴法大鼠局灶性脑缺血模型(PMCAO)的实验研究[J].吉林医学,2004,25(10):16-17.
3 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
4 Buck BH,Liebeskind DS,Saver JL,et al.Early neutrophilia is associated with volume of ischemic tissue in acute stroke[J].Stroke,2008,39(2):355-360.
5 Barone FC,Feuerstein GZ.Inflammatory mediators and stroke:new opportunities for novel therapeutics[J].J Cereb Blood Flow Metab,1999,19(8):819-834.
6 Huang J,Upadhyay UM,Tamargo RJ.Inflammation in stroke and focal cerebral ischemia[J].Surg Neurol,2006,66(3):232-245.
7 Wang Q,Tang XN,Yenari MA.The inflammatory response in stroke[J].Neuroimmunol,2007,184(1/2):53-68.
8 牛智领,唐兴江,李玲玲,等.大鼠局灶性脑缺血再灌注后TNF-α、SOCS-3动态表达的实验研究[J].实用心脑肺血管病杂志,2011,19(1):3.
9 Caso JR,Moro MA,Lorenzo P,et al.Involvement of IL-1beta in acute stress-induced worsening of cerebral ischemia in rats[J].Eur Neuropsychopharmacol,2007,17(9):600-607.
10 Denes A,Thornton P,Rothwell NJ,et al.Inflammation and brain injury:acute cerebral ischemia,peripheral and central inflammation[J].Brain Behav Immun,2010,24(5):708-723.
11 Pinteaux E,Rothwell NJ,Boutin H.Neuroprotective actions of endogenous interleukin-1 receptor antagonist (IL-1ra) are mediated by glia[J].Glia,2006,53(5):551-556.
12 Suzuki S,Tanaka K,Suzuki N.Ambivalent aspects of interleukin-6 in cerebral ischemia:inflammatory versus neurotrophic aspects[J].Cereb Blood Flow Metab,2009,29(3):464-479.
13 Chapman KZ,Dale VQ,Denes A,et al.A rapid and transient peripheral inflammatory response precedes brain inflammation after experimental stroke[J].Cereb Blood Flow Metab,2009,29(11):1764-1768.
14 李辉萍,徐伟,宋治,等.重复经颅磁刺激对急性脑梗死患者血清白介素-6水平及神经功能康复的影响[J].中国全科医学,2010,13(11):3709.
