胃癌及癌前病变中幽门螺杆菌感染与分泌型卷曲相关蛋白基因启动子甲基化的关系研究
2013-04-21杜美林王小玲樊建平张立玮内田智久村上和成刘月平王士杰
杜美林,王小玲,樊建平,张立玮,内田智久,村上和成,王 续,刘月平,王士杰
胃癌是常见的恶性肿瘤之一,也是主要的表观遗传疾病,近年来学者对胃癌的表观遗传学关注度极高,表观遗传学包括基因甲基化、组蛋白修饰、微小RNA调控等[1]。其中基因甲基化备受关注,很多基因的甲基化与肿瘤发生有密切关系,是肿瘤发生的重要因素,并且关系着肿瘤的进展、治疗及预后。随着分子生物学技术的不断发展,进一步研究信号传导通路在胃癌发生发展中的作用,寻求抗肿瘤药物治疗的新靶点是肿瘤研究的新热点,其中研究最多的是Wnt通路,分泌型卷曲相关蛋白(secreted frizzled-related proteins,SFRPs)在此通路中发挥了重要作用。正常情况下,SFRPs竞争性抑制Fz受体,使Wnt通路的转录激活信号封闭,从而使调控下游基因表达的β-连环蛋白处于稳定状态;当SFRPs基因发生甲基化时,导致Wnt通路激活,细胞过度增殖,从而导致肿瘤发生[2]。大量研究已表明SFRPs的高甲基化可导致肿瘤发生,尤其在消化道肿瘤中高表达[3]。
此外,幽门螺杆菌(H.pylori)是已确认的胃癌Ⅰ类致癌原,这与H.pylori菌株不同、宿主基因易感性及环境因素有关。H.pylori本身不能导致肿瘤发生,但是其感染后的代谢产物及感染引起的炎性反应促使原癌基因相继被激活,抑癌基因丢失或功能失活,出现基因表达异常或功能发生改变,从而引起细胞增殖,导致肿瘤形成[4-5]。有研究显示,在胃癌及癌前病变中H.pylori感染可能与异常DNA甲基化相关[6]。故根除H.pylori是否能逆转基因甲基化?本研究探讨了H.pylori感染致SFRPs基因启动子甲基化的机制和相关性,以期为胃癌的治疗提供新疗法。
1 材料与方法
1.1 标本 随机抽取河北医科大学第四医院2012年10—11月内镜咬检不同胃黏膜病变标本72例,其中胃癌40例,异型增生17例,慢性胃炎15例;中位年龄为43岁;男女比例为3.8∶1。患者均未接受过任何治疗,除胃病以外无其他疾病,并有完整的临床病理资料及随访资料,且患者均为无亲缘关系的河北省汉族人。
1.2 方法 每例患者均在胃组织同一部位取2块标本,1块于-20 ℃保存用于提取全基因组DNA,另1块放入10%甲醛溶液中固定,留作病理组织学检查及免疫组化检测。
1.2.1 提取全基因组DNA 采用Ezup柱式动物基因组DNA抽提试剂盒提取标本的基因组DNA,选用亚硫酸氢钠(NaHSO3)、对苯二酚、氢氧化钠(NaOH)、蒸馏水的混合溶液进行DNA的修饰。然后采用Wizard®DNA Clean-Up System试剂盒,加入80%异丙醇2 ml、3 mol/L NaOH 2 ml、10 mol/L醋酸铵5 ml、pH 8.3 Tris-HCl缓冲盐溶液(TBS)、70%乙醇,按步骤进行DNA纯化。
1.2.2 甲基化特异性聚合酶链反应(MSP) 由于引物序列的特异性,会出现两种情况:一是甲基化特异引物(M)扩增出目的条带,而非甲基化特异引物(U)无条带扩出,这种情况为甲基化;二是U扩增出目的条带,而M无条带扩出,这种情况为非甲基化。本研究的引物均由上海生工生物工程技术公司合成,包含SFRPs的甲基化与非甲基化位点的基因片段。扩增片段长度分别为SFRP1:M 113 bp、U 112 bp;SFRP2:M 153 bp、U 163 bp;SFRP4:M 155 bp、U 163 bp;SFRP5:M 113 bp、U 119 bp。
MSP的反应体系为:10×MSP Buffer 2 μl、25 mmol/L氯化镁(MgCl2)1.2 μl、2 mmol/L dNTP 1 μl、50 μmol/L primer1 1 μl、50 μmol/L primer2 1 μl、5 U/μl Taq酶0.5 μl、NaHSO3修饰过的DNA 2.5 μl、H2O 2.3 μl,总体积为20 μl。MSP扩增之后的产物经过琼脂糖凝胶电泳,后于紫外凝胶成像系统观察、拍照并保存。以DNA Marker作为对照,观测长度为各自碱基数目的扩增片段。
如果在含有上游引物SFRP1的反应体系中出现113 bp扩增片段的标本,表明是SFRP1甲基化基因片段,112 bp是SFRP1非甲基化基因片段(见图1);在含上游引物SFRP2的反应体系中出现153 bp扩增片段的标本,表明是SFRP2甲基化基因片段,163 bp是SFRP2非甲基化基因片段(见图2);在含有上游引物SFRP4的反应体系中出现155 bp的扩增片段的标本,表明是SFRP4甲基化的基因片段,163 bp是SFRP4非甲基化基因片段(见图3);在含有上游引物SFRP5的反应体系出现113 bp的扩增片段的标本,表明是SFRP5的甲基化基因片段,119 bp是SFRP5非甲基化基因片段(见图4)。
1.2.3 免疫组化法(SP法)检测胃黏膜组织H.pylori的表达 内镜下取胃黏膜活检组织快速固定于10%甲醛溶液中,24 h后取出,然后在常温下梯度脱水、透明、浸蜡、包埋,蜡块常温保存。按照SP法的步骤将保存好的蜡块进行切片,并进行抗原修复,滴加二抗(快捷型酶标羊抗鼠/兔IgG聚合物),磷酸盐缓冲液(PBS)进行冲洗,室温孵育,最后滴加显色剂进行显色,镜下观察H.pylori的感染情况。

注:m为DNA Marker(500、400、300、200、150、100、75、50 bp),M为甲基化的SFRP1基因,U为非甲基化的SFRP1基因;1~2为胃癌组,3为异型增生组,4为慢性胃炎组
图1 SFRP1基因电泳图
Figure1 Electrophoresis of SFRP1 gene

注:m为DNA Marker(500、400、300、200、150、100、75、50 bp),M为甲基化的SFRP2基因,U为非甲基化的SFRP2基因;1~2为胃癌组,3为异型增生组,4为慢性胃炎组
图2 SFRP2基因电泳图
Figure2 Electrophoresis of SFRP2 gene

注:m为DNA Marker(500、400、300、200、150、100、75、50 bp),M为甲基化的SFRP4基因,U为非甲基化的SFRP4基因;1~2为胃癌组,3为异型增生组,4为慢性胃炎组
图3 SFRP4基因电泳图
Figure3 Electrophoresis of SFRP4 gene

注:m为DNA Marker(500、400、300、200、150、100、75、50 bp),M为甲基化的SFRP5基因,U为非甲基化的SFRP5基因;1~2为胃癌组,3为异型增生组,4为慢性胃炎组
图4 SFRP5基因电泳图
Figure4 Electrophoresis of SFRP5 gene
1.3 统计学方法 采用SPSS 13.3软件进行统计检验。计数资料比较采用χ2检验。H.pylori感染与SFRPs基因启动子甲基化之间的关系采用Spearman等级相关分析。检验水准α=0.05。
2 结果
2.1 不同胃黏膜病变组织SFRPs基因启动子甲基化状态 72例标本中,测得SFRP1、SFRP2、SFRP4、SFRP5基因启动子甲基化分别为34例(47.2%)、36例(50.0%)、27例(37.5%)和30例(41.7%)。不同胃黏膜病变组SFRP1、SFRP2、SFRP4、SFRP5基因启动子甲基化率比较,差异均有统计学意义(P<0.05);慢性胃炎组、异型增生组、胃癌组SFRP1、SFRP2、SFRP4、SFRP5基因启动子甲基化率依次增加,两两比较差异均有统计学意义(P<0.05,见表1)。
表1 不同胃黏膜病变组织中SFRPs基因启动子甲基化率比较〔n(%)〕
Table1 Comparison of methylation rate of SFRPs gene in the tissues of different gastric mucosal lesions

组别例数SFRP1SFRP2SFRP4SFRP5慢性胃炎组150000异型增生组17 5(29.4)* 6(35.3)* 2(11.8)* 4(23.5)* 胃癌组4029(72.5)*△30(75.0)*△25(62.5)*△26(65.0)*△χ2值28.42529.25826.20524.011P值 0.000 0.000 0.000 0.000
注:SFRP=分泌型卷曲相关蛋白;与慢性胃炎组比较,*P<0.05;与异型增生组比较,△P<0.05
2.2 不同胃黏膜病变组织H.pylori感染率比较 72例标本中,22例(30.6%)感染H.pylori;不同胃黏膜病变组织H.pylori感染率比较,差异有统计学意义(P<0.05);胃癌组、慢性胃炎组、异型增生组胃黏膜H.pylori感染率依次增加,两两比较差异均有统计学意义(P<0.05,见表2)。
表2 不同胃黏膜病变组织中H.pylori感染率比较〔n(%)〕
Table2 Comparison of H.pylori infection rate in different gastric mucosa lesions
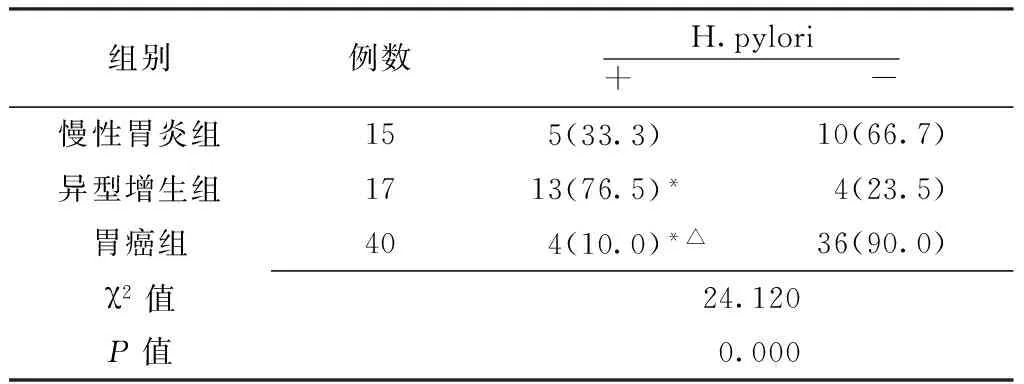
组别例数H.pylori+ -慢性胃炎组15 5(33.3) 10(66.7)异型增生组1713(76.5)* 4(23.5) 胃癌组40 4(10.0)*△ 36(90.0)χ2值24.120P值 0.000
注:与慢性胃炎组比较,*P<0.05;与异型增生组比较,△P<0.05
2.3 H.pylori感染与SFRPs基因启动子甲基化的相关性 Spearman等级相关分析结果显示,H.pylori感染与SFRPs基因启动子甲基化间无线性相关(rs=0.264,P<0.05)。
3 讨论
我国胃癌的特点是:(1)发病率高,我国每年新增胃癌病例约40万;(2)早期诊断率小于10%;(3)手术切除率低,总的胃癌手术切除率为50%~70%;(4)5年生存率低,我国胃癌根治术后5年生存率为32%~40%。近年来研究表明肿瘤的发生发展是基因组学和表观遗传学共同作用的结果。表观遗传是指DNA序列不发生变化,但基因表达却发生了可遗传的改变[7],表观遗传修饰包括DNA甲基化、组蛋白修饰、microRNA、染色质重塑等。DNA甲基化是主要的表观遗传学修饰方式,是指在DNA甲基转移酶的催化下,以S-腺苷甲硫氨酸为甲基供体,将甲基转移到胞嘧啶上[8]。哺乳动物基因组DNA甲基化主要位点是CpG岛,据统计,大于50%的基因启动子区含有CpG岛。启动子区的CpG岛通常处于非甲基化状态,使基因得以正常表达;当其发生甲基化时,会影响基因的转录调控,使基因表达发生沉默。
胃癌是一种表观遗传学疾病,DNA甲基化作为一种主要的表观遗传学修饰方式,在胃癌的发生发展中起到了重要作用。Wnt通路中的Wnt蛋白是一种分泌型糖蛋白家族,通过与细胞表面机制及特异性Fz受体结合激活下游信号传导途径,在细胞转运、生物发育、肿瘤形成、细胞凋亡等过程中发挥了重要的作用,其异常活化与肿瘤的发生、发展密切相关[9]。多种消化道肿瘤存在Wnt信号通路异常激活。在此通路中,最经典的是Wnt-β-catenin-TCF/LEF通路,其通路的拮抗剂有Dickkopf-1、SFRPs、Cerberus、Wnt抑制因子-1(WIF-1)[10]和内皮抑素(endostatin)[11]。其中,SFRPs作为Wnt信号通路的拮抗因子,常由于其启动子CpG岛的高甲基化致该基因表达沉默,而导致结肠癌、乳腺癌、黑色素瘤、肝癌、胃癌等恶性肿瘤发生[4]。
SFRPs是能与Wnt直接结合的分泌型糖蛋白家族系列,定位于8p12-11.1染色体,由SFRPs基因编码,其蛋白结构中含有半胱氨酸富含区域(cysteine-rich domain CRD),此区域与Fz受体有30%~50%序列相似,能竞争性抑制Fz受体或与Wnt配体直接结合,当其发生基因沉默时引起Wnt信号持续存在,使β-catenin不能被降解而在细胞质内大量积聚,从而转移至细胞核内与TCF/LEF转录因子发生作用,激活Wnt相关靶基因,导致细胞增殖而发生癌变。目前发现SFRPs家族的成员有SFRP1、SFRP2、SFRP3、SFRP4、SFRP5等[12]。本结果结果显示,72例胃黏膜病变者中,SFRP1、SFRP2、SFRP4、SFRP5基因启动子甲基化率分别为47.2%、50.0%、37.5%和41.7%;在异型增生组4者甲基化率分别为29.4%、35.3%、11.8%和23.5%,胃癌组分别为72.5%、75.0%、62.5%和65.0%;而在慢性胃炎组中未检测到SFRPs基因启动子甲基化;且胃癌组SFRPs基因启动子甲基化率显著高于慢性胃炎组。
H.pylori是已确认的胃癌Ⅰ类致癌原,其感染对于组织构成的损伤是促成因素。由于H.pylori的生长环境是碱性环境,当感染此菌时能破坏胃内本身正常的消化道黏膜的酸性环境,使正常的胃黏膜暴露于炎性细胞、损伤因子、各种致病菌的环境中,使胃黏膜发生病理改变,造成胃黏膜损伤,使胃内环境改变并导致一系列损伤反应,发生浅表性胃炎、萎缩性胃炎、胃黏膜上皮的肠上皮化生、异型增生等改变,以致上皮的恶性转化,导致腺癌的发生[13]。本研究结果显示,胃癌组、慢性胃炎组、异型增生组胃黏膜H.pylori感染率依次增加,且相关分析显示H.pylori感染与SFRPs基因启动子甲基化间无线性相关。H.pylori感染时启动了癌基因过表达,还是甲基化后的基因更容易使胃黏膜感染H.pylori,还需要进一步的实验研究探索。胃癌的分子病理基础也不单单是这两个方面就能决定的,它本身就是多基因、多信号通路及多种细胞因子共同作用的结果,但是H.pylori的感染与基因的甲基化并无直接关系[14]。
1 晏淼,刘小青,卞保祥,等.替吉奥胶囊联合紫杉醇治疗进展期胃癌的临床研究[J].中国全科医学,2012,15(3):990.
2 Verras M,Sun Z.Roles and regulation of Wnt signaling and beta-catenin in prostate cancer[J].Cancer Lett,2006,237(1):22-32.
3 戴结,刘畅,汪芳裕.SFRP基因甲基化与消化系肿瘤相关性的研究进展[J].世界华人消化杂志,2012,20(29):2812-2817.
4 郭宝文,杨琳.幽门螺杆菌cagE和virB11基因与胃癌的关系研究[J].中国全科医学,2012,15(4):1366.
5 叶婷,陈萦晅,房静远.幽门螺杆菌感染与DNA甲基化的相关性[J].中华内科杂志,2009,48(8):689-691.
6 Zou H,Molina JR,Harrington JJ,et al.Aberrant methylation of secreted frizzled related protein genes in esophagea adenocarcinoma and Barrett′ s esophagus[J].Int J Cancer,2005,116(4):584-591.
7 Jones PA,Baylin SB.The epigenomics of cancer[J].Cell,2007,128(4):683-692.
8 Bird A.DNA methylation patterns and epigenetic memory[J].Genes Dev,2002,16(1):6-21.
9 程翌,郑国荣.DNA甲基化在胃癌发生中的作用[J].实用预防医学,2011,18(6):1164-1166.
10 Marianna CP,Deborah JH,Am in R,et a l.Serum con cent rations of Dickkopf-1 protein are increased in patients with multiple myeloma and reduced after autologous stem cell transplantation[J].Int J Cancer,2006,119(7):1728-1731.
11 Etheridgea SL,Gary JS,Deborah JH,et al.Expression profiling and functional analysis of wnt signaling mechanisms in mesenchymal stem cells[J].Stem Cells,2004,22(5):849-860.
12 Ladher RK,Church VL,Allen S,et al.Cloning and expression of the Wnt antagonists Sfrp-2 and Frzb during chick development[J].Dev Biol,2000,218(2):183-198.
13 樊慧丽,陈玉梅.幽门螺杆菌感染及其相关疾病发病机制的研究进展[J].中国全科医学,2011,14(2):577.
14 Stoehr R,Wissmann C,Suzuki H,et al.Deletions of chromosome 8p and loss of sFRP1 expression are progression markers of papillary bladder cancer[J].Lab Invest,2004,84(4):465-478.
