非诺贝特对压力超负荷中期大鼠心肌能量代谢和心室重构的影响*
2013-04-19何燕邬江涛钟国强吴龙飞李醒三王炎陈卓宏闭奇
何燕,邬江涛,钟国强,吴龙飞,李醒三,王炎,陈卓宏,闭奇
·基础与实验研究·
非诺贝特对压力超负荷中期大鼠心肌能量代谢和心室重构的影响*
何燕,邬江涛,钟国强,吴龙飞,李醒三,王炎,陈卓宏,闭奇
目的:研究非诺贝特对压力超负荷中期大鼠心肌能量代谢和心室重构的影响。
非诺贝特;肥厚;重构;能量代谢;压力超负荷
(Chinese Circulation Journal, 2013,28:140.)
心脏压力超负荷可导致一系列复杂的级联信号瀑布激活,产生适应性应答以维持正常心脏输出。这种适应包括心肌细胞质量、基因表达和代谢的调整。在结构水平,表现为心脏肥大;在转录水平,表现为胚胎期基因再表达,而多种成人期基因表达下调[1];在代谢水平,表现为心肌能量底物由以脂肪酸β氧化为主转变为以葡萄糖酵解为主,这与过氧化物酶体增殖物 激 活 受体 α(peroxisome proliferator activated receptors α, PPARα)、 中 链 脂 酰 辅 酶 A 脱 氢 酶 (medium-chain acyl-CoA dehydrogenase, MCAD)、 肌型 肉碱棕榈 酰转移酶 -1(muscle carnitine palmitoyl transferase-1, MCPT-1) 活性降低密切相关[2,3]。研究发现 PPARα 激活剂在压力超负荷动物模型早期短暂应用即可减轻心肌肥厚[4],但另有研究发现后期长期应用反而加重心肌肥厚[5]。本研究将观察 PPARα激活剂非诺贝特对压力超负荷中期大鼠心肌重构的影响,有助于探索其在心肌肥厚不同病理生理阶段的作用机制。
1 材料和方法
实验动物:2010-07 至 2011-03,选择 8 周龄健康雄性 Wistar大鼠 42 只(广西医科大学动物实验中心提供),体重 200~250 g。
分组、建立大鼠压力超负荷模型及评价 : 8 周龄健康 Wistar大鼠,参照文献 [6]采用腹主动脉缩窄术建立压力超负荷模型后,随机分为2组:对照组(14只)和非诺贝特组(14只);另采用假手术(在腹主动脉相同部位穿线但不结扎)建立假手术组(14 只)。术后抗感染4天,观察4周后,各组分别取6只大鼠,麻醉固定后,经右颈总动脉插入心导管,连接生理信号采集处理仪,记录左心室收缩压、左心室舒张末压、左心室压力上升和下降最大速率,评价模型建立情况。
压力超负荷大鼠模型的干预 : 模型成功建立后,非诺贝特组予非诺贝特 150 mg/(kg·d)溶于 2 ml生理盐水后灌胃喂食;对照组、假手术组予等容积生理盐水灌胃喂食。干预8周。
留取血清和心肌组织标本 : 干预结束后,各组大鼠留取血清;开胸取出心脏,预冷生理盐水冲洗,滤纸吸干水份后称取左心室、右心室湿重,计算左心室湿重 /体重、右心室湿重 /体重,分别为左心室和右心室心肌质量指数。心底部心肌组织分装于4%甲醛液中固定,心尖部分于液氮中速冻后存于 -80℃超低温冰箱,待分子生物学实验。
心肌组织病理学形态 : 心肌组织按常规制作病理切片,做马松(Masson)染色,光镜观察细胞形态和胶原纤维分布,采用 HP IAS2000 计算机图像分析系统分析并计算胶原容积分数。
观察心肌超微结构及心肌线粒体损伤程度分级半定量分析 : 病理切片经醋酸双氧铀、枸橼酸铅双重染色,电镜观察心肌超微结构尤其是线粒体的变化,并照片分析,按照 Flameng 评分[7]进行损伤程度分级。
血清和心肌游离脂肪酸测定 : 按 Nixon 等[8]的方法,根据吸光率计算血清和心肌匀浆中游离脂肪酸的水平。
免疫印迹检测PPARα、MCAD、MCPT-1蛋白表达。
半定量逆转录聚合酶链反应(RT-PCR)检测PPARα、MCAD、MCPT-1 基因 表达 : 设 计并由 上海生 物 工程公 司合成 PPARα、MCAD、MCPT-1引 物,Trizol法 提 取 左 心 室 心 肌 组 织 总 核 糖 核 酸(RNA),取 2 μg RNA 进行逆转录反应合成脱氧核糖核酸(cDNA),进行 RT-PCR 后,取 PCR 产物 4 μl进行凝胶电泳并经成像系统分析,计算 PPARα、MCAD、MCPT-1 与甘油醛 -3- 磷酸脱氢酶 (GAPDH)信使核糖核酸 ( mRNA)的灰度比值。
统计学方法: 各组数据均采用 SPSS 13.0 统计软件分析,计量资料采用均数 ± 标准差(x±s)表示,多组间比较采用方差分析,进一步两两比较采用独立t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 实验大鼠一般情况
研究期间,假手术组死亡 2 只,对照组死亡 3 只,非诺贝特组死亡3只:死因多为感染、出血、呼吸衰竭和心力衰竭。最终,假手术组(12 只)、对照组(11 只)、非诺贝特组(11 只)到达研究终点。
2.2 压力超负荷大鼠模型建立的评价
腹主动脉缩窄术后4周测定血流动力学指标,对照组、非诺贝特组左心室收缩压、左心室舒张末压较假手术组增高(P<0.05),左心室压力上升和下降最大速率无明显变化(P>0.05);对照组与非诺贝特组间比较差异无统计学意义(P>0.05,表1)。初步判断压力超负荷中期大鼠模型成功建立。
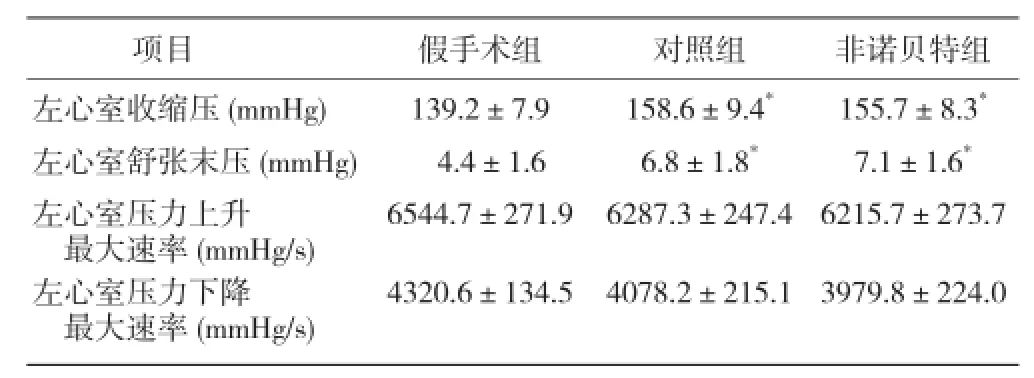
表1 3 组腹主动脉缩窄术后 4 周血流动力学指标(x±s, n=6)
2.3 3 组心肌重构指数的变化
对照组及非诺贝特组左心室质量指数较假手术组明显增高;非诺贝特组与对照组比增高程度低于对照组(P均 <0.05),差异均有统计学意义;3 组间右心室质量指数差异均无统计学意义(P>0.05,表2)。
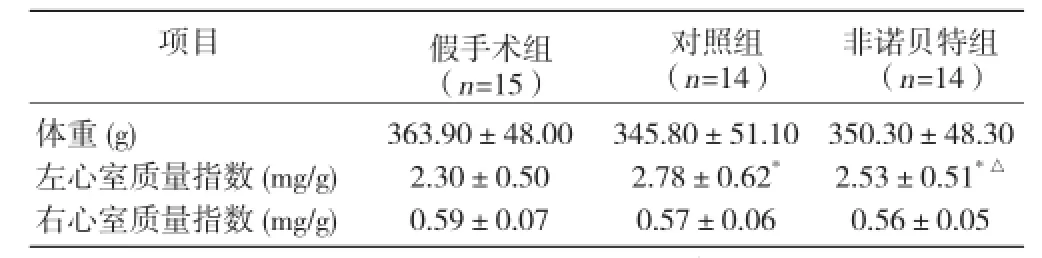
表2 3 组干预后心肌重构指数变化(x±s)
2.4 3 组心肌形态及胶原纤维分布
心肌组织马松染色显示,对照组、非诺贝特组心肌粗大、间质胶原纤维增生,进一步计算胶原容积 分 数, 对 照 组、 非 诺 贝 特 组 分 别 为 3.14±0.37、2.47±0.55,较假手术组 1.78±0.42 均增高(P<0.05),但非诺贝特组较对照组降低(P<0.05),差异均有统计学意义。图1

图1 大鼠心肌的组织病理学比较。 A: 假手术组心肌细胞正常,排列整齐,无间质胶原纤维增生;B: 对照组心肌稍显粗大,排列尚整齐,间质胶原纤维略显增生;C: 非诺贝特组心肌纤维接近正常,排列整齐,间质胶原纤维增生程度轻微。马松染色
2.5 3 组心肌超微结构及线粒体损伤程度分级半定量分析
电镜观察心肌超微结构,对照组、非诺贝特组心肌细胞及线粒体肿胀、破坏,非诺贝特组轻于对照组(图2);作线粒体损伤程度 Flameng 评分,对照组、非诺贝特组心肌线粒体损伤程度分别 为 1.7±0.5、1.0±0.4,均高 于假 手术 组 0.4±0.3(P<0.05),非诺贝特组则低于对照组(P<0.05),差异均有统计学意义。

图2 大鼠心肌的超微结构图。A: 假手术组心肌细胞无肿胀,胞膜完整,肌丝整齐,肌小节明、暗带清晰,线粒体整齐,膜完整,无肿胀,嵴突规则致密,线粒体间可见黑色糖原颗粒;B: 对照组心肌细胞肿胀,间有肌节溶解,伴肌膜破损,肌丝紊乱,线粒体明显肿胀,基质透明,嵴断裂或消失;C: 非诺贝特组心肌细胞轻度肿胀,肌丝基本整齐,肌节基本完整,线粒体轻度肿胀,基质基本完整,基质颗粒部分消失,嵴较规则,少部分断裂
2.6 3 组血清及心肌游离脂肪酸的变化
对 照 组 血 清 游 离 脂 肪 酸(440.7±77.3)μmol/L高 于 假 手 术 组(325.8±62.5)μmol/L 和 非 诺 贝 特组(256.6±48.8)μmol/L;对照组心肌游离脂肪酸(336.0±42.5)μmol/L 高 于 假 手 术 组(187.5±44.7)μmol/L 和 非 诺 贝 特 组(192.4±46.5)μmol/L(P 均<0.05),差异均有统计学意义。
2.7 3 组心肌 PPARα、MCAD、MCPT-1 蛋白表达的变化
对照组、非诺贝特组心肌PPARα、MCAD、MCPT-1蛋白表达较假手术组均明显下调;非诺贝特组较对照组均显著上调(P均 <0.05),差异均有统计学意义。图3
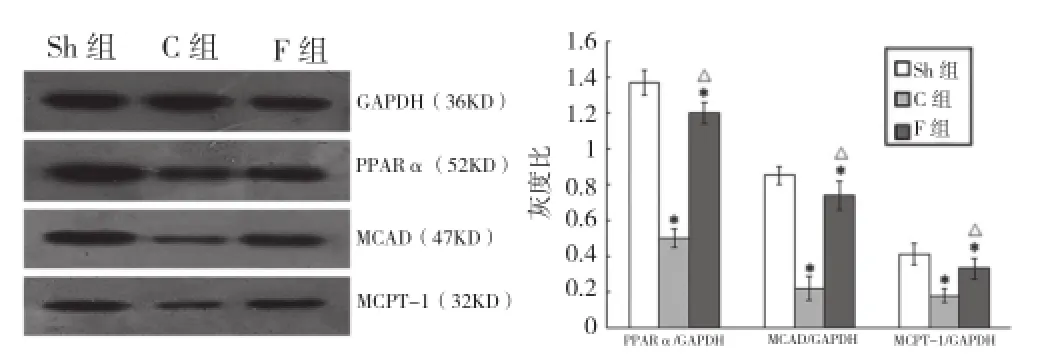
图3 蛋白质印迹法检测各组大鼠心肌 PPARα、MCPT-1、MCAD 蛋白表达。与假手术组比较*P<0.05;与对照组比较△P<0.05。GAPDH:甘油醛 -3-磷酸脱氢酶 PPARα:过氧化物酶体增殖物激活受体 α MCAD:中链脂酰辅酶 A 脱氢酶 MCPT-1:肌型肉碱棕榈酰转移酶 -1。Sh:假手术组;C:对照组;F:非诺贝特组
2.8 3 组 心 肌 PPARα、MCAD、MCPT-1 mRNA 基因表达的变化
对照组、非 诺 贝特组 心 肌 PPARα、MCAD、MCPT-1 mRNA 基因 表达 均较 假手术组明 显下 调(P<0.05);非诺贝特组均较对照组显著上调(P 均<0.05),差异均有统计学意义。图4
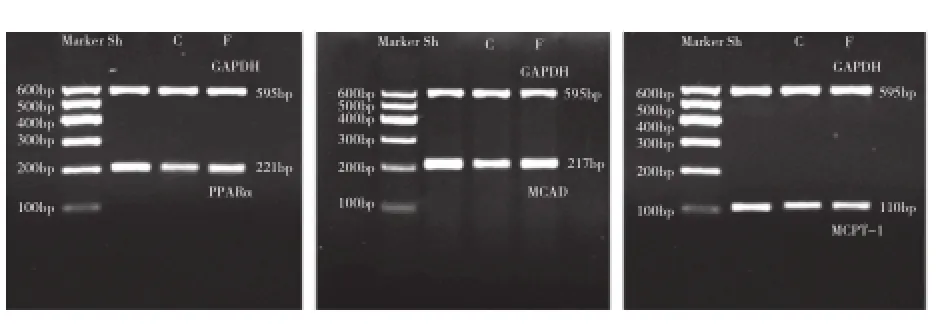
图4 逆转录聚合酶链反应检测各组大鼠心肌 PPARα、MCAD、MCPT-1 mRNA表达。余注见图3
3 讨论
压力超负荷下,心肌在结构水平、代谢水平、基因表达水平均产生适应性调节,以维持正常的心脏功能[9-11]。腹主动脉缩窄诱导的压力超负荷大鼠,心肌肥厚多始于术后 4 周[12],而心肌代谢模式转换则始于术后 8 周[5]。基于现有的研究,PPARα 激活剂在压力超负荷早期(2~4 周)短暂干预减轻心肌肥厚,后期(8~12 周 )长期干预可能加重心肌肥厚[5,12]。本研究 旨在观察 PPARα 激活剂非 诺贝特在压力超负荷中期对大鼠心肌肥厚的影响。选择术后4周开始干预,持续到术后12周,覆盖心肌重构和代谢重构发生发展的关键时期,预期研究结果相对具有代表性。本研究发现,术后4周,模型组血流动力学指标明显变化,提示进入压力超负荷中期;术后 12周,压力后负荷的增加,左心室心肌为了维持正常的心脏输出,发生了心肌肥厚;马松染色证实,心肌正经历由代偿性肥厚向失代偿性肥大和纤维化演变的进程。采用 PPARα 激活剂非诺贝特干预,可延缓压力超负荷中期大鼠心肌肥厚的演变进程。
压力超负荷下心肌代谢已经发生“能量缺乏”, 而心肌结构则逐渐出现“失调”,表现为心肌脂肪酸代谢水平和相关基因表达已下调,出现心肌肥厚和轻度纤维化,但光镜下心肌结构完整,排列整齐[13]。为了避免持续的代谢“能量缺乏”进一步导致结构“失调”,提高心肌能量代谢水平尤为重要。本研究证实,模型组血清和心肌游离脂肪酸增高,可能是心肌脂肪酸β氧化转变为以葡萄糖酵解为主的代谢模式,脂肪酸摄取减少,氧化能力减弱,导致脂肪酸蓄积,并产生自由基损伤线粒体、呼吸链和亚细胞器膜结构相关酶的功能,抑制线粒体、肌浆网和胞质酶体系中 Ca2+- 三磷酸腺苷(ATP)酶和 Na+-K+-ATP 酶等的活性[14,15],最终将抑制糖酵解模式的效率,导致心肌细胞和线粒体损伤逐渐加重,心肌能量进一步匮乏。
近年研究发现,PPARα可调控其下游编码基因MCAD、MCPT-1。MCPT-1 是脂肪酸转运到线粒体的关键酶,MCAD则是线粒体脂肪酸氧化第一步的关键酶。PPARα 激活剂可通过上调 PPARα 及其所调控的MCAD、MCPT-1基因表达,增强脂肪酸氧化,提高心肌能量代谢水平[16,17]。本研究中,心肌 PPARα、MCAD、MCPT-1蛋白和基因的表达在对照组均下调,在非诺贝特组则上调,提示非诺贝特可能通过上调脂肪酸氧化相关酶表达,改善代谢水平来减轻心肌肥厚。但另有研究表明长期激活可使脂肪酸过度氧化,增加心肌耗氧量,降低氧化效率,加剧心肌能量匮乏,加重心室重构。提示在机体能量代谢演变的不同阶段,脂肪酸氧化与葡萄糖酵解模式之间的动态转换,可能存在复杂的调控机制。总之,在压力超负荷中期,PPARα 激活剂非诺贝特能够改善心肌能量代谢,延缓心室重构,其机制可能与上调心肌 PPARα、MCAD、MCPT-1 蛋白和基因的表达增加脂肪酸氧化有关。
[1]Melenovsky V, Benes J, Skaroupkova P, et al. Metabolic characterization of volume overload heart failure due to aorto-caval fistula in rats. Mol Cell Biochem, 2011,354:83-96.
[2]Schwarzer M, Faerber G, Rueckauer T, et al. The metabolic modulators, Etomoxirand NVP-LAB121, fail to reverse pressure overload induced heart failure in vivo. Basic Res Cardiol, 2009,104:547-557.
[3]Rimbaud S, Ruiz M, Piquereau J, et al. Resveratrol improves survival, hemodynamics and energetics in a rat model of hypertension leading to heart failure. PLoS One, 2011,6:26391.
[4]Rose M, Balakumar P, Singh M. Ameliorative effect of combinationof fenofibrate and rosiglitazone in pressure overload-induced cardiac hypertrophy in rats. Pharmacology, 2007,80:177-184.
[5]Purushothaman S, Sathik MM, Nair RR. Reactivation of peroxisome proliferator-activated receptor alpha in spontaneously hypertensive rat: age-associated paradoxical effect on the heart. J Cardiovasc Pharmacol, 2011,58:254-262.
[6]罗 羽 慧 ,李 法 琦 ,梅 霞 ,等 .福 辛 普 利 对 实 验 性 心 力 衰 竭 大 鼠心肌细胞凋亡和 Fas、Fas 配体基因表达的影响 .中国循环杂志 ,2004,19:66-70.
[7]Flameng W, Borgers M, Daenen W, et al. Ultrastructural and cytochemical correlates of myocardial protection by cardiac hypothermia in man. J Thorac Cardiovasc Surg, 1980,79:413-424.
[8]Nixon M, Chan SH. A simple and sensitive colorimetric method for the determinationof long-chain free fatty acids in subcellular organelles. Anal Biochem, 1979,97:403-409.
[9]Lionetti V, Stanley WC, Recchia FA. Modulating fatty acid oxidation in heart failure. Cardiovasc Res, 2011,90:202-209.
[10]Chaanine AH, Hajjar RJ. AKT signalling in the failing heart. Eur J Heart Fail, 2011,13:825-829.
[11]Lombardi R, Betocchi S. Aetiology and pathogenesis of hypertrophic cardiomyopathy. Acta Paediatr Suppl, 2002,91:10-14.
[12]Schultz Jel J, Glascock BJ, Witt SA, et al. Accelerated onset of heart failure in mice during pressure overload with chronically decreased SERCA2 calcium pump activity. Am J Physiol Heart Circ Physiol, 2004,286:1146-1153.
[13]韩瑜 ,韩变 梅 ,柳 明沫 ,等 . 心 肌胶 原及 代 谢 . 中 国循 环杂 志 , 2006,21:315-317.
[14]Purushothaman S, Renuka Nair R, Harikrishnan VS, et al. Temporal relation of cardiachypertrophy, oxidative stress, and fatty acidmetabolism in spontaneously hypertensive rat. Mol Cell Biochem, 2011,351:59-64.
[15]Jaswal JS, Keung W, Wang W, et al. Targeting fatty acid and carbohydrate oxidation--anovel therapeutic intervention in the ischemic and failing heart. Biochim Biophys Acta, 2011,1813:1333-1350.
[16]Balakumar P, Rose M, Singh M. Effect of fenofibrate in pressure overload-induced experimental cardiac hypertrophy. International Journal of Biological Chemistry, 2007,1:104-110.
[17]Lebrasseur NK, Duhaney TA, De Silva DS, et al. Effects of fenofibrate on cardiac remodeling in aldosterone-induced hypertension. Hypertension, 2007,50:489-496.
Effect of Fenofibrate on Myocardial Energy Metabolism and Ventricular Remodeling in Metaphase Pressure Overloaded Rats
HE Yan, WU Jiang-tao, ZHONG Guo-qiang, WU Long-fei, LI Xing-san, WANG Yan, CHEN Zhuo-hong, Bi Qi.
Department of Cardiology, The First Affiliated Hospital of Guangxi Medical University,
Nanning (530021), Guangxi, China
Objective: To investigate the effect of fenofibrate on myocardial energy metabolism and ventricular remodeling in metaphase pressure overloaded rats.Methods: The metaphase pressure overloaded animal model was established by aortic constriction in wistar rats and then randomly divided them into 3 groups, Control group and Sham operation (Sham) groupand the rats received normal saline in both groups, and Medication group, the rats received fenofibrate 150mg/(kg·d). n=14 in each group, all animals were treated for 8 weeks. The rats’ myocardial structure was observed by light microscope and the collagen volume fraction was calculated. The mitochondrial structure was studied by electron microscope and the Flameng score for myocardial mitochondrial injury was calculated. Serum and myocardial free fatty acid levels were examined, PPARα, MCAD and MCPT-1 gene and protein expressions were assessed by RT-PCR and western blot analysis respectively.Result: ① Compared with Sham group, both Control and Medication groups presented increased left ventricular weight index and collagen volume fraction; Medication group was much lower than that in Control group, P<0.05. ② Compared with Sham group, both Control and Medication groups showed increased Flameng score; Medication group was lower than that in Control group, P<0.05. ③ The serum and cardiac free fatty acid level in Medication group was lower than Control group, P<0.05. ④ The expression of PPARα, MCPT-1 and MCAD in both Control and Medication groups were down-regulated than that in Sham group; they were up-regulated in Medication group than that in Control group, P<0.05.Conclusion: Fenofibrate could increase fatty acid oxidation through up-regulating the expression of PPARα, MCPT-1 and MCAD, and therefore, reducing the serum and cardiac free fatty acid levels, extenuate mitochondrial injury, those are helpful to protect the cardiac function in metaphase of pressure overload rats.
Fenofibrate; Hypertrophy; Remodeling; Energy metabolism; Pressure overload
HE Yan, E-mail:hyxjwxy@126.com
2012-05-19)
(编辑:漆利萍)
*
广西壮族自治区科技厅青年基金项目资助(桂科青 0728064),本研究受“广西大型仪器协作共用网资助 ” 项目编号:635-2008-048
530021 广西壮族自治区南宁市,广西医科大学第一附属医院 老年心内科
何燕 主任医师 博士 主要研究方向为慢性心力衰竭机制及临床 Email:hyxjwxy@126.com 通讯作者:何燕
R541
A
1000-3614(2013)02-0140-04
10.3969/j.issn.1000-3614.2013.02.018
方法 :采用腹主动脉缩窄术建立 Wistar 大鼠压力超负荷模型,随机分为对照组(14 只 )和非诺贝特组(14 只);另建立假手术组(14 只 )。假手术组和对照组给予生理盐水、非诺贝特组给予非诺贝特 150 mg/(kg·d),干预 8 周后,留取大鼠心肌,光镜观察心肌结构,计算胶原容积分数;电镜观察线粒体结构,进行 Flameng 评分;测定血清及心肌游离脂肪酸水平;蛋白质印迹法、逆转录聚合酶链反应检测过氧化物酶体增殖物激活受体 α(PPARα)、中链脂酰辅酶 A 脱氢酶 (MCAD)、肌型肉碱棕榈酰转移酶 -1(MCPT-1)蛋白及基因表达。
结果:①干预后,对照组、非诺贝特组心肌左心室质量指数、胶原容积分数较假手术组增高,非诺贝特 组则较对照组明显降低(P 均 <0.05);②干预后,对照组、非诺贝特组心肌线粒体损伤 Flameng 评分高于假手术组,非诺贝特组评分低于对照组(P 均 <0.05);③干预后,非诺贝特组血清及心肌游离脂肪酸较对照组明显降低(P均 <0.05);④干预后对照组、非诺贝特组心肌 PPARα、MCPT-1、MCAD 蛋白及基因表达均较假手术组下调, 非诺贝特组较对照组上调(P均 <0.05),差异均有统计学意义。
结论 :在压力超负荷中期,非诺贝特通过上调大鼠心肌 PPARα、MCPT-1、MCAD 基因表达,增强脂肪酸氧化,而降低血清和心肌游离脂肪酸,减轻线粒体损伤,减轻左心室肥厚和心肌纤维化,有助于保护压力超负荷下大鼠心脏功能。
