GATA-4 M310V 单基因突变参与家族性房间隔缺损的机制研究*
2013-04-19唐胤韩增强寒桦陈彧
唐胤,韩增强,寒桦,陈彧
GATA-4 M310V 单基因突变参与家族性房间隔缺损的机制研究*
唐胤,韩增强,寒桦,陈彧
目的:在以往发现家族性先天性房间隔缺损 GATA-4 M310V 单基因突变的基础上,本研究进一步探讨该突变导致家族性房间隔缺损的可能机制。
先天性心脏病;GATA-4 基因;基因突变;启动子活性;蛋白质核定位
(Chinese Circulation Journal, 2013,28:211.)
先天性心脏病是人类出生缺陷中最常见的畸形,但其病因仍不清楚,目前认为是遗传因素及环境致畸因素共同作用的结果。研究发现GATA-4 基因等转录因子突变是先天性心脏病的重要病因。GATA-4 参与调节心脏结构基因的表达 ,包 括 心 脏 肌 球 蛋 白 重 链 -α(α-Myhc)、心肌钙蛋白 C、心房利钠肽因子(ANF)等[1,2],并通过其锌指结构与其他心脏特异性的转录因子如 Nkx2-5、TBX5 等相互作用发挥转录调控作用。先天性房间隔缺损是最常见的发育性心脏病之一,GATA-4 等基因突变与房间隔缺损的关联机制早已得到研究关注[3,4]。2003 年《Nature》第一次报告 GATA-4 基因突变导致的家族性房间隔缺损[5]。我们前期基因筛查全新发现了 GATA-4 基因外显子 5 区域的点突变(A928G)(M310V)与房间隔缺损相关[6],而该突变氨基酸恰好位于GATA4蛋白的重要功能结构域——核定位信号(NLS)。GATA-4 基因这一区域的突变少有报道。本研究将进一步探讨 GATA-4 M310V 单基因突变导致家族性房间隔缺损的可能机制。
1 资料与方法
表达载体与报告基因载体的构建: 2010-02 选取我们在前期工作中发现的一个先天性房间隔缺损家族(三级亲属成员共 31人中有8例单纯性房间隔缺损患者),经我院伦理委员会批准,并经8例单纯性房间隔缺损患者知情同意并签署知情同意书后采集外周血样,3例单纯性房间隔缺损手术患者知情同意并签署知情同意书后采集少量心肌组织标本。采用 TRIZOL 总核糖核酸(RNA)提取试剂盒(实验室自备)提取人心肌细胞总 RNA,采用 M-MLV反转录酶(Promega 公司)将 RNA 逆转录为互补脱氧核糖核酸(cDNA)。以人 RNA 为模板进行聚合酶链反应(PCR)反应扩增 GATA-4 目的基因片段及ANF、α-Myhc 启动子目的片段。设计合成引物信息见表1。反应条件为:预变性 95 ℃ 5 min,变性95 ℃ 30 s,退火 55 ℃ 30 s,延伸 72 ℃ 45 s,72℃ 7 min,共 32 次循环。扩增产物回收后纯化,行双酶切反应后将回收的酶切后载体与目的片段进行水浴连接,构建载体依据 STRATAGENE 公司说明书进行定点突变(表1)。

表1 基因目的片段引物序列
α-Myhc、ANF 启动子活性双荧光素酶报告系统检测 :Hela 细胞(实验室自备 )培养至 70%~80% 生长密度时,参照 Invitrogen 公司的 LipofectamineTM 2000 说明书,按照不同载体组合(表2)转染 Hela细胞,培养 48 h 后采用 Promega 公司的双荧光素酶报告系统、以 pRL-SV40 质粒为内参,进行启动子活性检测。每个转染组合进行5次重复实验取平均值。
GATA4 蛋 白 细 胞 定 位 实 验 :将 构 建 好 的pEGFP-GATA4 表达载体(野生型和 A928G 突变型)瞬时转染大鼠心肌细胞 H9c2(购自 ATCC 公司 ),培养 48 h 后收集细胞进行涂片,固定细胞后采用4',6- 二脒基 -2- 苯基吲哚 (Invitrogen 公司 )进行细胞核染色,通过观察绿色荧光蛋白发光的情况,确认GATA4蛋白在细胞内的定位情况。
统计学方法 :采用 SPSS16.0 统计软件,双荧光素酶检测检测结果用x±s表示,对所测结果进行正态性及方差齐性检验,同一野生型或突变型载体不同剂量转染组内比较采用单因素方差分析,相同表达载体剂量野生型与突变型载体影响效果组间比较采用t检验,P<0.05 为差异有统计学意义。
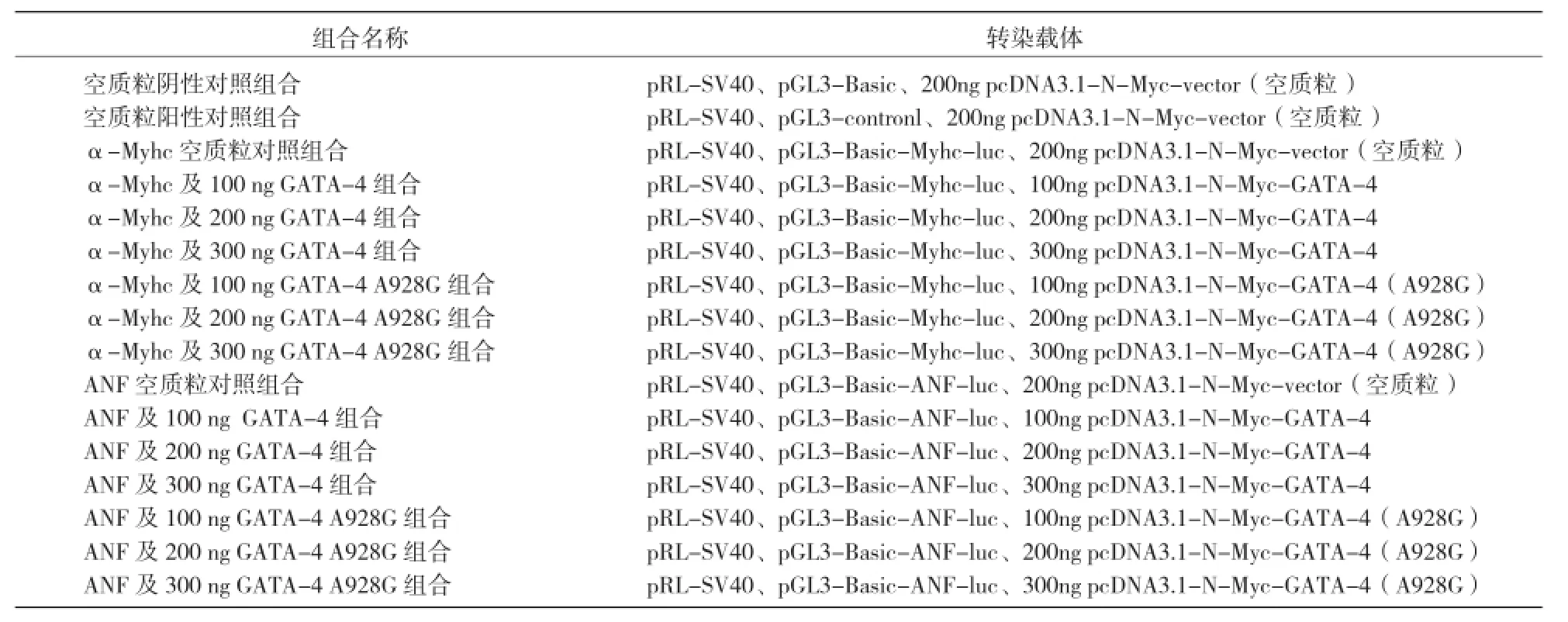
表2 转染入 Hela 细胞系的载体组合
2 结果
载 体 构 建 后 进 行 测 序 验 证,pcDNA3.1-GATA-4、pcDNA3.1-GATA-4(A928G)、pEGFPGATA-4、 pEGFP-GATA-4(A928G)、 及报 告基因 载 体 pGL3-Basic-Myhc-luc、pGL3-Basic-ANF-luc 均验证构建成功。
双荧光素酶检测结果:对于 α-Myhc 启动子,引入 GATA-4 基因表达载体后,随着 GATA-4 表达载体浓度的上升,其启动子活性呈现上升趋势,差异有统计学意义(P<0.005);引入 GATA-4(A928G)突变基因表达载体后,相同 GATA-4 表达载体转染剂量(100 ng、200 ng)调控的启动子活性增强,差异有统计学意义(P<0.005);但随GATA-4 突变型表达载体引入量的增加(300 ng),启动子活性似乎有下降趋势,但差异无统计学意义(P=0.195)。对于 ANF 启动子,引入 GATA-4基因表达载体、GATA-4 突变基因表达载体后,启动子活性变化组间差异及趋势变化并不明显(P>0.05)。表3
GATA-4 M310V 突 变 对 GATA4 蛋 白 定 位的影响:pEGFP-GATA-4(A928G)突变型重组载体转染后大鼠心肌细胞绿色荧光发光区外周有环形强光带,且边界大于蓝色荧光视野下细胞核显色区域。而 pEGFP-GATA-4 野生型重组载体转染后大鼠心肌细胞绿色荧光视野下发光区域与蓝色荧光视野下细胞核显色区域一致,且绿色荧光视野下发光区域边缘无环形强光带。图1、2

表3 双荧光素酶检测结果

图1 pEGFP-GATA-4(A928G)突变型重组载体转染后荧光观察结果。图2 pEGFP-GATA-4 野生型重组载体转染后荧光观察结果。1A、2A:白光视野显示大鼠心肌细胞直视形态。1B、2B:绿色荧光视野显示GATA4 蛋白位置。1C、2C:蓝色荧光显示细胞核位置
3 讨论
实验结果显示,野生型 pEGFP-GATA4 融合蛋白完全定位在细胞核中,突变型 pEGFP-GATA4 融合蛋白有部分定位在细胞核中,但同时也定位在胞核周边细胞质中。由此推知,定点突变影响了融合蛋白的核定位,即核定位信号区的 M310V 突变影响了 GATA4 蛋白的核定位。
综上所述,课题实验证实了 GATA4蛋白对α-Myhc启动子活性具有量依赖性的正性调控作用,而该突变可能没有明显影响 GATA4 蛋白对 ANF启动子活性的调控。GATA-4 核定位信号区的 M310V突变影响了 GATA-4蛋白的定位功能。
人类 GATA-4 基因属于 GATA 转录因子家族,GATA 结合蛋白家族广泛存在于各种生物体内 ,是调节细胞生长与分化的重要转录因子[7],大量研究证实了 GATA-4 是维持心血管系统发育的关键性转录因子[8]。目前已发现 GATA-4 突变与多种先天性心脏疾病相关,如房间隔缺损、室间隔缺损、法洛四联症、右心室肥大、心内膜垫缺损[9-11]等。
在心脏发育和心肌活动的不同阶段,α-Myhc、ANF 均起到重要作用。有研究报道发现 GATA-4 对于 α-Myhc、ANF 基因具有量依赖性的正性调控作用。本研究结果发现 GATA-4 M310V 突变影响ANF、α-Myhc的程度与效果与先前的报道可能并不一致,推测不同位点的基因突变对 GATA-4 表达调控的意义和影响也可能不同。
核定位信号是亲核蛋白均具备的特殊短肽氨基酸序列,是蛋白质通过主动运输进入核孔的充分必要条件。经典的核定位信号由核心信号及其相邻的调控序列构成,残基的组成形式决定信号的强弱,由于重要碱性氨基酸残基突变或关键氨基酸残基改变引起蛋白构象变化而导致核定位信号不能有效暴露可导致核定位信号区被覆盖,进而影响蛋白的入核移位功能[12]。本研究结果也确实发现 GATA-4 M310V 突变导致部分 GATA4 蛋白未能定位入核, GATA4 蛋白入核量减少后影响心肌细胞及心脏结构调控导致心脏发育缺陷的机制有待进一步研究。
最近,Ieda 等[13]报 道应 用包 含 Gata4、Mef2c、和 Tbx5(GMT)转录组信息的逆转录病毒载体注射感染大鼠心脏心肌梗死区域,可诱导纤维母细胞转化 为 心 肌 样 细 胞。Ahuja 等[14]报 道 以 GATA-4 基因为靶向目标的姜黄素将有可能起到抑制心肌肥厚的治疗作用。因此,转录因子 GATA-4 等调控心肌结构与心脏发育的机制有重要意义和广阔的应用前景,有可能为先心病临床诊断、基因治疗药物的开发或直接应用转录因子进行先心病的基因治疗等提供新的分子生物学信息和突破口。而 GATA-4 M310V 核定位区突变作为一种新 GATA-4 突变致先心病机制,其参与心肌结构发育与心脏功能的通路和机制具有重要意义,值得深入研究。
综上所述,课题实验证实了 GATA4 蛋白对α-Myhc启动子活性具有量依赖性的正性调控作用,GATA-4 M310V 突变可能改变了其对 α-Myhc 启动子活性调控的趋势,而该突变可能没有明显影响GATA4 蛋白对 ANF 启动子活性的调控。GATA-4 核定位信号区 M310V 突变影响了 GATA4 蛋白的定位,使全部定位于细胞核的GATA4蛋白部分定位于核周的细胞质中,可能是该突变导致家族性先天性房间隔缺损的重要分子生物学机制。GATA4 M310V 突变引起 GATA4蛋白核定位改变及进一步影响心肌细胞结构调控的机制有待深入研究明确。
[1]Brunskill EW. Novel cell lines promote the discovery of genes involved in early heart development. Dev Biol, 2001, 235: 507-520.
[2]Temsah R, Nemer M. GATA factors and transcriptional regulation of cardiac natriuretic peptide genes. Regul Pept, 2005, 128: 177-185.
[3]韩增强 ,唐胤 ,陈彧,等 .81 例单纯性先天性心脏病患者 NKx2.5基因突变筛查及关联研究 .中国循环杂志,2011,26:461-464.
[4]石琳,李晓峰,申 阿 东, 等 .法洛四联 症 患 儿 NKX2.5、TBX5、GATA-4 基因的表达研究 .中国循环杂志,2009,34:375-378.
[5]Garg V , Kathiriya IS , Barnes R, et al. GATA4 mutations cause human congenital heart defects and reveal an interaction with TBX5. Nature , 2003 ,424 :443-447.
[6]Chen Y, Han ZQ, Yan WD,et al.A Novel Mutation in GATA4 Gene associated with Dominant Inherited Familial Atrial Septal Defect. J Thoracic Cardiovascular Surg,2010,40:684-687.
[7]Patient RK, McGhee JD. The GATA family(vertebrates and invertebrates). Curr Opin Genet Dev, 2002, 12: 416-422.
[8]姜升阳,徐明,张幼怡 . GATA 结合蛋白 4 在心脏发育及心肌重塑中的作用 . 生理学进展, 2008,39:302-306.
[9]Rajagopal SK, Ma Q, Obler D, et al. Spectrum of heart disease associated with murine and human GATA4 mutation. J Mol Cell Cardiol,2007,43:677-685.
[10]Zhang W, Li X, Shen A, et al. GATA4 mutations in 486 Chinese patients with congenital heart disease. Eur J Med Genet, 2008,51:527-535.
[11]Butler TL, Esposito G, Blue GM, et al. GATA4 mutations in 357 unrelated patients with congenital heart malformation. Genet Test Mol Biomarkers, 2010, 14: 797-802.
[12]Hall MN, Craik C, Hiraoka Y. Homeodomain of yeast repressor alpha 2 contains a nuclear localization signal. Proc Natl Acad Sci USA, 1990, 87: 6954-6958.
[13]Ieda M, Fu JD, Delgado-Olguin P, et al. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell,2010,142:375-386.
[14]Ahuja S, Kohli S, Krishnan S,et al. Curcumin: a potential therapeutic polyphenol, prevents noradrenaline-induced hypertrophy in rat cardiac myocytes. J Pharm Pharmacol, 2011,63:1604-1612.
Molecular Mechanism Study on GATA-4 M310V Gene Mutation Involved in Patients With Familial Atrial Septal Defect
TANG Yin, HAN Zeng-qiang, HAN Hua, CHEN Yu.
Department of Cardiac Surgery, Peking University People’s Hospital, Beijing (100044), China Corresponding Author: CHEN Yu, Email: chenyu@pkuph.edu.cn
Objective: Based on known gene mutation of GATA-4 M310V in familial congenital atrial septal defect (ASD), we further explored the possible molecular mechanism of these mutations involved in patients with familial ASD.Methods: A total of 31 subjects from one ASD family were studied, 8 of them suffered from ASD. The peripheral blood sample and small amount of myocardial tissue were collected from patients, and both wild type and mutant type GATA-4 expression vectors were constructed, then different vector-combination were transfected into Hela cell lines in vitro. The influences of GATA-4 mutation on α-Myhc and ANF promoters were examined by Dual luciferase reporter assay system. The effect of GATA-4 M310V mutation on GATA-4 protein nuclear location was measured by Green fluorescent protein location method.Results: Dual luciferase reporter assay presented that for α-Myhc promoter, its activity increased accordingly with the increased GATA-4 vector concentrations, P<0.05. With trasfected GATA-4 (A928G) mutation vectors (100ng, 200ng)the corresponding GATA-4 controlled promoter activity increased accordingly, P<0.005. While with more GATA-4 mutation vector (300ng) trasfected, the promoter activity seemed to decrease but no statistic meaning, P=0.195. For ANF promoter, with transfected GATA-4 vector and GATA-4 mutation vector, its activity changes was not significantly, P>0.05.Conclusion: GATA-4 M310V gene mutation affects α-Myhc promoter activity and GATA-4 protein nuclear location, which might be an important molecular mechanism for patients who suffering from familial congenital ASD.
Congenital heart disease; GATA-4 gene; Gene mutation; Promoter activity; Protein nuclear location
2012-12-18)
(编辑:王宝茹)
*
国家自然科学基金资助项目(项目号:81041004)
100044 北京市,北京大学人民医院 心脏中心 心外科
唐胤 住院医师 博士 主要从事心外科方面研究 Email:tangyin39@163.com 通讯作者:陈彧 Email:chenyu@pkuph.edu.cn
R54
A
1000-3614(2013)03-0211-04
10.3969/j.issn.1000-3614.2013.03.015
方法:选取一个先天性房间隔缺损家族(三级亲属成员共 31 人中有 8 例单纯性房间隔缺损患者),采集外周血样,采集少量心肌组织标本。体外成功构建 GATA-4基因野生型及突变型真核表达载体并转染细胞系,按照不同载体组合(16 种组合 )转染 Hela 细胞,应用双荧光素酶报告系统检测 GATA-4 基因突变对心脏肌球蛋白重链 -α(α-Myhc)、心房利钠肽因子(ANF)启动子活性的影响。应用绿色荧光蛋白定位法检测 GATA-4 M310V 突变对 GATA4 蛋白核定位的影响。
结果:双荧光素酶检测结果:对于 α-Myhc 启动子,引入 GATA-4 基因表达载体后,随着 GATA-4 表达载体浓度的上升,其启动子活性呈现上升趋势,差异有统计学意义(P<0.005);引入 GATA-4(A928G)突变基因表达载体后,相同 GATA-4 表达载体转染剂量(100 ng、200 ng)调控的启动子活性增强,差异有统计学意义(P<0.005);但随GATA-4 突变型表达载体引入量的增加(300 ng),启动子活性似乎有下降趋势,差异无统计学意义(P=0.195)。对于ANF 启动子,引入 GATA-4 基因表达载体、GATA-4 突变基因表达载体后,启动子活性变化组间差异及趋势变化并不明显(P>0.05)。
结论:GATA-4 M310V 突变影响了 α-Myhc 启动子活性及 GATA4 蛋白的核定位,该突变对 GATA4 蛋白核定位的影响可能是该突变导致家族性房间隔缺损新的重要分子生物学机制。
