环介导等温扩增技术在检测痰标本结核分枝杆菌中的应用
2013-04-18王静张艳胡钰卿竺祖军岳永宁朱敏
王静 张艳 胡钰卿 竺祖军 岳永宁 朱敏
环介导等温扩增技术在检测痰标本结核分枝杆菌中的应用
王静 张艳 胡钰卿 竺祖军 岳永宁 朱敏
目的 评价结核分枝杆菌环介导等温扩增技术(LAMP)快速检测试剂盒的临床应用效果。方法选取肺结核患者183例(肺结核组)和非肺结核患者120例(对照组)。采用涂片抗酸染色、罗氏培养法和LAMP对痰标本进行检测,采用结核分枝杆菌核酸扩增荧光检测试剂盒(TB-PCR)检测罗氏培养与LAMP结果不符的标本,分析LAMP与罗氏培养的检出率及两者的符合率。结果去除经鉴定为非结核分枝杆菌的10例标本,涂片抗酸染色、罗氏培养法和LAMP的阳性检出率分为64.1%(111/173)、64.7%(112/173)、78.6%(136/173)。LAMP与抗酸染色、罗氏培养阳性检出率的差异有统计学意义(P<0.01),抗酸染色与罗氏培养比较差异无统计学意义(P>0.05)。以罗氏培养为金标准,LAMP检测的灵敏度、特异度、阳性预测值和阴性预测值分别为88.5%(108/122)、82.3%(149/181)、77.1%(108/140)、91.4%(149/163),LAMP检测与罗氏培养的符合率为84.8%(257/303)。结论结核分枝杆菌环介导等温扩增技术的灵敏度和特异度高,具有简单易行、快速准确的特点,在肺结核患者的早期诊断中将发挥重要作用。
结核分枝杆菌 环介导等温扩增技术 痰
早期准确和廉价的检测诊断技术在结核病的预防、诊断、治疗中有着非常重要的作用。环介导等温扩增技术(loop-mediated isothermal amplication,LAMP)是近几年研究较多的恒温扩增方法,国内外实验室已进行了相关研究[1-3]。本实验室引进最近在国内研发的LAMP恒温扩增商品试剂盒,笔者通过评估其应用效果,旨在探求一种敏感、准确、快速、低成本、方便操作的方法。
1 资料和方法
1.1 一般资料 选取2011-06—10我院结核病治疗中心住院的肺结核患者183例(其中初治141例,复治42例),男125例,女58例,年龄18~88岁,平均(53±21)岁。所有对象均经临床表现、胸部X线、CT检查及痰液抗酸染色等确诊。选择同期在我院呼吸科住院的非结核患者120例,男90例,女30例,年龄18~97岁,平均(69±19)岁。其中肺癌22例,矽肺14例,慢性阻塞性肺气肿18例及慢性支气管炎20例,其它各类肺炎46例。本研究经本院伦理委员会批准,所有患者均知情同意。
1.2 方法
1.2.1 痰标本采集 嘱患者漱口后留早晨第一口痰。
1.2.2 抗酸染色 按照文献[4]进行。
1.2.3 罗氏培养及菌株菌型鉴定 按照文献[4]操作。对于罗氏培养阳性菌株使用对硝基苯甲酸(PNB)鉴别培养基(500μg/ml)进行分型,区分结核分枝杆菌复合群与非结核分枝杆菌。培养基购自杭州创新生物检控技术有限公司(批号20110625和20110901)。
1.2.4 LAMP检测 结核分枝杆菌核酸快速检测试剂盒由广州华峰生物科技有限公司提供(批号:20110409)。试剂盒包含4条LAMP引物,引物序列为FIP:ACCGTTGACCCCGTCTTCTTGTTTTAGAAGTCGGAACCCCT;BIP:ATACGACTTCGAAACCGTCGCCTTTTGGTCAGCCCCTTGTTGAG,F3:GGGTACGAGTGGTCTCAGG,B3:CGTCTTGGGTCACCCTCT。引入SYBR GreenI核酸染液,直接用肉眼对实验结果判定[5]。
1.2.4.1 痰液样本DNA的制备 (1)初步估计痰样本量,加入4倍体积4%氢氧化钠溶液,充分混匀,室温静置液化30min;(2)吸取1ml液化痰加入1.5ml无菌离心管中,15 000r/min离心5min,吸弃上清液;(3)沉淀使用1ml 0.9%氯化钠溶液重悬洗涤,15 000r/min离心5 min,弃上清液;(4)采用1ml 0.9%氯化钠溶液重悬洗涤,15 000r/min离心5min,弃上清液,沉淀用于模板提取;(5)分别加入100μl DNA提取液Ⅰ和0.25μl Proteinase K,56℃温浴30 min,再沸水浴10 min;(6)加入12.5μl DNA提取液Ⅱ,稍混匀,12 000r/min离心5min,上清液即为DNA模板。
1.2.4.2 LAMP扩增反应 (1)在解冻后的HF管内按顺序分别加入阴性对照模板、待测标本模板和阳性对照模板各2.5μl;(2)放置65℃水浴箱恒温反应60min;(3)反应结束后使反应管冷却,颠倒混匀HF管。
1.2.4.3 结果判读 (1)若待检样品反应管液体变为绿色,说明该管发生了特异性扩增,为结核分枝杆菌阳性;(2)若待检样品反应管液体仍为橙色,说明未发生特异性扩增,为结核分枝杆菌阴性。
1.3 结核分枝杆菌核酸扩增荧光体外检测(TB-PCR)当同样的标本罗氏培养与LAMP检测结果不一致时,采用TB-PCR对备份样品进行检测。试剂盒购自深圳匹基生物工程有限公司(批号:20110307)。
1.4 统计学处理 采用SPSS11.5统计软件。以罗氏培养基检测结果为金标准,计算LAMP检测的敏感度、特异度、阳性预测值和阴性预测值。阳性检出率组间比较采用χ2检验。
2 结果
2.1 肺结核组3种检测方法阳性率的比较 肺结核组罗氏培养阳性122例,所有阳性菌株均经PNB培养基进行结核分枝杆菌复合群与非结核分枝杆菌鉴定,其中LAMP阴性培养阳性的10例痰标本为非结核分枝杆菌(未进行进一步分型)。剩余的173例标本中,抗酸染色、罗氏培养、LAMP的阳性检出率分别为64.1%(111/173)、64.7%(112/173)、78.6%(136/173),LAMP试验与抗酸染色阳性检出率的差异有统计学意义(χ2= 8.84,P<0.01),与罗氏培养法的差异有统计学意义(χ2=8.20,P<0.01),抗酸染色法与罗氏培养的差异无统计学意义(χ2=0.02,P>0.05)。
2.2 两组患者LAMP检测与罗氏培养检测结果比较肺结核组122例罗氏培养阳性中LAMP检测阳性108例,阴性14例;61例罗氏培养阴性中LAMP检测阳性28例,阴性33例。对照组120例痰标本中,罗氏培养均为阴性,LAMP检测阳性4例。以罗氏培养为金标准,LAMP检测的灵敏度、特异度、阳性预测值和阴性预测值分别为 88.5%(108/122)、82.3%(149/181)、77.1%(108/140)、91.4%(149/163),LAMP检测与罗氏培养的符合率为84.8%(257/303)。
2.3 TB-PCR检测结果 两组患者的痰标本中罗氏培养与LAMP检测结果不符的标本共46例,其中34例LAMP检测结果与TB-PCR检测结果一致,详见表1。
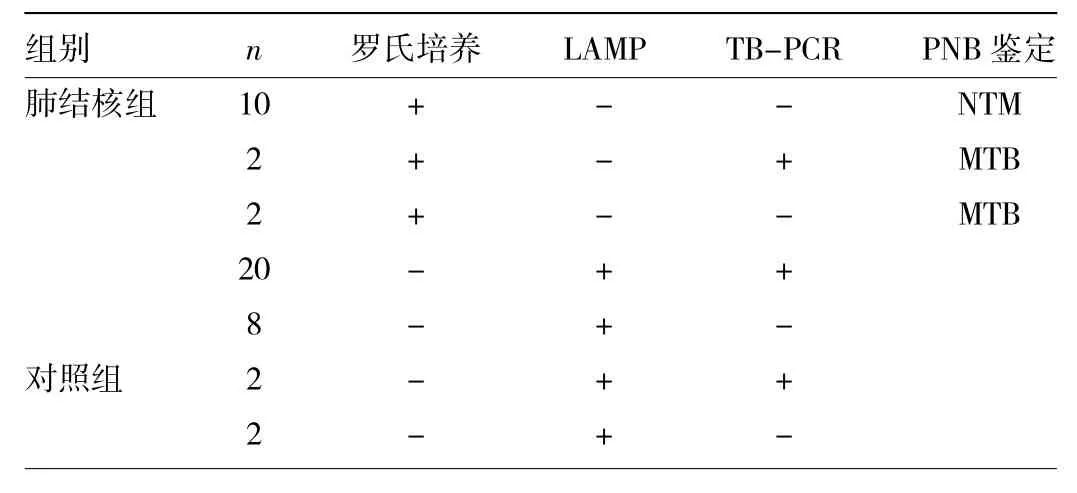
表1 罗氏培养与LAMP检测结果不一致的标本
3 讨论
为了寻找快速灵敏的结核病感染检测诊断方法,目前已有多种核酸扩增方法,如罗氏公司Amplicor检测系统[6]、Genprobe的rRNA扩增结核分枝杆菌直接反应(AMTD)[7]、连接酶链式反应[8]、Q-β复制酶扩增法[9]、链置换扩增法[10],但以上基因学检测方法都需要昂贵的仪器设备以及实验室条件,限制了这些方法的广泛应用。
LAMP检测是近年发展起来的核酸体外扩增技术,该方法最初是由Notomi等[11]设计用于病原微生物的检测,其针对靶基因的6个区段,在一个恒定65℃下即可完成扩增,可一步完成基因的扩增和产物的检测,并在15~60min内扩增109~1 010倍,扩增效率极高,摆脱了特殊仪器的限制,操作更加的简单、方便,适合大量样品高通量检测,通过判别扩增产物的有无来对靶基因序列进行检测,结果判断简单,可通过比浊法[4]和紫外线法两种方法进行。
本研究显示,LAMP检测的阳性率(78.6%)明显高于抗酸染色法(64.1%)、罗氏培养(64.7%)。以罗氏培养为金标准,LAMP检测的灵敏度、特异度、阳性预测值和阴性预测值分别为88.5%(108/122)、82.3%(149/ 181)、77.1%(108/140)、91.4%(149/163),LAMP检测与罗氏培养的符合率为84.8%(257/303),与国外文献报道基本相似[1-3]。由于罗氏培养阳性菌株中包括MTB和NTB,因此其特异度较低;另外,由于罗氏培养的营养条件等因素的限制,检测临床标本的MTB敏感度偏低。上述缺点导致本方法与罗氏培养检测结果符合率偏低问题。本研究选用TB-PCR试剂盒,对罗氏培养和LAMP检测结果不符的标本进行第3方检测评价,TBPCR试剂盒作为MTB检测试剂,具有较高的灵敏度和特异度。在46例罗氏培养与LAMP检测结果不符的标本中,34例LAMP与TB-PCR检测结果相符。
本研究发现了LAMP检测过程从样品制备到结果报告,所需时间短,仅需3h,通过肉眼可迅速观察到实验结果,并且可以较准确地对标本中是否含有结核分枝杆菌复合群做出快速鉴定,为临床医师对肺结核患者早期诊断和鉴别诊断提供了重要依据。因此,LAMP恒温扩增技术具用高灵敏度、高特异度、操作简单、设备要求低、实验人员快学易接受等优点,在经济条件欠发达的发展中国家具有巨大的发展前景。
A novel and more sensitive loop-mediated isothermal amplification assay targeting IS6110 for detection of Mycobacterium tuberculosis complex[J].Microbiological Research,2010,165(3): 211-220.
[2] Catharina C.Boehme,Pamela Nabeta,German Henostroza,et al.Operational feasibility of using loop-mediated isothermal amplification for diagnosis of pulmonary tuberculosis in microscopy centers of developing countries[J].Journal of Clinical Microbiology,2007,45(6):1936-1940.
[3] Geojith George,Prem Mony,John Kenneth.Comparison of the Efficacies of Loop-Mediated Isothermal Amplification,Fluorescence Smear Microscopy and Culture for the Diagnosis of Tuberculosis[J].PLOS ONE,2011,6(6):e21007.
[4] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006:13-16,33-36,54.
[5] Yasuyoshi Mori,Kentaro Nagamine,Norihiro Tomita,et al.Detection of loop-Mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochemicaland BiophysicalResearch Communications, 2001,289(1):150-154.
[6] Carpentier E,Drouillard B,Dailloux M,et al.Diagnosis of tuberculosis by Amplicor Mycobacterium tuberculosis test:a multicenter study[J].Journal of Clinical Microbiology,1995,33(12): 3106-3110.
[7] Vlaspolder F,Singer P,Roggeveen C.Diagnostic value of an amplification method(Gen-Probe)compared with that of culture for diagnosis of tuberculosis[J].Journal of Clinical Microbiology,1995,33(10):2699-2703.
[8] Douglas F Moore,Janis I Curry.Detection and Identification of Mycobacterium tuberculosis Directly from Sputum Sediments by Ligase Chain Reaction[J].Journal of Clinical Microbiology, 1998,36(4):1028-1031.
[9] Smith J H,Radcliffe G,Rigby S,et al.Performance of an automated Q-beta replicase amplification assay for Mycobacterium tuberculosis in a clinical trial[J].Journal of Clinical Microbiology, 1997,35(6):1484-91.
[10] Bergmann J S,Woods G L.Clinical evaluation of BD ProbeTec strand displacement amplification assay for rapid diagnosis of tuberculosis[J].Journal of Clinical Microbiology,1998,36(9): 2766-2768.
[11] Tsugunori Notomi,Hiroto Okayama,Harumi Masubuchi,et al. Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):e63.
Evaluation of loop-mediated isothermal amplification in direct detection mycobacterium tuberculosis DNA of sputum samples
ObjectiveTo assess the clinical use of the loop-mediated isothermal amplification(LAMP)assay for detection mycobacterium tuberculosis in sputum samples.MethodsLAMP with acid-fast bacilli(AFB)smear microscopy and Lowenstein-Jensen(L-J)culture,were performed in 183 sputum specimens from pulmonary tuberculosis patients and 120 sputum specimens from non-pulmonary tuberculosis patients.The samples with different results between LAMP and L-J culture were tested by mycobacterium tuberculosis PCR fluorescence diagnostic kits.L-J culture positive strains were identified by p-Nitrobenzoic acid medium.The sensitivity and specificity of LAMP were calculated according to the result of L-J culture.The detection rates of the 3 methods were analyzed according to the clinical diagnosis and the differences were analyzed by chi-square test.ResultsFor tuberculosis patient(removing 10 samples caused by NTM),the detection rate of AFB,L-J culture and LAMP were 64.1%(111/173)、64.7%(112/173)、78.6%(136/173),respectively.The differences between LAMP and other 2 methods were signifinant(P<0.01).The difference between the detection rates of AFB and L-J culture was not significant(P>0.05).With the results of L-J culture as the reference,the sensitivity、specificity、positive and negative predictive values of LAMP were 88.5%(108/122)、82.3%(149/181)、77.1%(108/140)、91.4%(149/163),respectively.The accordance rate of LAMP and L-J culture was 84.8%(257/303). Conclusion LAMP is a rapid,sensitive and specific method for detection of mycobacterium tuberculosis in clinical sputum samples.
Mycobacterium tuberculosis Loop-mediated isothermal amplification Sputum

2012-11-22)
(本文编辑:严玮雯)
310003 杭州市红十字会医院结核病治疗中心
王静,E-mail:wj_wzmc@163.com
[1] Ehsan Aryan,Manoochehr Makvandi,Ahmad Farajzadeh,et al.
