Oct4在胃癌组织中的表达及其与胃癌浸润转移及预后的关系
2013-04-18王克畏王元宇叶再元
王克畏 王元宇 叶再元
Oct4在胃癌组织中的表达及其与胃癌浸润转移及预后的关系
王克畏 王元宇 叶再元
目的 探讨干细胞标记物Oct4在胃癌组织中的表达及其与胃癌浸润、转移及预后的关系。 方法 应用免疫组织化学SP法检测206例胃癌组织和其中40例癌旁非肿瘤胃黏膜Oct4的表达,并对Oct4表达水平与胃癌临床病理参数及患者生存率的关系作统计分析。 结果 在40例非肿瘤胃黏膜组织中,13例(32.5%)Oct4表达阳性,均为低表达。在206例胃癌组织中,155例(75.2%)存在Oct4表达,其中高表达126例(61.17%),Oct4在胃癌组织中的表达水平明显高于癌旁非肿瘤胃黏膜组织(P<0.05)。Oct4蛋白的表达与胃癌的分化程度、浸润深度、淋巴结转移、远处转移及TNM分期有关(均P<0.05),而与患者年龄、性别、肿瘤部位、肿瘤大小和组织学类型无关(均P>0.05)。I、Ⅱ和Ⅲ期Oct4高表达胃癌患者5年生存率显著低于Oct4低表达者(均P<0.05),Ⅳ期胃癌患者的5年生存率与Oct4表达水平无关(均P>0.05),多变量分析表明Oct4表达、淋巴结转移、远处转移和TNM分期是胃癌患者独立的预后因素。 结论 Oct4的表达与胃癌淋巴结和远处转移及预后相关,Oct4可以作为胃癌预后判断有价值的分子标记物。
胃癌 Oct4 进展 预后
胃癌发病率踞世界各类肿瘤的第4位,死亡率踞第2位。尽管外科手术和放化疗技术不断发展,我国胃癌的病死率仍居于各种肿瘤之首,5年生存率仍低于40%,大多数患者确诊时已经是Ⅲ或Ⅳ期,淋巴结转移率高达50%~75%,转移是导致胃癌患者死亡的主要原因[1]。Octamer-4(Oct4)是一种转录因子,在胚胎和成人干细胞表达,并且与胚胎干细胞和生殖细胞的多潜能性、增殖潜力和自我更新特性相关[2]。Oct4在生殖细胞肿瘤表达的研究已有报道[3],但是在实体肿瘤的表达的研究仍很少。本研究使用免疫组织化学技术分析Oct4在胃癌及非肿瘤胃黏膜组织中的表达,明确Oct4在胃癌及非肿瘤胃黏膜组织中的表达情况及其与胃癌临床病理参数和患者预后的关系。
1 对象和方法
1.1 研究对象 收集本院2001-01—2005-12收治的胃癌患者206例,诊断均经病理检查证实,术前未经任何治疗。其中男142例,女64例,男女比例为2.22∶1;年龄30~85岁,中位年龄为62岁;肿瘤位于贲门42例,胃体77例,胃窦87例;肿瘤直径<5cm 99例,≥5cm 107例。按WHO 2002年胃癌分类标准诊断为乳头状腺癌5例,管状腺癌147例,黏液腺癌15例,印戒细胞癌39例;高、中分化腺癌65例,低、未分化癌141例;TNM分期Ⅰ期胃癌9例,Ⅱ期胃癌54例,Ⅲ期胃癌116例,Ⅳ期胃癌27例;有远处转移27例,无远处转移179例。并取其中40例患者的距癌边缘5 cm以上的无增生或不典型增生的非肿瘤胃黏膜作为对照。随访起止日期为2001-01—2010-12,生存期的计算从手术日期到随访截止日期,或由于复发、转移而死亡的日期为止。本研究得到医院伦理委员会同意和患者知情同意。
1.2 检测材料 山羊抗人Oct4抗体(SC-8629)购于Santa Cruz公司,广谱二抗试剂盒及DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色方法和结果判定 按文献[4]进行,Oct4以细胞质和细胞核出现棕黄色颗粒为阳性,根据染色程度和染色细胞百分率进行评定和分析:基本不着色者为0分,着色淡者为1分,着色适中者为2分,着色深者为3分;着色细胞占计数细胞的百分率≤5%记0分,6%~25%记1分,26%~50%记2分;≥51%记3分。将每张切片的染色程度与染色细胞百分率得分相乘,其乘积为最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。在统计分析中,将表达-或+划分为低表达组,++~+++划分为高表达组。
1.4 统计学处理 采用SPSS13.0统计软件,计数资料的比较采用χ2检验或Fisher精确概率检验,对生存数据采用Kaplan-Meier法分析并绘制生存曲线,差异性采用Log-rank检验,并用Cox风险模型进行独立预后因素分析。
2 结果
2.1 Oct4在正常胃黏膜组织和胃癌组织中的表达 在40例非肿瘤胃黏膜组织中,13例(32.5%)Oct4表达阳性,均为低表达。206例胃癌组织中,155例(75.2%)Oct4表达阳性,其中高表达126例(61.17%),主要在细胞核和细胞质表达(图1)。
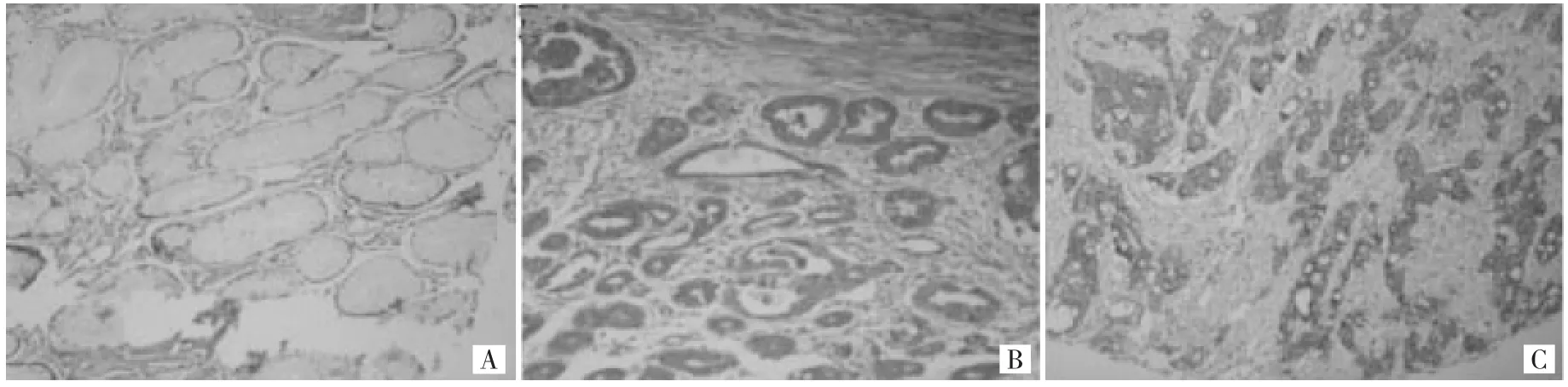
图1 免疫组织化学检测Oct4在非肿瘤胃黏膜及胃癌组织中的不同表达强度(A:非肿瘤胃黏膜组织阴性表达;B:中分化胃腺癌阳性表达;C:低分化胃腺癌阳性表;SP法,×100)
2.2 Oct4表达与胃癌临床病理指标的关系 见表1。
由表1可见,Oct4的表达强度与胃癌分化程度、浸润深度、相关淋巴结转移及远处转移相关(均P<0.05),而与患者的性别、肿瘤部位、肿瘤直径大小、组织学类型无关(均P>0.05)。T3和T4、有淋巴结转移、有远处转移、Ⅲ期和Ⅳ期胃癌组织Oct4表达明显强于T1和T2、无淋巴结转移、无远处转移、Ⅰ期和Ⅱ期胃癌组织的表达。
2.3 Oct4表达与患者预后的关系 由于Ⅰ期患者太少,行生存分析时将Ⅰ、Ⅱ期合并,Ⅰ期和Ⅱ期Oct4低表达患者5年生存率为71.43%(25/35),高表达者为53.57%(15/28),两者的差异有统计学意义(P<0.01,图2);Ⅲ期Oct4低表达患者5年生存率为33.3%(13/39),高表达者为9.09%(7/77),两者的差异有统计学意义(P<0.01,图3);Ⅳ期Oct4低表达患者5年生存率为0(0/6),高表达者为4.76%(1/21),两者的差异无统计学意义(P>0.05)。独立预后因素分析表明,Oct4表达、淋巴结转移、远处转移和TNM分期均为胃癌的独立预后因素(均P<0.05)。
3 讨论
Oct4是含POU同源结构域蛋白家族的成员之一,参与胚胎干细胞和生殖细胞的多潜能性、特异细胞类型终末分化和胚胎的早期形成[5]。Oct4在成人干细胞高表达,并参与了肿瘤的形成[6]。Okamoto等[7]研究表明,Oct4蛋白高表达与鼠胚胎干细胞源行肿瘤恶性潜能呈正相关。Oct4在化生的胰腺导管表达显著高于正常胰腺腺泡和胰腺癌组织(P<0.05)[8]。Oct4高表达导致生长因子的不平衡激活、促进细胞增殖,最终导致恶性转化[9]。Oct4的表达与良性前列腺疾病和高级别前列腺上皮内瘤变显著相关,而与前列腺癌无关[10]。Oct4在不同的组织存在不同程度的表达,在有些肿瘤组织中高表达,也有一些肿瘤组织中低表达。本研究表明Oct4在胃癌组织中高表达(206例中126例阳性,达61.17%),并主要在细胞核和细胞质表达。
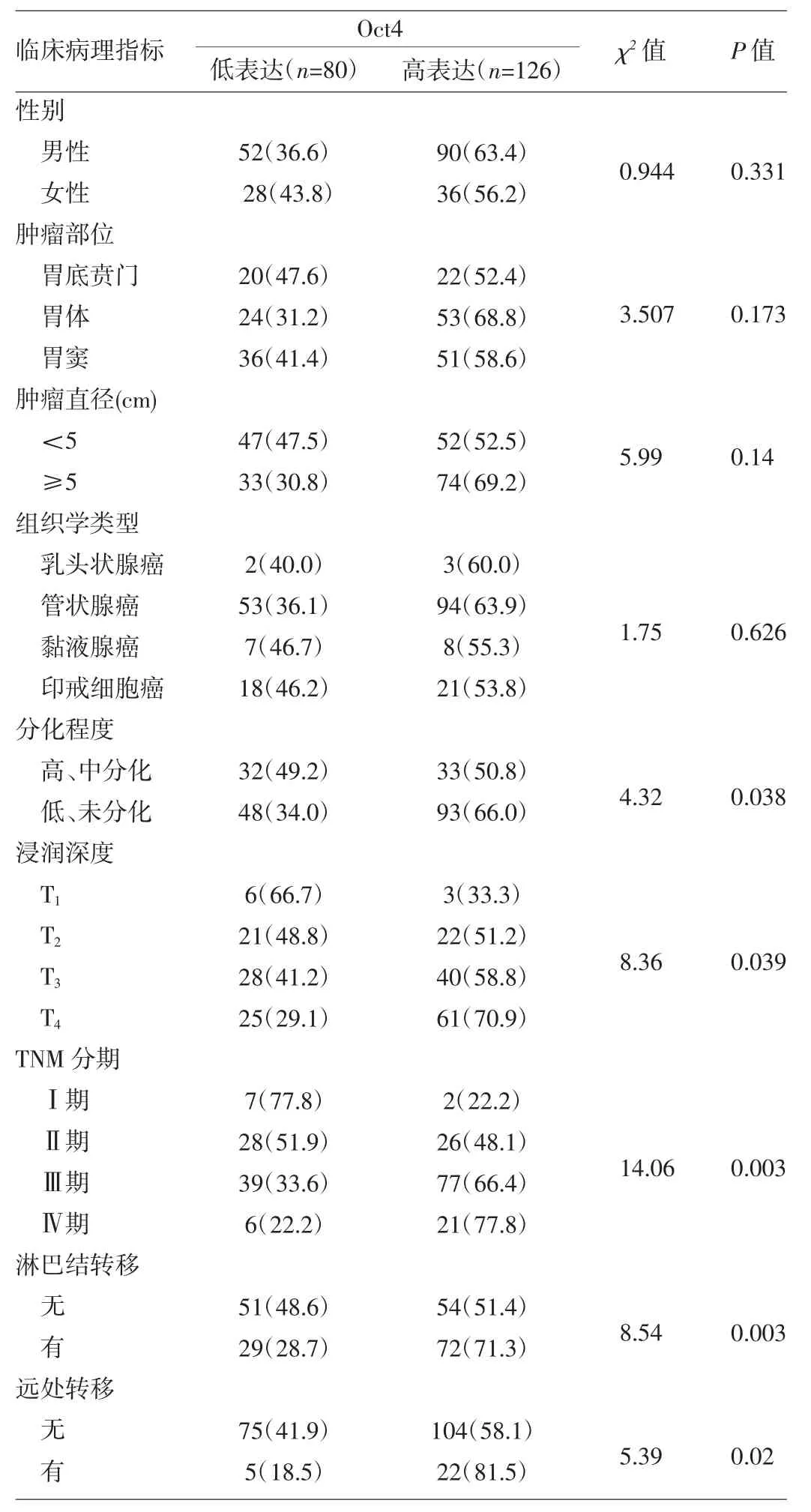
表1 Oct4表达与临床病理指标间的关系[例(%)]
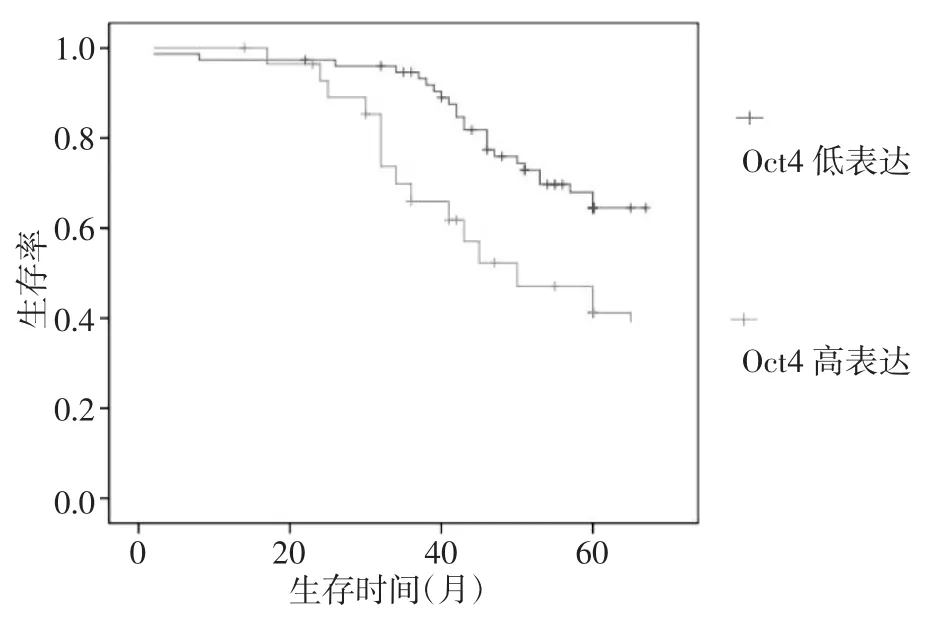
图2 Ⅰ期和Ⅱ期胃癌患者生存曲线
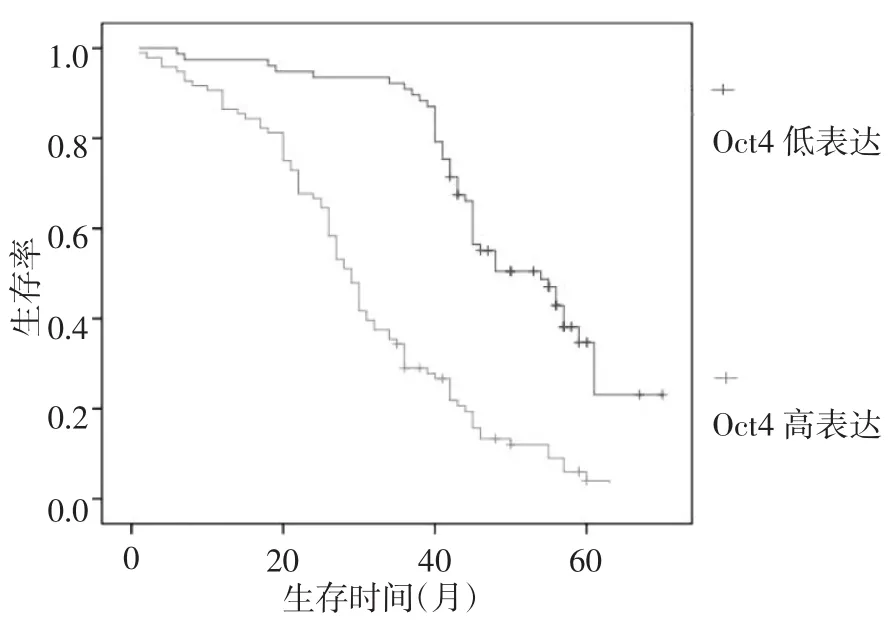
图3 Ⅳ期胃癌患者生存曲线
目前关于Oct4在肿瘤组织中的表达与肿瘤的分化、浸润、转移的研究很多,各研究结果之间存在着很大的差异。Oct4A mRNA在肝癌组织中高表达,其表达水平与肿瘤浸润表型显著相关,Oct4A表达是肝癌独立预后因素之一[11]。Oct4在膀胱癌组织中表达,Oct4阳性率与肿瘤分级、复发和转移无显著相关性[12]。上述研究表明Oct4在肿瘤组织中高表达,其表达与肿瘤的分化、浸润和转移相关。本研究结果表明,Oct4的表达强度与胃癌的分化程度、浸润深度、淋巴结转移、远处转移及TNM分期相关,Ⅰ、Ⅱ期和Ⅲ期Oct4低表达患者5年生存率显著高于高表达者,而在Ⅳ期,Oct4表达与患者的预后无相关性;TNM分期是影响预后的主要因素,由于本研究Ⅳ期例数比较少,Oct4表达与Ⅳ期患者的预后有无相关性有待进一步大样本量来进行验证。Oct4在胃癌组织中的表达及其临床意义的研究也有文献报道,认为Oct4在胃癌组织中的表达水平显著高于配对的非肿瘤组织、萎缩性胃炎和胃溃疡组织的表达水平,Oct4在胃癌组织中的表达与肿瘤的分化相关,而与患者的性别、年龄、肿瘤大小、TNM分期、浸润深度和淋巴结转移不相关,Oct4是肿瘤发生、进展和分化的潜在标记物[13]。这一结论与我们的研究结果存在差异,原因可能是他们研究的例数较少。但是Saigusa等[14]和Zhang等[15]的研究结果表明,Oct4与肿瘤分化、分期、复发和预后相关,与我们的结果一致。Saigusa等[14]的研究结果表明,Oct4的表达可以预测术前接受放化疗直肠癌患者远处复发和不良预后。Oct4的表达水平在正常上皮(卵巢上皮和输卵管上皮)、良性和交界性囊腺瘤以及浆膜下卵巢癌逐渐增加,Oct4高表达与浆膜下腺癌FIGO分期和组织学分级相关,Oct4的表达参与了浆膜下卵巢癌的发生、发展,有可能成为诊断和预测浆膜下卵巢癌的标记物[15]。
综上所述,Oct4在胃癌分化及浸润转移过程中起重要作用,并与胃癌患者的预后密切相关,理论上可作为胃癌诊断和预后判断的分子标记物。
[1]詹文华,韩方海.我国胃癌外科治疗的现状和思考[J].实用肿瘤杂志, 2008,23(8):91-93.
[2]Nichols J,Zevnik B,Anastassiadis K,et al.Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4[J].Cell,1998,95(3):379-391.
[3]Looijenga L H,Stoop H,de Leeuw H P,et al.POU5F1(OCT3/4) identifies cells with pluripotent potential in human germ cell tumors[J].Cancer Res,2003,63(9):2244-2250.
[4]Fukuoka J,Fujii T,Shih J H,et al.Chromatin remodeling factors and BRM/BRG1 expression as prognostic indicators in nonsmall cell lung cancer[J].Clin Cancer Res,2004,10:4314.
[5]Cheng L,Sung M T,Cossu-Rocca P,et al.OCT4:biological functions and clinical applications as a marker of germ cell neoplasia[J].J Pathol,2007,211(1):1-9.
[6]Tai M H,Chang C C,Kiupel M.Oct4 expression in adult human stem cells:evidence in support of the stem cell theory of carcinogenesis[J].J Pathol,2005,26(2):495-502.
[7]Okamoto K,Okazawa H,Okuda A,et al.A novel octamer binding transcription factor is differentially expressed in mouse embryonic cells[J].Cell,1990,60(3):461-472.
[8]Wen J,Park J Y,Park K H,et al.Oct4 and Nanog expression is associated with early stages of pancreatic carcinogenesis[J]. Pancreas,2010,39(5):622-626.
[9]Hochedlinger K,Yamada Y,Beard C,et al.Ectopic expression of Oct-4 blocks progenitor-cell differentiation and causes dysplasia in epithelial tissues[J].Cell,2005,121(3):465-477.
[10]Ugolkov A V,Eisengart L J,Luan C,et al.Expression analysis of putative stem cell markers in human benign and malignant prostate[J].Prostate,2011,71(1):18-25.
[11]Huang P,Qiu J,Li B,et al.Role of Sox2 and Oct4 in predicting survival of hepatocellular carcinoma patients after hepatectomy [J].Clin Biochem,2011,44(8-9):582-589.
[12]Xu K,Zhu Z,Zeng F.Expression and significance of Oct4 in bladder cancer[J].J Huazhong Univ Sci Technolog Med Sci, 2007,27(6):675-677.
[13]Chen Z,Xu W R,Qian H,et al.Oct4,a novel marker for human gastric cancer[J].J Surg Oncol,2009,99(7):414-419.
[14]Saigusa S,Tanaka K,Toiyama Y,et al Correlation of CD133, OCT4,and SOX2 in rectal cancer and their association with distant recurrence after chemoradiotherapy[J].Ann Surg Oncol,2009,16(12):3488-3498.
[15]Zhang J,Li Y L,Zhou C Y,et al.Expression of octamer-4 in serous and mucinous ovarian carcinoma[J].J Clin Pathol,2010, 63(10):879-883.
Expression of Oct4 in gastric cancer and its clinicopathological significance
WANG Kewei,WANG Yuanyu,YE Zaiyuan.Department
of Surgery,Zhejiang Provincial People’s Hospital,Hangzhou 310014,China
【 Abstract】 Objective To investigate the expression of Octamer-4(Oct4)in gastric cancer and its relationship with tumor invasion,metastasis and prognosis. Methods Immunohistochemistry was used to analyze the expression of Oct4 in 206 cases of gastric cancer. Results Oct4 protein was detected in 75.2% (155/206)of gastric cancer cases,including 61.17%(126/206) with high expression;while Oct4 was detected in 32.5%(13/40)non-cancerous mucosa,and was expressed in low levels.Compared to non-cancerous tissue the Oct4 expression was higher in gastric cancer tissue(P<0.05).The expression of Oct4 was correlated with histological differentiation,depth of invasion,lymph node metastasis,distant metastasis and TNM stage of gastric cancer.In stages I,II and III cancer,the 5-year survival rate of patients with a high expression of Oct4 was significantly lower than those with low expression.In stage IV,Oct4 expression was not correlate with the 5 year survival rate of patients.Multivariate analysis suggested that lymph node metastasis,distant metastasis,TNM stage,and up-regulation of Oct4 expression were independent prognostic indicators for the disease. Conclusion Expression of Oct4 in gastric cancer is significantly associated with lymph node metastasis,distant metastasis and poor prognosis.Oct4 may be an useful markers for progression and prognosis of the cancer.
Gastric carcinoma Oct4 Progression Prognosis
2011-12-02)
(本文编辑:沈叔洪)
310014 杭州,浙江省人民医院肝胆胰外科
王克畏,E-mail:wangkewei560818@126.com
