术前动脉化疗栓塞对膀胱癌细胞增殖和凋亡、血管生成的影响
2013-04-18王荣江石麒麟赵红星邵四海郑银元陈煜
王荣江 石麒麟 赵红星 邵四海 郑银元 陈煜
术前动脉化疗栓塞对膀胱癌细胞增殖和凋亡、血管生成的影响
王荣江 石麒麟 赵红星 邵四海 郑银元 陈煜
目的 探讨术前动脉化疗栓塞对膀胱癌细胞增殖和凋亡及肿瘤血管生成相互关系的影响及临床意义。 方法 分别选取术前行动脉化疗栓塞及同期单纯手术治疗的膀胱癌患者50例(观察组)、30例(对照组),采用EliVision二步法检测Ki-67的表达情况,细胞凋亡检测应用DNA末端标记法(Tunel法),计算凋亡指数(AI)、增殖指数(LI)和微血管密度计数(MVD)。比较两组患者的3年生存率和复发率。分析观察组患者化疗栓塞前后AI、LI、MVD的变化及其与患者预后的关系。结果 两组患者3年生存率的差异无统计学意义(P>0.05),观察组3年复发率显著低于对照组(P<0.01)。观察组患者栓塞后MVD及LI显著下降、AI显著升高(均P<0.01),其中高分级、浸润性及初发患者栓塞后MVD及LI明显下降、AI显著升高,复发患者仅MVD明显下降,差异均有统计学意义(P<0.05或0.01)。AI与LI、MVD呈负相关(P<0.01),LI与MVD呈正相关(P<0.01)。观察组中复发与未复发者栓塞前后MVD的差异均有统计学意义(均P<0.05),未复发者栓塞后LI显著下降、AI显著升高(P<0.01);生存者栓塞后MVD、LI明显下降、AI显著升高,差异均有统计学意义(P<0.05或0.01)。 结论 细胞的增殖和凋亡状况、微血管密度可作为膀胱癌的预后评估指标。术前动脉化疗栓塞可以明显降低膀胱癌组织的LI和MVD,增高AI,调节膀胱癌的分化程度,降低复发率。
化疗栓塞 膀胱癌 凋亡指数 增殖指数 微血管密度
膀胱癌生物学行为复杂多变,突出表现为易复发、多发、浸润和转移。已有的研究表明,细胞增殖失控和细胞凋亡障碍是膀胱癌发生、发展的重要原因。肿瘤发展过程中血管生成可以影响肿瘤细胞的凋亡和增殖状态。本研究通过观察术前动脉化疗栓塞的膀胱癌患者膀胱癌组织中增殖指数(LI)、凋亡指数(AI)和微血管密度(MVD)的表达,旨在探讨动脉化疗栓塞对膀胱癌细胞增殖和凋亡及肿瘤血管生成的影响及临床意义。
1 资料和方法
1.1 一般资料 选取2004-01—2010-06我院收治的膀胱癌患者50例(观察组),男35例,女15例,年龄38~78(60.98±9.05)岁;术前均行动脉栓塞化疗。根据国际抗癌联盟肿瘤浸润深度分期:非浸润性癌16例,浸润性癌34例。根据WHO 2004年膀胱尿路上皮癌恶性程度病理分级:低分级尿路上皮癌13例,高分级尿路上皮癌37例。淋巴转移5例,盆壁浸润3例,腹腔转移2例,肺转移2例;单发29例,多发21例,因复发入院者14例。术后经病理证实单纯尿路上皮细胞癌44例,尿路上皮细胞癌合并腺癌3例,合并鳞癌3例。同期另择单纯手术治疗的膀胱癌患者30例作为对照组,男20例,女10例,年龄29~80(59.62±10.13)岁。非浸润性癌8例,浸润性癌22例。低分级尿路上皮癌7例,高分级尿路上皮癌23例。淋巴转移2例,盆壁浸润1例,腹腔转移0例,肺转移2例;单发16例,多发14例,因复发入院者7例。术后经病理证实单纯尿路上皮细胞癌27例,尿路上皮细胞癌合并腺癌2例,合并鳞癌1例。两组患者性别、年龄、浸润深度、病理分级及转移、合并等情况的差异均无统计学意义(均P>0.05)。
1.2 方法
1.2.1 动脉化疗栓塞 采用Seldinger技术,局麻下经皮穿刺,用5~6Fcobra导管选择一侧股动脉进路至髂内动脉,先行盆腔动脉造影明确肿瘤部位及膀胱动脉供血情况,再分别超选择性至膀胱动脉至肿瘤区域主要供血动脉分支,了解肿瘤血管的形态和走向,结合术前膀胱镜示肿瘤位置,放置导管位置一般超选至膀胱动脉口,给予丝裂霉素20mg或羟喜树碱10mg联合顺铂60mg药物灌注+明胶海绵颗粒栓塞治疗1次。化疗栓塞后7d行经尿道膀胱肿瘤电切或膀胱部分切除术。
1.2.2 标本制备及检测 观察组患者化疗栓塞前膀胱镜检查所取肿瘤标本及化疗栓塞后手术标本,常规经10%中性甲醛溶液固定,石蜡包埋。Ki-67检测:选取代表性蜡块连续4μm切片,采用EliVision二步法行免疫组化染色,使用鼠抗人Ki-67单克隆抗体、鼠抗人CD34单克隆抗体,参照试剂盒说明书操作;EliVision试剂盒及相应抗体均购自福州迈新生物技术有限公司,以PBS代替一抗作阴性对照,以已知阳性切片作为阳性对照。细胞凋亡检测应用DNA末端标记法(Tunel法)。
1.3 判定标准 LI判定标准:以肿瘤细胞膜或细胞核有棕色颗粒着色为阳性标记,计数随意5个400倍视野的癌巢区阳性细胞数,LI=(Ki-67阳性细胞数/观察细胞数)×100%。MVD判定标准:肿瘤组织及其邻近间质内,胞膜或胞质内出现棕黄色颗粒的内皮细胞或内皮细胞簇即被认为是单个微血管。MVD参照Weidner等[1]报道的方法,先在40倍光学显微镜下扫描,选取肿瘤组织内微血管高度密集区,即“热点”,然后在400倍视野下计数肿瘤内的微血管的数目,记录3个视野中的微血管数目并取其平均数。AI判定标准:细胞核中出现棕褐色颗粒者为阳性细胞,即凋亡细胞。随机选择5个400倍视野并计数1 000个肿瘤细胞,记录凋亡细胞数,其中阳性细胞所占百分比即为AI,AI=(凋亡细胞数/1000)× 100%。
1.4 观察指标 观察化疗栓塞前后肿瘤细胞增殖和凋亡、MVD表达情况及术后患者生存率和复发率,分析免疫组化结果与病理分级、分期及预后的相关性。
1.5 统计学处理 采用SPSS10.0统计软件,计量资料均以表示,栓塞化疗前后的比较采用t检验,组间率的比较采用χ2检验,相关性采用Pearson相关性分析。
2 结果
2.1 两组患者3年生存率及复发率的比较 对照组3年生存率为83.3%(25/30),观察组为88.0%(44/50),差异无统计学意义(P>0.05)。对照组1、2、3年复发率分别为10.0%(3/30)、13.3%(4/30)、30%(9/30),观察组分别为8.0%(4/50)、4.0%(2/50)、6.0%(3/50),观察组3年复发率显著低于对照组(P<0.01)。
2.2 观察组患者化疗栓塞前后膀胱癌组织的比较 见图1~6。

图 1 栓塞前AI较低(Tunel法,×400)
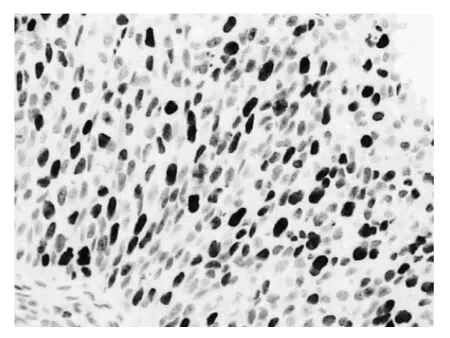
图2 栓塞前Ki-67表达较强(EliVision二步法,×400)
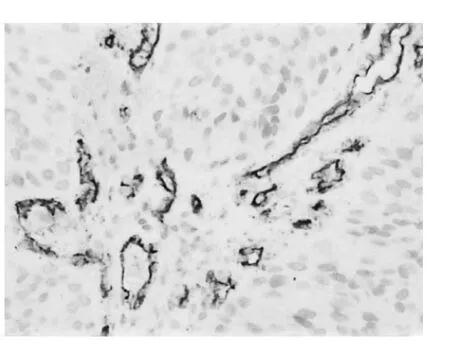
图3 栓塞前MVD较高(EliV-ision二步法,×400)
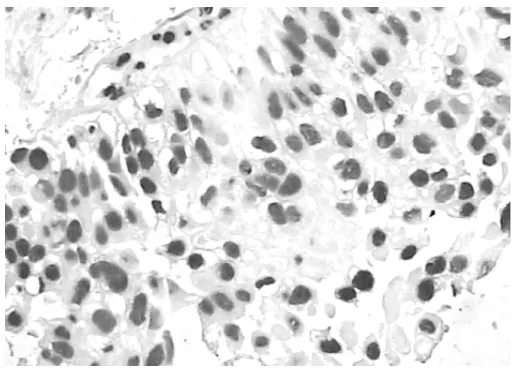
图 4 栓塞后 AI升高(Tunel法,×400)

图5 栓塞后Ki-67表达减弱(EliVision二步法,×400)
由图1~6可见,化疗栓塞后MVD、Ki-67表达强度下降,AI明显升高。
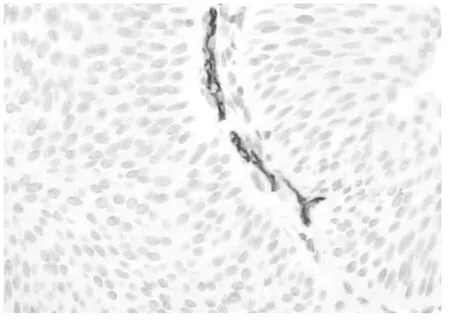
图6 栓塞后MVD降低(EliVision二步法,×400)
2.3 观察组患者化疗栓塞前后膀胱癌组织MVD、AI、LI值的比较 见表1。
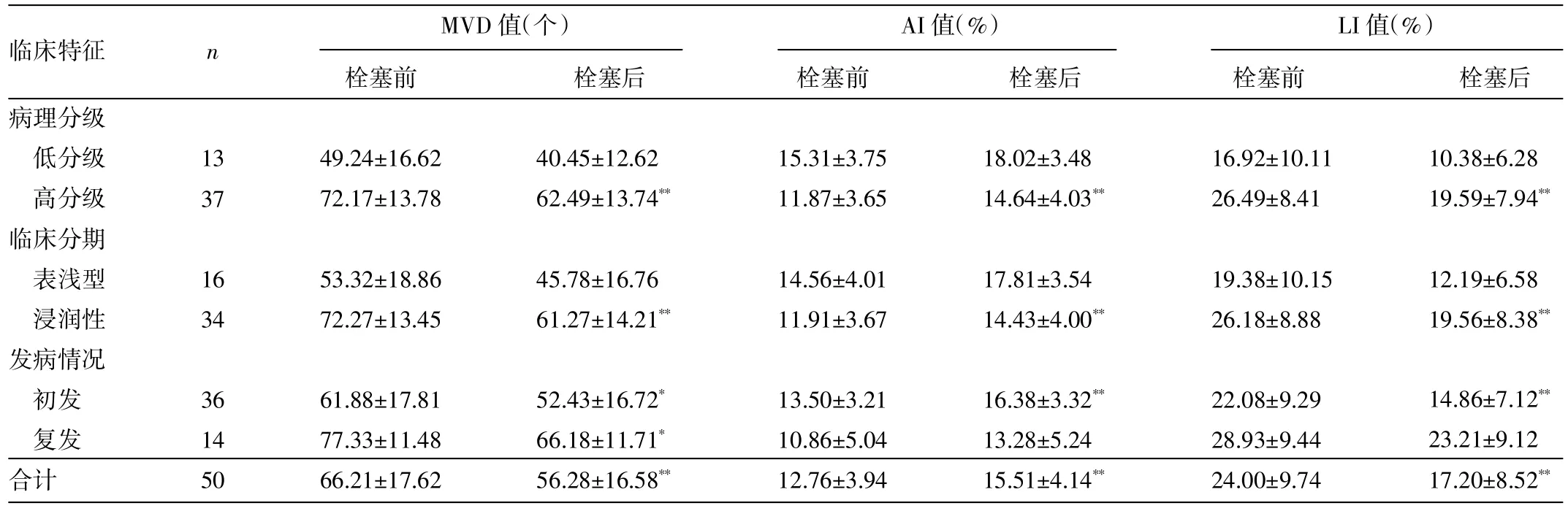
表1 观察组患者化疗栓塞前后膀胱癌组织MVD、AI、LI值的比较
由表1可见,观察组患者栓塞后MVD及LI值显著下降、AI显著升高,差异均有统计学意义(均P<0.01)。其中高分级、浸润性及初发患者栓塞后MVD及LI值明显下降、AI显著升高,复发患者仅MVD值明显下降,差异均有统计学意义(P<0.05或0.01)。Pearson相关性分析显示,AI与LI、MVD呈负相关(P<0.01),LI与MVD呈正相关(P<0.01)。
2.4 MVD、AI、LI值与栓塞后肿瘤复发和生存的关系
观察组患者随访6~78个月,平均19.8个月。动脉化疗栓塞前后MVD、AI、LI表达与患者预后和生存的关系见表2~3。

表2 MVD、AI、LI值与患者预后的关系

表3 MVD、AI、LI值与患者生存的关系
由表2~3可见,复发与未复发者栓塞前后MVD值 的差异均有统计学意义(均P<0.05),复发者栓塞前后AI、LI值的差异均无统计学意义(均P>0.05),而未复发者栓塞后LI值显著下降、AI值显著升高,差异均有统计学意义(均P<0.01);死亡者栓塞前后3项指标的差异均无统计学意义(均P>0.05),生存者栓塞后MVD、LI值明显下降、AI值显著升高,差异均有统计学意义(P<0.05或0.01)。
3 讨论
细胞增殖和凋亡状况是预测膀胱癌发展及预后的重要指标,研究肿瘤增殖和细胞凋亡是了解肿瘤和控制肿瘤的一条途径。细胞增殖失调和细胞凋亡障碍是膀胱癌恶性增生发生、发展的重要原因[1-2]。
1971 年,Folkman等[3]提出了“肿瘤的生长与转移依赖于肿瘤血管的形成”的概念。肿瘤的新生血管化程度与肿瘤恶性程度、侵袭性及其预后密切相关[4]。MVD是反映肿瘤微血管形成程度的标志,不仅可定量反映出膀胱肿瘤的血管生长情况,而且一定程度上可作为预测肿瘤浸润、转移、复发和判断预后的一项指标。肿瘤发展过程中微环境的改变可以影响到肿瘤细胞的凋亡和增殖状态[5],而血管生成正是微环境改变的重要表现形式之一。
膀胱癌细胞凋亡与肿瘤分级和分期呈负相关,AI是衡量组织中细胞凋亡发生程度的一项指标。细胞凋亡多者,说明肿瘤在各种因素的作用下,其生长繁殖受到限制,肿瘤的恶性程度低,因此预后较好。相反,细胞凋亡少则说明肿瘤受限制的程度差,肿瘤恶性程度高,患者预后较差[6]。肿瘤LI的检测对于判断肿瘤的恶性程度、评估预后及选择适当的治疗措施意义重大。Ki-67是与增殖细胞相关的核抗原,为细胞增殖的一种标记,其表达水平不仅能客观反映膀胱癌的增殖活性,并能估计肿瘤的浸润、转移潜能,Ki-67的阳性表达与肿瘤恶性程度正相关,表达越高,肿瘤增生活跃,复发的可能性越高。因此检测Ki-67在肿瘤中的表达强度,可以评估肿瘤细胞的生物活性并提供肿瘤演变的信息[7-8]。
本研究发现,膀胱肿瘤中微血管的形成与肿瘤细胞的增殖活性及其AI明显相关,AI与LI、MVD呈负相关,LI与MVD呈正相关。本组表浅性肿瘤的AI显著高于浸润性肿瘤,而浸润性肿瘤的MVD显著高于表浅性肿瘤,表浅肿瘤处于血管形成前期时以细胞凋亡为主,以抵消细胞的过度增生,使病变保持相对的静止状态。一旦进入血管期,新生血管形成,血管内皮细胞及宿主的良性细胞产生的各种生长因子通过新生血管源源不断运至肿瘤细胞,同时改善了肿瘤细胞的缺氧状态,致使细胞凋亡减少、细胞增殖,这也是膀胱癌发生、发展的原因之一[9]。
膀胱癌术前超选择性肿瘤动脉化疗栓塞,切断了肿瘤的血供,造成癌细胞缺血缺氧,减低肿瘤细胞活力,加快其坏死[10],显著提高肿瘤局部及盆腔区域的初始抗癌药物浓度;化疗药物发挥细胞毒作用都与诱导细胞凋亡和抵制细胞增殖有关。同时,抑制肿瘤新生血管生成及增殖细胞核抗原下降,诱导促凋亡基因表达,使膀胱癌细胞发生凋亡,增殖抑制;有遏制癌细胞进一步分化、浸润和转移作用[11-12]。本研究结果显示,动脉化疗栓塞后肿瘤缩小,表面均有组织的不同程度坏死,术野清晰,术中基本无出血,3年复发率明显降低。
化疗栓塞后MVD、LI明显下降,AI升高,前后差异有统计学意义。化疗栓塞后MVD、LI随着肿瘤的病理分级、临床分期的升高而降低,AI随着病理分级的增高而增高,化疗栓塞前后低分级和非浸润性膀胱癌组织中阳性表达水平比较,差异均无统计学意义;而高分级和浸润性膀胱癌组织中阳性表达水平差异均有统计学意义。AI、LI在初发膀胱癌者栓塞前后有统计学意义,在复发膀胱癌中无统计学意义,MVD在初发和复发膀胱癌栓塞前后下降均有统计学意义。以上结论均说明动脉化疗栓塞后肿瘤组织内的血管减少,肿瘤生长受限,甚至因缺血而使肿瘤坏死,还可通过诱导肿瘤细胞凋亡,抑制细胞增殖达到肿瘤消失或缩小的目的。MVD、AI、LI与栓塞后肿瘤复发率和患者生存率有明显的相关性,MVD、LI与病死率和复发率呈正相关,AI则呈负相关。
综上所述,术前动脉化疗的抗肿瘤效应与诱导细胞凋亡和抑制细胞增殖密切相关,可以明显地降低高分级和浸润性膀胱癌组织的LI和MVD值,增高细胞凋亡率,但对低分级和非浸润性无明显影响,这能否作为术前动脉化疗适应证之一尚有待进一步证实,但对于选择适合术前动脉化疗患者具有一定指导意义,同时术前动脉化疗具有降低术后复发率的优点。
[1]郭晓华,米振国.凋亡抑制基因及PCNA在膀胱移行细胞癌中表达的意义[J].临床医药实践杂志,2006,15(3):172-175.
[2]McKnightJJ,GrayS B,O'KaneHF,et al.Apoptosis and chemotherapy for bladder cancer[J].J Urol,2005,173(3):683-690.
[3]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[4]Li C,Guo B,Bernabeu C,et al.Angiogenesis in breast cancer:the role of transforming growth factor beta and CD105[J].Microsc Res Tech,2001,52(4):437-449.
[5] Elfiky A A,Rosenberg J E.Targeting angiogenesis in bladder cancer[J].Curr Oncol Rep,2009,11(3):244-249.
[6]杨承纲,张丽娟,陈芸.细胞凋亡在膀胱移行细胞癌中的预后价值[J].实用医技杂志,2006,13(19):3337-3338.
[7]Sanchez-Carbayo M,Socci N D,Lozano J J,et al.Gene discovery in bladder cancer progression using cDNA microarrays[J].Am J Pathol,2003,163(2):505-516.
[8]Lopez-Beltran A,Luque R J,Alvarez-Kindelan J,et al.Prognostic factors in stage T1 grade 3 bladder cancer survival:the role of G1-S modulators(p53,p21Waf1,p27kip1,Cyclin D1,and Cyclin D3)and proliferation index(ki67-MIB1)[J].Eur Urol,2004,45(5): 606-612.
[9]刘贤奎,孔垂泽,王平,等.膀胱癌肿瘤血管生成与肿瘤细胞凋亡和增殖的关系[J].中国医科大学学报,2004,33(5):438-439.
[10]王荣江,邵四海,赵红星,等.化疗栓塞对膀胱肿瘤新生血管生成及血管内皮细胞生长因子表达的影响[J].中华泌尿外科杂志,2008,29 (7):470-474.
[11]Koumenis C,Alarcon R,Hammond E,et al.Regulation of P53 by hypoxia:dissociation of transcriotional repression and apoptosis from P53-dependent transactivation[J].Mol cell boil,2001,21 (4):1297-1310.
[12]Rudinger H A,Clacient P A.Tumor necrosis factor alpha,but not FAS,mediates hepatocellular apoptosis in the murine ischemic liver[J].Gastroeterology,2002,122(1):202-210.
Cell proliferation,apoptosis and neovascularization of bladder cancer after arterial chemoembolization
Chemoembolization Bladder cancer Apoptosis index Proliferation index Microvessel density
2012-05-07)
(本文编辑:欧阳卿)
313000 湖州师范学院附属第一医院、湖州市第一人民医院泌尿外科(王荣江、邵四海、陈煜),病理科(石麒麟),放射介入科(赵红星、郑银元)
【 Abstract】Objective To investigate the cell proliferation,apoptosis and tumor angiogenesis of bladder cancer after transcatherter arterial chemoembolization(TACE). Methods The apoptosis index(AI),proliferation index(LI)and microvessel density(MVD)of cancer tissue were examined by immunohistochemistry in 50 bladder cancer patients before and after chemoembolization (TACE group)and in 30 patients with surgical treatment(control group).The 3-y survival rates and recurrence rates were compared between two groups.The correlation of cancer cell proliferation,apoptosis and MVD before and after chemoembolization with postoperative survival and the recurrence was analyzed. Results There was no significant difference in 3-y survival rate between two groups(P>0.05).The 3-year recurrence rate in TACE group was significantly lower than that in control group(P<0.01).AI was increased significantly after chemoembolization,while MVD and LI were decreased significantly(P<0.01), especially for the high grade,invasive or incipient patients.But the relapsing patients had only decline of MVD.AI was negatively correlated with MVD and LI(P<0.01),while LI was positively correlated with MVD(P<0.01).There was significant difference in MVD of cancer tissue between relapsed group and non-relapsed group both before and after chemoembolization.LI declined significantly,while AI increased significantly in non-relapsed group after chemoembolization(P<0.01). Conclusion The cancer cell proliferation,apoptosis and microvessel density may be used as indicators in assessing prognosis for bladder cancer.Preoperative chemoembolization can decrease LI and MVD and increase apoptosis rate in bladder cancer tissue,resulting in the decrease of recurrence rate.
