苯磺贝他斯汀与氯雷他定治疗过敏性鼻炎:多中心随机双盲临床试验
2013-04-09顾建青刘光辉
李 宏,顾建青,张 罗,程 雷,刘光辉,尹 佳
(中国医学科学院 北京协和医学院 北京协和医院变态反应科,北京 100730)
过敏性鼻炎是常见的过敏性疾病,全球普通人群患病率约为10%~20%。研究显示,过敏性鼻炎会显著影响患者的生活质量、学习表现和工作效率。在过敏性鼻炎发病机制中,组胺作为一种重要介质,在鼻痒、喷嚏、流涕和鼻塞等症状中起着关键作用。因此,包括《变应性鼻炎及其对哮喘的影响》(allergic rhinitis and its impact on asthma,ARIA)等世界众多国家和国际指南均推荐用组胺H1受体拮抗剂治疗过敏性鼻炎。非镇静类第二代抗组胺药由于具有嗜睡作用弱的特点,更适合作为治疗过敏性鼻炎的常用药物。苯磺贝他斯汀是一种选择性的组胺H1受体拮抗剂,属于第二代H1抗组胺药,主要特点是服用后起效迅速,不良反应如嗜睡等发生率低。苯磺贝他斯汀具有很强的组胺拮抗作用,对白三烯、血小板活化因子(platelet activating factor,PAF)等也有同样的拮抗作用,因此,其对嗜酸粒细胞在炎性部位的浸润具有较强抑制作用。本试验采用多中心、随机、双盲、双模拟、平行对照研究的方法,通过与氯雷他定片进行比较,对田边三菱制药株式会社(日本)生产的苯磺贝他斯汀治疗过敏性鼻炎的疗效及安全性进行评价。
对象与方法
试验设计
采用多中心、随机、双盲、阳性对照、平行分组设计。
研究对象
病例选择:于2007年11月至2008年7月至各研究中心就诊的过敏性鼻炎患者,凡符合以下入选标准,且无任何一项排除标准,纳入本试验。过敏性鼻炎的诊断依照2001年世界卫生组织发表的ARIA[1]。
入选标准:(1)年龄18~65岁,男女不限;(2)符合过敏性鼻炎的诊断标准:病史:具有鼻痒、喷嚏、鼻分泌物和鼻塞4项症状中至少3项,常年性者在有症状的日子里症状每日累计达0.5~1 h以上。查体:鼻腔检查可见鼻黏膜苍白、水肿或充血。花粉症患者往往有明显的结膜充血、水肿,严重者眼睑肿胀。过敏原特异性诊断:采用ImmunoCAP系统检测过敏原血清sIgE≥2级;(3)过敏性鼻炎病程大于等于1年;(4)愿意接受治疗并签署知情同意书。
排除标准:(1)合并感染性副鼻窦炎,中耳炎,上、下呼吸道感染者;(2)合并过敏性哮喘者,最近5年有哮喘发作者;(3)非过敏性鼻炎患者(不能查出明确过敏原的患者);(4)鼻息肉或严重的鼻中隔偏曲者;(5)已知对H1受体拮抗剂或研究制剂的成分或类似成分过敏者;(6)氯雷他定停药时间小于4周;(7)阿司咪唑的停药时间小于6周,其他抗组胺药停药时间小于1周;(8)鼻吸入抗组胺药停药时间小于1周;(9)皮质激素滴鼻剂或喷鼻剂停药时间小于1周;(10)系统使用皮质类固醇停药时间小于4周;(11)正在使用大环内酯类抗生素,和或正在系统使用咪唑类抗真菌剂;(12)合并青光眼、尿潴留、前列腺肥大者;(13)器质性心脏病或心律失常者,心电图指标异常者;(14)合并严重肝、肾等器官疾病或恶性肿瘤患者,或有临床意义的肝肾功能异常的实验室检查结果;(15)妊娠、哺乳期妇女及近期准备生育的男女;(16)从事需注意力高度集中工作者,如驾驶员、高空作业者;(17)既往癫痫发作或者脑器质性病变以及有诱发癫痫发作可能的患者;(18)需要维持服用抗焦虑药,安定药及镇静药的患者;(19)选前90天参加过其他药物临床试验;(20)已知或怀疑患者不能遵守试验方案,或研究者认为不适合入选的其他情况。
剔除标准:(1)不符合入选标准或符合排除标准;(2)入选后未曾用药者;(3)无任何随访记录者。
试验用药
安慰剂:重量与氯雷他定片10 mg相同的安慰剂,规格为10 mg片,用胶囊包装,主要成分为药用辅料,田边三菱制药株式会社生产,产品批号070301,有效期至2010年1月。
用药方法
苯磺贝他斯汀组:早饭和晚饭后分别服用胶囊包装的苯磺贝他斯汀片10 mg。
氯雷他定组:早饭后服用胶囊包装的氯雷他定片10 mg,晚饭后服用安慰剂。
两组均连续用药14 d。
疗效评估
主要疗效指标:本试验的主要疗效指标为治疗2周后过敏性鼻炎总有效率。总有效率根据过敏性鼻炎症状积分下降指数(symptom score reducing index,SSRI)来计算。计算公式为SSRI=(治疗前积分-治疗后积分)治疗前积分。
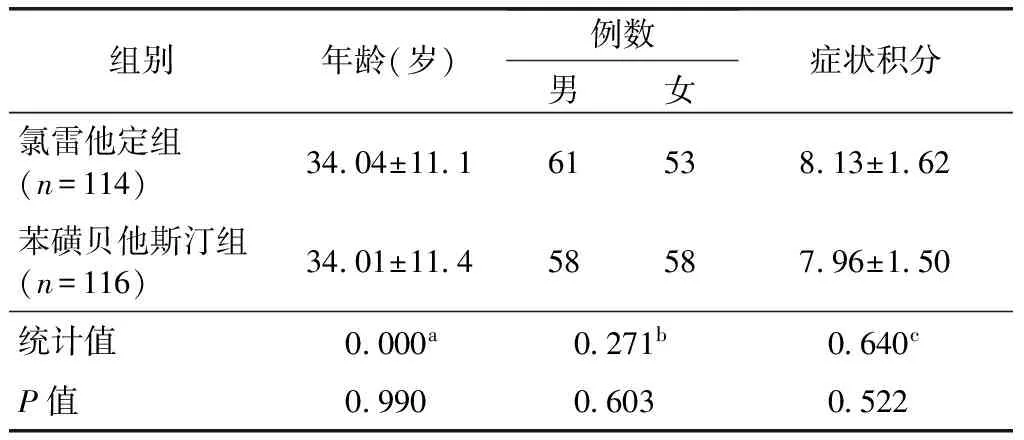
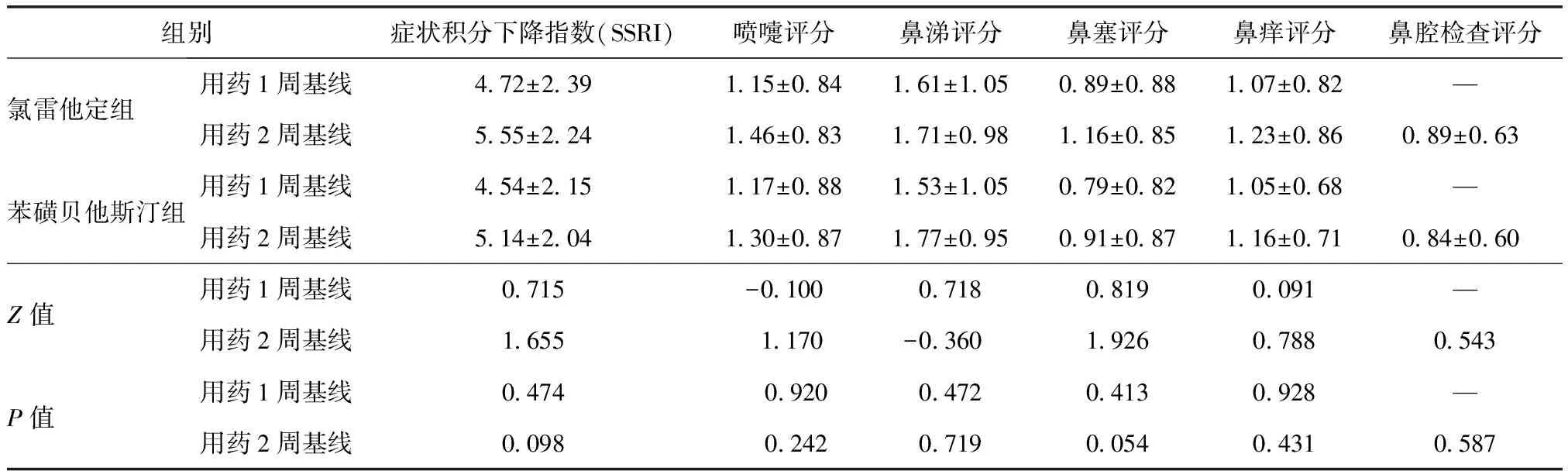
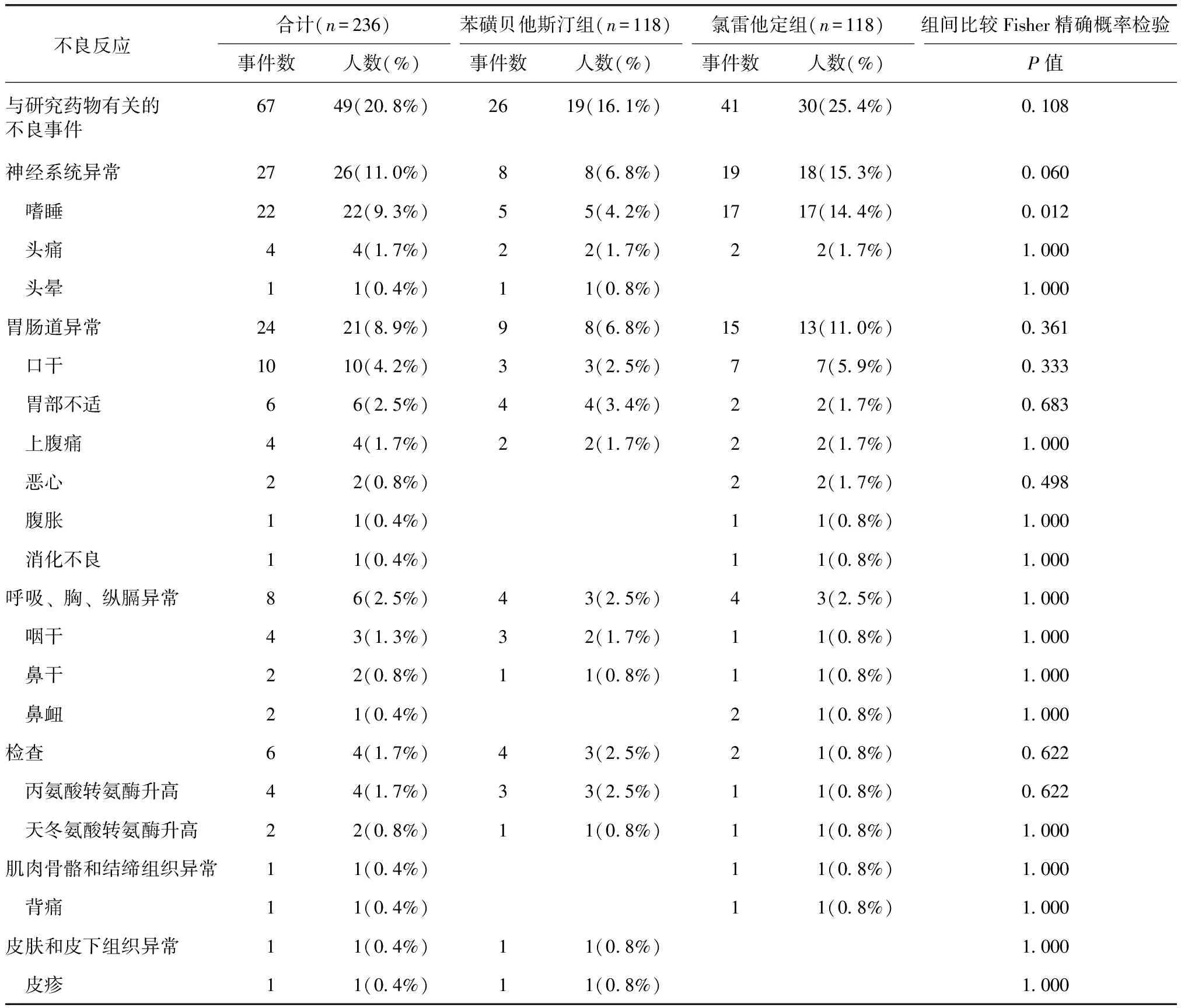
症状积分按4级评分法记录受试者喷嚏、鼻涕、鼻痒、鼻塞的情况(表1),上述4项评分相加即为症状积分,试验期间要求患者每日如实记录症状变化情况,根据症状严重程度进行评分。疗效判定按照以下4级标准进行:(1)显效为SSRI≥0.8;(2)良效为0.3≤SSRI<0.8;(3)微效为0 次要疗效指标:(1)用药1、2周后SSRI;(2)用药1、2周后喷嚏、鼻涕、鼻痒、鼻塞这4个症状评分分别较基线的下降值,计算公式:单个症状评分下降值=治疗前单个症状评分―治疗后单个症状评分;(3)用药2周后鼻腔检查评分较基线的下降值,分别于基线和治疗2周后对鼻腔进行检查,计算公式:鼻腔检查评分下降值=治疗前鼻腔检查评分―治疗后鼻腔检查症状评分(表2)。 表1 过敏性鼻炎症状评分标准Table 1 Criteria for symptoms of allergic rhinitis *1次连续喷嚏个数;**每日擤鼻次数 记录在治疗过程中患者出现的与治疗目的无关的各种不良事件,说明其程度、持续时间、是否需要处理以及转归等。对所有不良事件均按“肯定”、“很可能”、“可能”、“可疑”及“不可能”等5类进行分析,并将前3种定为药物的不良反应[2]。 测定用药前后患者的血、尿常规、肝肾功能、心电图等实验室检查。 用SAS 9.1.3版进行统计分析,两组间疗效比较采用两样本率的非劣效假设检验,显著性水平设定为0.025,单侧检验。次要疗效指标采用Wilxocon秩和检验分析两组差异。P≤0.05被认为所检验的差别具有统计学意义。安全性分析包括不良事件例数及百分比、实验室异常例数及百分比。用药后的主要和次要疗效指标对全分析数据集(full analysis set,FAS)进行分析,安全性分析对安全集(safety set,SS)进行分析。 本试验3个中心共入组240例,苯磺贝他斯汀组与氯雷他定组为1∶1。其中230例受试者的数据可进入FAS,苯磺贝他斯汀组为116例,氯雷他定组为114例,受试者未进入FAS的原因是未服药(或服药未知)(苯磺贝他斯汀组1例,氯雷他定组2例)和违反方案用药(苯磺贝他斯汀组3例,氯雷他定组4例)。236例受试者的数据可进入SS,其中苯磺贝他斯汀组118例,氯雷他定组118例,所有接受至少一剂试验药物并至少一次安全性评价的受试者,均将纳入SS。两组病例入组时的年龄、性别、总症状积分等均具有可比性(表3)。 表2 过敏性鼻炎鼻腔检查评分标准Table 2 Criteria for nasal cavity examination of allergic rhinitis 治疗2周后过敏性鼻炎总有效率:FAS中服用苯磺贝他斯汀的受试者的总有效率为91.4%,氯雷他定组为91.2%。两组间差异无统计学意义(P=0.984)(表4)。 用药1、2周后SSRI:用药1、2周后鼻涕、喷嚏、鼻塞、鼻痒评分较基线的下降值,以及用药2周后鼻腔检查评分较基线的下降值等6项次要疗效指标的组间比较差异,差异均无统计学意义,均P>0.05(表5)。 两组均未见与研究药物相关的严重不良事件。苯磺贝他斯汀组1人发生了妊娠事件,该事件按照严重不良事件的报告流程进行了报告。研究者在得知该例受试者发生妊娠后即终止了其试验,并在随后对该受试者采取了终止妊娠的措施。 236例受试者(SS)中,有49例发生了67例与研究药物有关的不良事件,发生率为20.8%。其中苯磺贝他斯汀组有19例发生了26件例与研究药物有关的不良事件,发生率为16.1%;氯雷他定组有30例发生了41例与研究药物有关的不良事件,发生率为25.4%。 67件与研究药物有关的不良事件中,头痛4件,头晕1件,嗜睡22件,口干10件,咽干4件,鼻干2件,鼻衄2件,胃部不适6件,上腹痛4件,腹胀1件,消化不良1件,恶心2件,皮疹1件,背痛1件,丙氨酸氨基转移酶升高4件,天冬氨酸氨基转移酶升高2件。按身体系统分,Fisher精确概率检验结果显示试验药物的与研究药物有关的嗜睡发生率低于对照药物,有统计学意义;其余各种类型的与研究药物有关的不良事件发生率的组间差别均无统计学意义均P>0.05(表6)。 表3全分析数据集一般资料分析 组别年龄(岁)例数男女症状积分氯雷他定组(n=114)34 04±11 161538 13±1 62苯磺贝他斯汀组(n=116)34 01±11 458587 96±1 50统计值0 000a0 271b0 640cP值0 9900 6030 522 a为F值,t检验;b为χ2值,卡方检验;c为Z值,Wilcoxon秩和检验 表4 用药2周后过敏性鼻炎疗效总有效率频数分析(全分析数据集)Table 4 Frequency analysis of total effective rate of anaphylactic rhinitis after two-week therapy [n(%)] 表5 次要疗效评价指标分析(全分析数据集)Table 5 Index analysis of secondary therapeutic evaluation 表6 试验中出现的药物相关不良反应Table 6 Adverse reactions associated with drugs for trial 实验室检查指标两组患者治疗前后的血常规、尿常规、肝肾功能、心电图等检查结果均无明显变化或仅有轻度改变但无临床意义。 本试验经国家食品药品监督管理局批准,由北京协和医院牵头北京同仁医院、南京医科大学第一附属医院和华中科技大学同济医学院附属同济医院共同完成。通过检索中文数据库(万方数据库、中国知网数据库),发现国内尚无苯磺贝他斯汀临床试验报告。本试验始于2007年9月,2008年7月结束。该试验为多中心、随机、双盲、双模拟、平行对照临床试验,苯磺贝他斯汀片与氯雷他定片对照,评价其治疗过敏性鼻炎的疗效和安全性。在对照药的选择方面,由于其他类似产品如依巴斯汀、咪唑斯汀等在临床应用并不广泛,因此本试验选择同为抗H1组织胺受体拮抗剂的氯雷他定片做为对照药,该药同为长效三环类抗组胺药物,在中国上市多年,疗效肯定,应用最广泛,治疗过敏性鼻炎效果被广泛认可。两种药物均以乙胺基团X-CH2-CH2-N作为母核,均为特异选择性与组胺靶细胞上的H1受体结合,阻断组胺H1受体而发挥抗组胺作用,具有相似的作用机制。 本试验四个中心(中国医学科学院 中国协和医科大学 北京协和医院 变态反应科;北京同仁医院北京市耳鼻喉科研究所;江苏省人民医院耳鼻喉科;武汉同济医院过敏反应科)共计随机入组240例受试者,230例进入FAS,195例进入符合方案集(PPS),其中苯磺贝他斯汀组96例。从主要疗效指标来看,无论是PPS或FAS,用药2周后,过敏性鼻炎的治疗疗效显示,苯磺贝他斯汀组与氯雷他定组间疗效无差异。治疗后,苯磺贝他斯汀的受试者的总有效率为91.4%,氯雷他定组为91.2%,P=0.984。提示苯磺贝他斯汀治疗过敏性鼻炎有效。 苯磺贝他斯汀最早于2000年10月获准在日本上市,用于治疗过敏性鼻炎。基础研究提示苯磺贝他斯汀有很强的I型过敏反应(PCA反应,过敏性休克)抑制作用[2],组胺的拮抗作用及对白三烯、血小板活化因子等的拮抗作用,可抑制白介素5生成[3]。动物试验显示,苯磺贝他斯汀具有抑制呼吸道嗜酸粒细胞浸润,降低外周血嗜酸粒细胞数量的作用[4]。苯磺贝他斯汀不易透过血脑屏障,几乎无中枢镇静及抗M胆碱作用。本试验结果进一步证实苯磺贝他斯汀对中枢镇静作用极弱,且低于氯雷他定的中枢镇静作用。本试验显示苯磺贝他斯汀组嗜睡的发生率为4.2%;氯雷他定组为14.4%,P=0.012。两组差异有统计学意义。 药代动力学方面[5],在人体血浆及尿中未发现苯磺贝他斯汀的代谢物,用药后24小时内,75~90%以药物原形贝他斯汀从尿中排泄。目前,该药主要在日本、韩国销售。国外临床试验和药品上市后反馈的信息显示,常见的不良反应主要有困倦和消化系统症状,一般为轻度,时间较短,停药后都可消失。本试验安全性结果显示,苯磺贝他斯汀组与氯雷他定组均有良好的安全性,药物不良反应总发生率分别为16.1%,25.4%。苯磺贝他斯汀组主要不良反应是嗜睡和消化系统症状,程度轻,时间短,停药后即消失。本次试验未发生与研究药物有关的严重不良事件。 苯磺贝他斯汀治疗过敏性鼻炎有效,不良反应发生率低。其疗效及安全性与氯雷他定相似,并且苯磺贝他斯汀嗜睡的发生率低于氯雷他定。 [1]Bousquet J, Van Cauwenberge P, Khaltaev N. Allergic rhinitis and its impact on asthma[J]. J Allergy Clin Immunol, 2001, 108:147-334. [2]Yato N, Murata T, Saito N, et al. Anti-allergic activity of bepotastine besilate (TAU-284), a new anti-allergic drug[J]. Nippon Yakurigaku Zasshi, 1997, 110:19-29 [3]Kaminuma O, Ogawa K, Kikkawa H, et al. A novel anti-allergic drug, bepotastine besilate, suppresses interleukin-5 production by human peripheral blood mononuclear cells[J]. Biol Pharm Bull, 1998, 21:411-413. [4]Sakai A, Kikuchi M, Yato N, et al. Inhibitory effect of bepotastine besilate on antigen-induced airway eosinophil infiltration and peripheral blood eosinophilia in mice[J]. Arzneimittelforschung, 1997, 47:954-958. [5]Williams JI, Gow JA, Klier SM, et al. Non-clinical pharmacology, pharmacokinetics, and safety findings for the antihistamine bepotastine besilate[J]. Curr Med Res Opin, 2010, 26:2329-2338.
安全性评估
统计学分析
结 果
一般资料

疗效分析
安全性评价
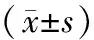

讨 论
