沙利度胺治疗炎症性肠病7例疗效
2013-04-09李明玮李沛霖
李明玮,罗 雯,李 扬,李沛霖,李 泉,王 芳
(首都医科大学附属复兴医院风湿免疫科,北京 100038)
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),是一组病因不明的慢性非特异性肠道炎症性疾病。前者多为大肠黏膜慢性炎性反应和溃疡性病变,主要累及结肠和末端回肠。后者为全胃肠道慢性肉芽肿性疾病,好发于回盲部和小肠。尽管治疗IBD的方案有许多,但仍存在部分患者对治疗方案反应差、耐受性差、出现药物依赖或严重不良反应等问题。因此,目前迫切需要探索新的治疗方法,以应对难治性IBD。
迄今为止,已知许多细胞因子特别是肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在IBD的发生过程中发挥着关键作用[1],在IBD患者的血清和肠道黏膜中,TNF-α水平均升高,其可反映疾病活动程度[2]。TNF-α抗体对CD具有疗效,如英夫利昔单抗、阿达木单抗和certolizumab,这些抗TNF-α单克隆抗体对于诱导和维持中度至重度CD处于缓解期是有效的[3]。然而,患者可能会对这些生物制剂产生抗体,造成耐药性或过敏反应。此外,这类药物还必须通过静脉或皮下注射给药,也有可能增加不良反应的发生风险。因此,没有抗体形成风险的口服药物对治疗非常重要。
沙利度胺作为一种口服免疫抑制剂,具有抗TNF-α的作用。近年来,沙利度胺用于治疗与TNF-α相关的多种疾病取得了良好的疗效。到目前为止,该药疗效显著的疾病包括类风湿关节炎、贝赫切特综合征[4]、多发性骨髓瘤干细胞移植后维持治疗[5]、慢性移植物抗宿主病[6]及人类免疫缺陷病毒消耗综合征[7]。但用于治疗IBD的报道较少,本文将沙利度胺治疗7例IBD患者的疗效进行单中心开放性研究并报道如下。
对象和方法
病例选择
入选标准:2009年1月至2011年6月首都医科大学附属复兴医院就诊并经临床、结肠镜、X线钡餐及组织学检查诊断为IBD的患者。合格受试者年龄18至70岁,诊断条件符合中华医学会消化病学分会炎症性肠病(IBD)协作组标准[8]。IBD患者均于用药前1周经病情评估,证实病情活动。采用国际IBD研究组织指数(international organization for the study of IBD,IOIBD)+血细胞沉降率(erythrocyte sedimentation rate,ESR)+C反应蛋白(C reactive protein,CRP)判断。IOIBD评分在3~7分之间,ESR及CRP水平异常,内镜评分≥2分,具有生育潜力的妇女需要有效控制生育。
主要排除标准:伴有其他严重疾病者;其他自身免疫性疾病患者;具有肠梗阻病史者;具有肠道狭窄症状者;具有直肠或结肠造瘘治疗史者;暴发性疾病或需要紧急手术者;使用全肠外营养的患者;具有恶性肿瘤病史者;曾经接受针对TNF治疗的患者;妊娠或哺乳期女性。
所有入组治疗的患者均符合人体观察伦理要求,经医院伦理委员会讨论同意后并签订知情同意书。
检测指标
基线资料:病史采集、体格检查、实验室检查(血及粪常规、肝肾功能、CRP、ESR)、妊娠测试(具有生育潜力的女性)、心电图、结肠镜、IOIBD评分。
治疗后2、4、8周检测:详细记录消化系统症状、体格检查、实验室检测(血及粪常规、肝肾功能、CRP、ESR)、IOIBD评分。严密监测任何不良事件。
治疗后12、24、48周检测:详细记录消化系统症状、体格检查、实验室检测(血及粪常规、肝肾功能、CRP、ESR)、结肠镜、IOIBD评分。严密监测任何不良事件。
治疗方法
所有受试患者停用所有免疫抑制剂,每晚口服沙利度胺(江苏常州制药厂生产)200 mg,糖皮质激素可继续按照原剂量应用或减量服用,疗程为24周。
评估方法
病情评估:缓解期为IOIBD为0~1分,ESR及CRP水平正常;活动期为IOIBD超过2分,ESR及CRP水平异常。
临床严重程度判定:UC患者腹泻每日4次以下,便血轻或无,无发热、脉搏加快或贫血,ESR水平正常者,判定为轻度;腹泻每日6次以上,明显黏液血便,体温>37.5℃,脉搏>90次min,血红蛋白<100 gL,ESR>30 mm1 h者,判定为重度;介于轻度和重度之间者为中度。CD患者无全身症状、腹部压痛、包块及梗阻者,判定为轻度;有明显腹痛、腹泻、全身症状及并发症者,判定为重度;介于轻度和重度之间为中度[8]。
内镜评分:根据2000年成都会议制定的标准进行判定[10]。UC患者内镜分级标准采用国内标准(Chinese grading system of ulcerative colitis,CGSUC)判断,1分(轻度):黏膜下血管透见消失,黏膜细颗粒状改变;2分(中度):黏膜表面发红、有小黄色点;黏膜增粗、糜烂、小溃疡;易出血,接触性出血;黏膜表面附着脓性分泌物;伴有其他活动性炎症;3分(重度):广泛范围溃疡,明显的自然出血。CD患者内镜分级标准分采用国内标准(Chinese grading system of Crohn’s disease,CGSCD)判断,1分(轻度):局部或多处红斑,脆性增加,无上皮损伤;2分(中度):阿弗他糜烂或表浅小溃疡;3分(重度):大溃疡或多处溃疡,有肠狭窄、瘘管、大出血并发症。
疗效评价:UC患者完全缓解为临床症状消失,结肠镜检查示黏膜大致正常;有效为临床症状基本消失,结肠镜检查示黏膜轻度炎性改变或假息肉形成;无效为经治疗后临床症状、内镜及病理检查结果均无改善。CD患者临床缓解为临床症状消失,X线或结肠镜检查发现炎性反应趋于稳定;有效为经治疗后临床症状减轻,X线或结肠镜检查发现炎性反应减轻;无效为经治疗后临床症状、X线、内镜及病理检查结果均无改善。
结 果
基线资料
入选7例患者,其中4例为UC,3例为CD。男4例,女3例;年龄29~66岁,平均44.3岁;病程 0~96个月,平均30.7个月。病情评估:IOIBD评分3~7分,平均5.5分,ESR及CRP水平均高于正常,病情处于活动期。临床严重程度评估:重度4例、中度3例。内镜评分为1~3分。7例中初治病例3例(2例UC,1例CD),4例为对常规治疗无效病例(2例UC,2例CD)。初治病例中,2例既往对磺胺类药物过敏,1例存在可疑结核感染。2例受试期间同时服用糖皮质激素(表1)。
疗效评价
治疗后4周,IOIBD评分4例(例1、例3、例4、例7)下降。治疗后12周,IOIBD评分7例均下降,2例(例4、例5)处于缓解期。治疗后24周,IOIBD评分7例均下降,4例(例3、例4、例5、例7)处于缓解期。
治疗48周后,IOIBD评分3例(例2、例3、例6)回升,例2因沙利度胺所致周围神经病变停药,再次使用原方案治疗,例3及例6于治疗后24周停药;3例(例1、例4、例5)处于缓解期,其中2例(例1、例5)坚持服用沙利度胺,例1联合泼尼松维持治疗,泼尼松逐渐减量至5 mgd,例5仅服用沙利度胺,例4于治疗后24周停药;1例(例7)失访(表2、图1)。
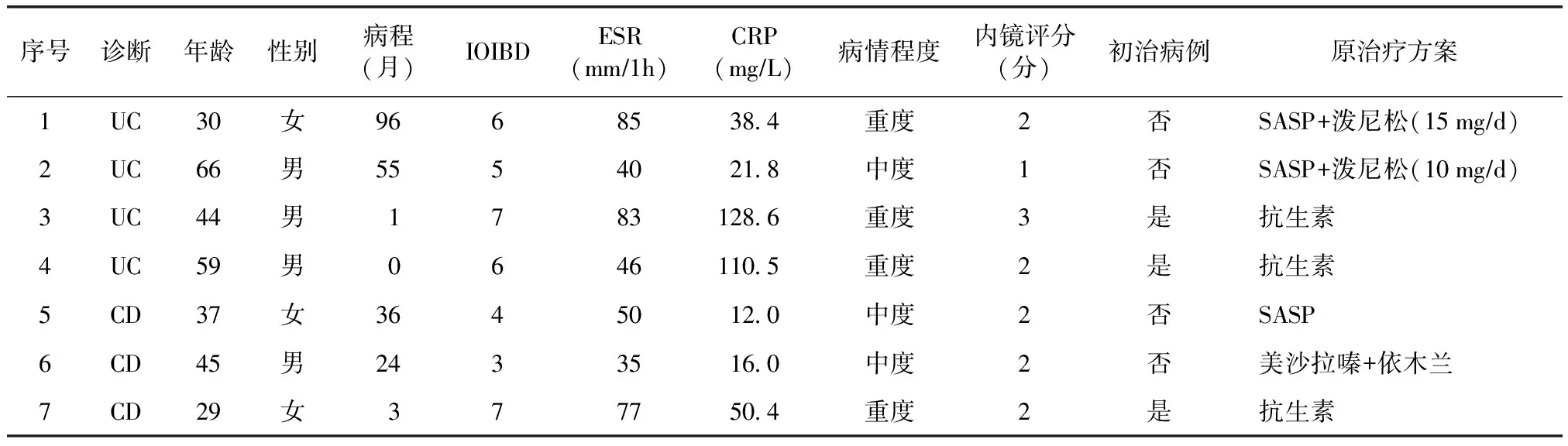
表1 7例受试者基线资料Table 1 Baseline data in 7 subjects
IOIBD:国际炎症性肠病研究组织指数;ESR:血细胞沉降率;CRP:C反应蛋白;UC:溃疡性结肠炎;CD:克罗恩病;SASP:柳氮磺吡啶
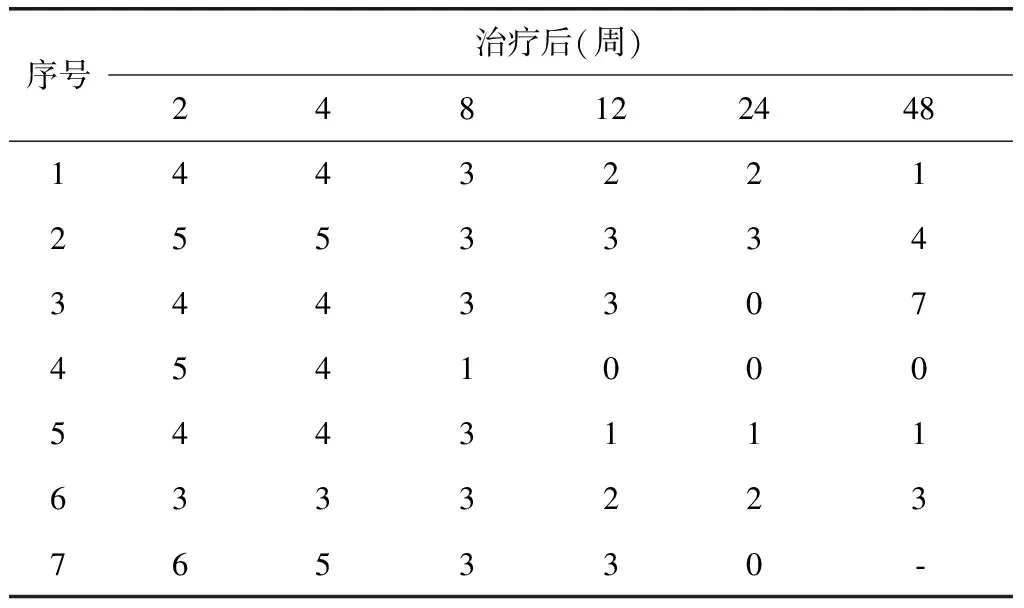
表2 7例受试者疗效评价-国际炎症性肠病研究组织指数评分Table 2 Evaluation of the curative effect of 7 subjects-IOIBD
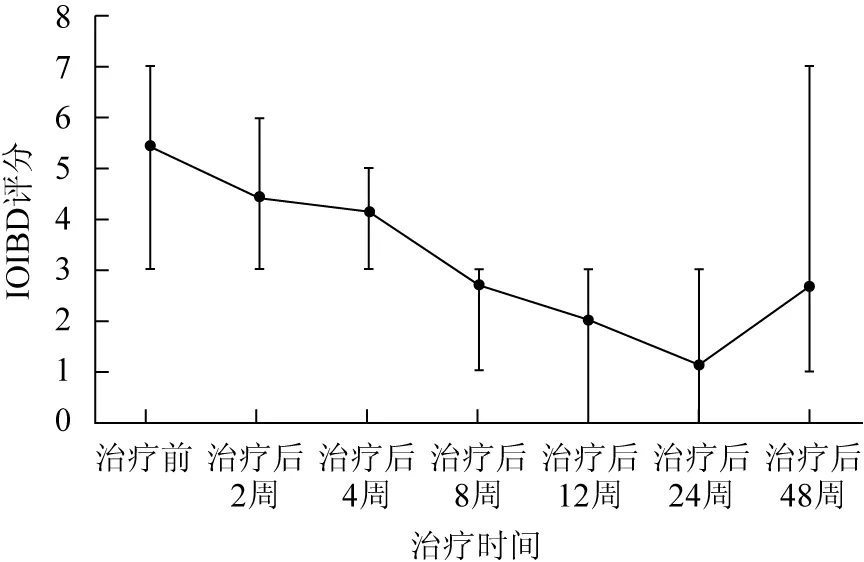
图17例受试者疗效-治疗时间曲线
Fig1Effect of treatment time curve of 7 subjects
IOIBD:国际炎症性肠病研究组织指数
炎性指标
治疗后4周,所有患者ESR及CRP水平均开始下降。治疗后12周,3例(例3、例4、例7)ESR及CRP水平恢复正常。治疗后24周,5例(例1、例3、例4、例5、例7)ESR及CRP水平恢复正常。治疗后48周,3例(例2、例3、例6)ESR或CRP水平出现异常;3例(例1、例4、例5)ESR及CRP水平处于正常;1例失访(例7)(表3、图2、3)。
内镜评估
治疗后12周,结肠镜检查结果示4例(例3、例4、例5、例7)镜下评分级别下调,其中1例(例4)达到缓解期结肠粘膜表现。治疗后24周,结肠镜检查结果示所有患者镜下评分级别下调,2例UC(例3、例4)和1例CD(例7)达到缓解期结肠黏膜表现。治疗后48周,3例(例2、例3、例6)评级上调;3例(例1、例4、例5)保持原有评级;1例(例7)失访(表4、图4、5)。
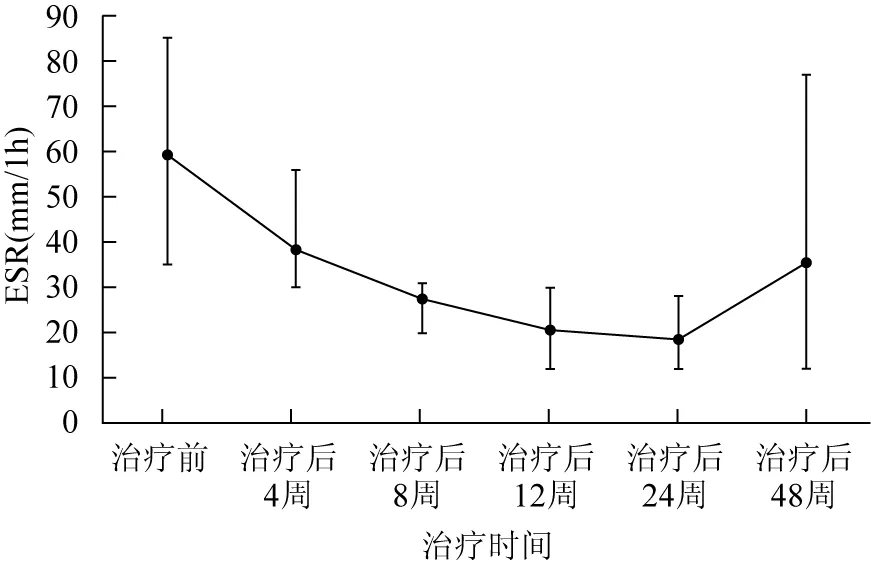
图27例受试者血细胞沉降率-治疗时间曲线
Fig2ESR-treatment time curve of 7 subjects
ESR:血细胞沉降率
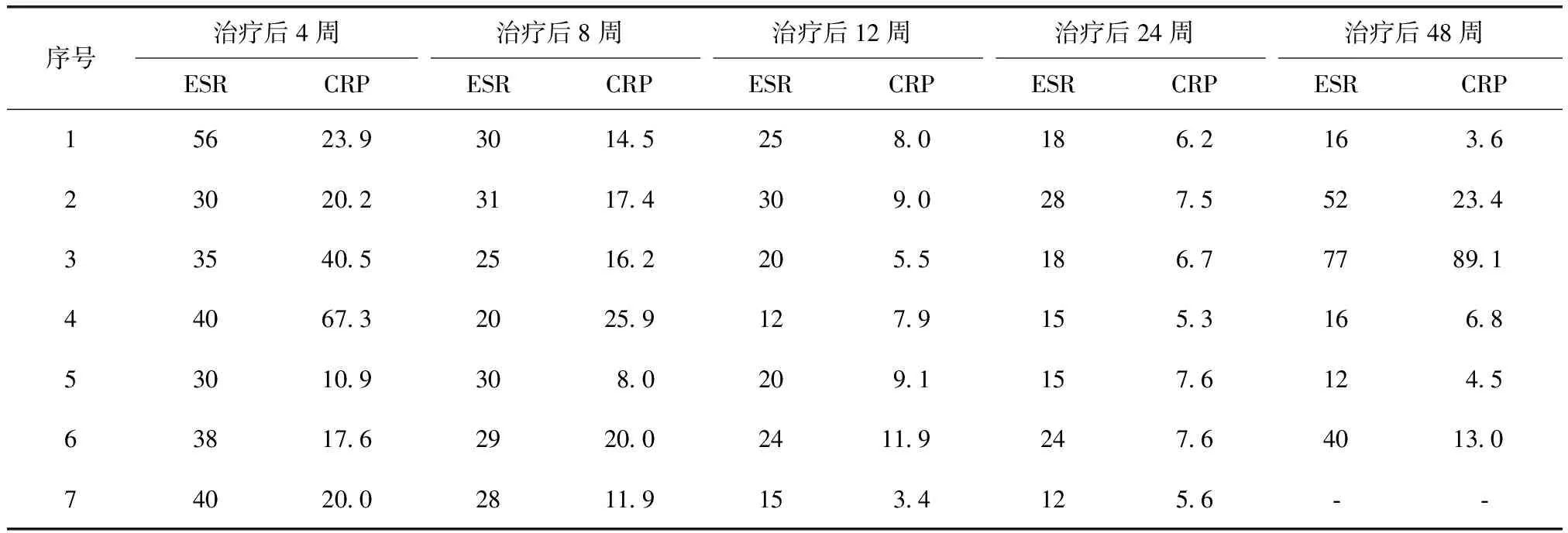
表3 7例受试者炎性指标水平Table 3 Inflammatory markers of 7 subjects
ESR:血细胞沉降率,单位为mm1h;CRP:C反应蛋白,单位为mgL
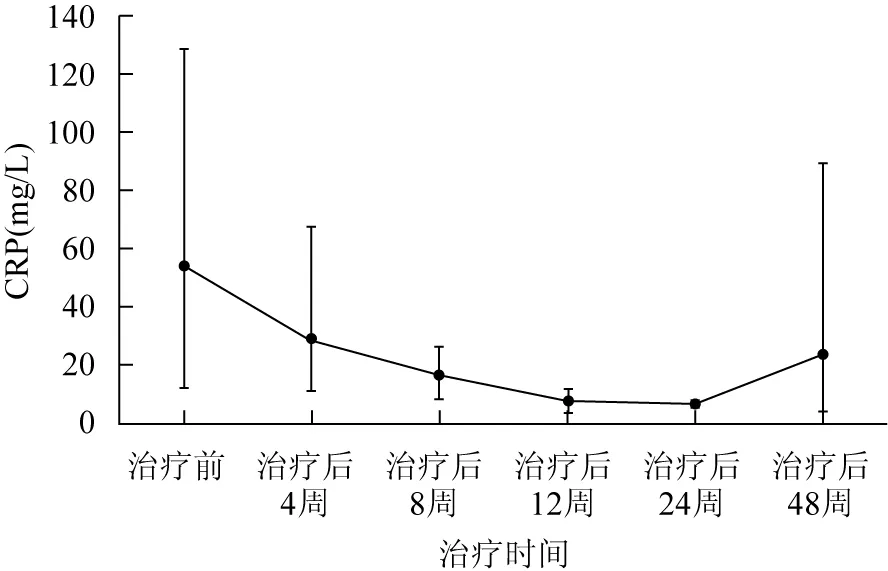
图37例受试者C反应蛋白-治疗时间曲线
Fig3CRP-treatment time curve of 7 subjects
CRP:C反应蛋白
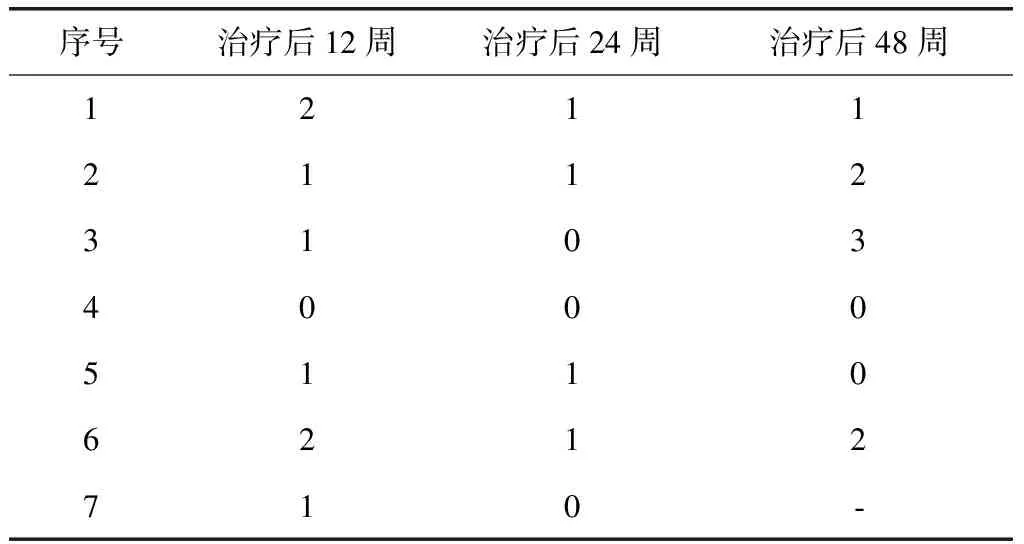
表4 7例受试者结肠镜评分Table 4 Colonoscopy score of 7 subjects
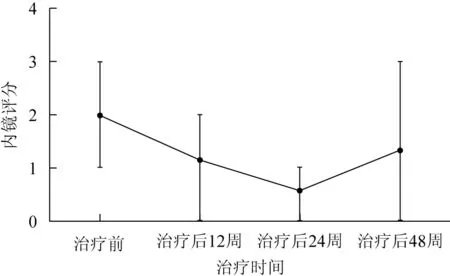
图47例受试者内镜-治疗时间曲线
Fig4Colonoscopy score-treatment time curve of 7 subjects
不良反应
所有患者均出现至少1个不良反应,嗜睡4例(例2、例3、例5、例6),均发生在服药后2周以内,维持原剂量持续约2周后患者均逐渐耐受。便秘2例(例5、例7),起始于服药后8~12周。周围神经病变3例(例1、例2、例6),以肢端感觉异常为主,起始于8~24周,给予口服维生素B12营养神经治疗,症状在1~3周内逐渐缓解。恶心、头痛1例(例7),服药12周后间断发生,可自行缓解,给予营养神经、止吐等对症治疗,但无明显疗效。试验期间进行实验室检查监测,7例受试者均未出现骨髓抑制及肝肾功能损伤,均无重症感染发生。所有患者均在试验规定疗程坚持服药,且没有因粒细胞或中性粒细胞计数减少而致研究药物剂量调整的情况,1例患者于检测期失访。
讨 论
沙利度胺在20世纪50年代作为一种口服镇静剂和止吐剂用于临床,但到了20世纪60年代由于发现其有致胎儿海豹样畸形作用而被禁止使用[11]。1965年,Sheskin偶然用沙利度胺成功治疗麻风病患者的皮肤病损证明沙利度胺具有潜在的抗炎作用[12]。1991年,沙利度胺被发现可以通过加速细胞因子TNF-α的mRNA降解,抑制TNF-α的合成[13]。由于沙利度胺免疫调节和抗血管生成的特性被识别,临床上对其的研究逐渐增多[14]。目前,该药已经有效地用于治疗由炎性细胞因子介导的炎性反应,如难治性皮肤狼疮、骨髓移植所出现的移植物与宿主的排异反应、血清阴性关节炎和皮肤表现的瘤型麻风结节性红斑。
TNF-α具有重要的生理功能,同时也对多种疾病起着关键的作用。TNF-α具有趋化循环炎性细胞至局部组织发生炎性反应的作用,其可以诱发水肿,激活凝血级联反应,并开始形成肉芽肿,与IBD发病相关[15]。随着对TNF-α在IBD发病机制中所起作用的深入研究及抗TNF-α单克隆抗体用于治疗CD患者取得很好的疗效后,以TNF-α为靶向治疗便成为IBD治疗的新思路。直到1997年,Wettstem和Meagher[16]报道了1例皮质类固醇治疗无效的CD患者经沙利度胺治疗获得改善后,该药才受到重视,开始考虑沙利度胺对IBD可能有治疗作用。沙利度胺治疗CD的机制被认为主要是通过增加巨噬细胞中TNF-α的mRNA降解来抑制TNF的生物合成;并且抑制Th1细胞因子人白介素-12及增加Th2细胞因子人白介素-4和人白介素-5的释放[17]。
本研究4例UC和3例CD患者每日服用沙利度胺200 mg,连续24周,治疗均有效,所有患者IOIBD评分均下降。临床疗效结果初步表明,沙利度胺对治疗中、重度活动性IBD有效。本研究患者尤其在4例UC患者中,无论是初治或是难治性患者,其临床疗效均至少达到有效。沙利度胺治疗IBD具有起效快的特点,服药后前4周的IOIBD评分下降幅度最大,且服药过程中未见IOIBD反弹。5例患者24周后停服沙利度胺,48周内3例患者IOIBD回升,2例患者24周后仍坚持服用沙利度胺,病情均保持于缓解期、IOIBD稳定。提示沙利度胺治疗IBD有效后,需长期服药,缓解期维持治疗是否需要联用激素依病情而定;若缓解期联合激素治疗,有利于激素减量,避免出现药物依赖。所有患者炎性指标ESR、CRP在治疗4周后均开始下降,治疗24周后5例患者降至正常,提示沙利度胺可通过抑制炎性作用发挥疗效。治疗后12周,1例患者达到完全缓解;治疗后24周,所有患者镜下评分级别均下调,且有3例患者达到完全缓解,其中包括治疗前内镜评分为重度的例3;治疗后48周,3例保持原有评级,其中2例为坚持服用沙利度胺者,提示沙利度胺可促进肠黏膜的修复,降低内镜评分,维持缓解。
7例患者中,4例对常规治疗无效,为复治/难治患者,其中1例UC(例1)达到完全缓解,1例CD(例5)达临床缓解,另2例(例2、例6)治疗有效,但始终未达缓解标准,提示对于常规治疗方案反应差的难治性IBD患者,可选择尝试使用沙利度胺治疗。初治病例3例,其中2例既往对磺胺类药物过敏,1例存在可疑结核感染,故选择沙利度胺治疗。提示遇到严重的不良反应及存在发生不良反应潜在风险的患者,或由于合并结核感染而不能接受类固醇或免疫抑制剂治疗的患者,可选择尝试使用沙利度胺治疗。
本组所有患者均经历至少1个不良反应,嗜睡4例、周围神经病变3例、便秘2例、恶心、头痛1例,所有患者均在服药期坚持原剂量服药,无骨髓抑制、肝肾功能损伤及重症感染等恶性不良事件发生,提示应用本试验的给药剂量时,沙利度胺有良好的安全性。如何规避上述不良反应,需要经过严格的随机对照试验测试,准确量化其疗效和毒性之间的平衡,促进其在日常临床实践中的使用。
综上所述,沙利度胺对中、重度的IBD患者具有抑制炎性反应、改善临床症状、促进肠黏膜修复及降低结肠镜下评分的作用,且相对安全。沙利度胺口服给药方便且价格低廉,比抗TNF-α单克隆抗体更有临床吸引力。本研究因病例数少、随访时间有限尚存在一定的局限性,有待更多病例经验的积累和验证,并进一步量化沙利度胺的疗效和毒性之间的平衡。对于难治性IBD患者可以试用该药,同时应监测随访药物不良反应,尤其是神经病变。
(本文图5见插页第Ⅰ页)
[1]Rutgeerts P, Van Assche G, Vermeire S. Optimizing anti-TNF treatment in inflammatory bowel disease[J]. Gastroenterology, 2004, 126:1593-1610.
[2]Murch SH, Braegger CP, Walker-Smith JA, et al. Location of tumour necrosis factor alpha by immunohistochemistry in chronic inflammatory bowel disease[J]. Gut, 1993, 34:1705-1709.
[3]Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial[J]. Lancet, 2002, 359:1541-1549.
[4]Direskeneli H, Ergun T, Yavuz S, et al. Thalidomide has both anti-inflammatory and regulatory effects in Behcet’s disease[J]. Clin Rheumatol, 2008, 27:373-375.
[5]van de Donk NW, Kröger N, Hegenbart U, et al. Remarkable activity of novel agents bortezomib and thalidomide in patients not responding to donor lymphocyte infusions following nonmyeloablative allogeneic stem cell transplantation in multiple myeloma[J]. Blood, 2006, 107:3415-3416.
[6]Arora M, Wagner JE, Davies SM, et al. Randomized clinical trial of thalidomide, cyclosporine, and prednisone versus cyclosporine and prednisone as initial therapy for chronic graft-versus-host disease[J]. Biol Blood Marrow Transplant, 2001, 7:265-273.
[7]Kaplan G, Thomas S, Fierer DS, et al. Thalidomide for the treatment of AIDS-associated wasting[J]. AIDS Res Hum Retroviruses, 2000, 16:1345-1355.
[8]中华医学会消化病学分会炎症性肠病协作组. 对我国炎症性肠病诊断治疗规范的共识意见[J]. 中华消化杂志, 2007, 27:545-550.
[9]Bernstein CN, Loftus EV Jr, Ng SC, et al. Epidemiology and Natural History Task Force of the International Organization for the Study of Inflammatory Bowel Disease (IOIBD). Hospitalisations and surgery in Crohn’s disease[J]. Gut, 2012, 61:622-629.
[10] 沈骏, 冉志华, 童锦禄, 等. 炎症性肠病内镜分级和评分标准的一致性研究[J]. 中华消化内镜杂志, 2008, 25:239-244.
[11] SPEIRS AL. Thalidomide and congenital abnormalities[J]. Lancet. 1962, 1:303-305.
[12] Calderon P, Anzilotti M, Phelps R. Thalidomide in dermatology. New indications for an old drug[J]. Int J Dermatol, 1997, 36:881-887.
[13] Sampaio EP, Sarno EN, Galilly R, et al. Thalidomide selectively inhibits tumor necrosis factor alpha production by stimulated human monocytes[J]. J Exp Med, 1991, 173:699-703.
[14] Dredge K, Marriott JB, Dalgleish AG. Immunological effects of thalidomide and its chemical and functional analogs[J]. Crit Rev Immunol, 2002, 22:425-437.
[15] Akazawa A, Sakaida I, Higaki S, et al. Increased expression of tumor necrosis factor-alpha messenger RNA in the intestinal mucosa of inflammatory bowel disease, particularly in patients with disease in the inactive phase[J]. J Gastroenterol. 2002, 37:345-353.
[16] Wettstein AR, Meagher AP. Thalidomide in Crohn’s disease[J]. Lancet, 1997, 350:1445-1446.
[17] 肖瑛, 许元富, 周园, 等. 靶向肿瘤坏死因子的炎症性肠病治疗研究进展[J]. 世界临床药物, 2004, 25:683-687.
