类风湿关节炎相关自身抗体谱检测比对
2013-04-09白伊娜胡朝军李丽君邓垂文史艳萍郑文洁曾小峰张奉春李永哲
白伊娜,宋 宁,胡朝军,李 萍,李丽君,邓垂文,史艳萍,郑文洁,赵 岩,曾小峰,张奉春,李永哲
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科 风湿免疫病学教育部重点实验室,北京 100032)
类风湿关节炎(rheumatoid arthritis,RA)是一种以对称性、多关节为主要表现的慢性、全身性自身免疫病。RA发病隐匿,致残率高,早期诊断及早期治疗对于预防骨和软骨的破坏、保护关节功能尤为重要。1987年美国风湿病学会(American College of Rheumatology,ACR)制定了RA的分类标准,该标准规定类风湿因子(rheumatoid factor,RF)为血清学标志物。由于此标准对RA的早期诊断价值有限,随着免疫学检验技术的发展,2009年ACR与欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)共同制定了RA分类的新标准,将抗环瓜氨酸肽(cyclic citrullinated peptide,CCP)抗体列为新的血清学标志物[1]。由此可见,RA相关自身抗体谱的检测及自身抗体检测的准确性对于RA的早期诊断非常重要。目前,我国还没有RA相关自身抗体室间质评,本文的研究结果有助于了解国内RA相关自身抗体的检测现状。
2010年,由北京协和医院风湿免疫科牵头组织了200余家医院共同参与了实验室室间自身抗体检测比对工作。其中包括100余家系统性红斑狼疮(systemic lupus erythematosus,SLE)“十一五”支撑项目临床干预及注册研究中国系统性红斑狼疮研究协作组(Chinese SLE Treatment And Desearch Group,CSTAR)医院实验室,另外的100余家实验室包括中华风湿病学会委员单位、省级三甲医院,参与项目单位覆盖了全国30个省市自治区。自身抗体检测实验室包括检验科实验室、风湿科实验室、中心实验室、独立实验室及企业实验室等。
材料和方法
比对样本
抗CCP抗体、RF、抗角蛋白抗体(anti-keratin antibodies,AKA)、抗核周因子抗体(antiperinuclear factor,APF)比对品各5支,均为人血清制备,由北京协和医院风湿免疫科实验室提供。
比对品发放
由北京协和医院向参与医院实验室寄发比对品,各参比实验室在规定时间内检测,并将结果回报。
检测方法
各参比实验室可采用间接免疫荧光法(indirect immunofluorescence,IFA)、酶联免疫吸附法(enzyme-linked immuno sorbent assay,ELISA)、免疫渗滤层析试验(胶体金)、免疫比浊法、乳胶凝集试验(latex agglutination,LA)进行检测。
实验方法
各参比实验室可根据各自现行检测方法自行选择上述5种检测方法对前述4种自身抗体进行定性检测,所选4种自身抗体根据各实验室开展的常规项目检测。
数据分析
根据回报结果,分别统计自身抗体检测的正确率及各种检测方法的正确率。结果分析采用随机双盲法,由北京协和医院对各家医院检验结果进行分析并将结果反馈给各实验室。
结 果
项目开展情况
RA相关自身抗体谱参比实验室检验项目构成分别为检测抗CCP抗体的有138家,检测RF的有57家,检测AKA的有77家,检测APF的有26家。RA相关自身抗体谱检测项目组合结果:单独检测抗CCP抗体为48%,抗CCP抗体+APK+AKA的组合为17%,抗CCP抗体+APF(或AKA)的组合为31%,APF+AKA的组合为1%,单独检测APA(或AKA)为3%。
RA相关自身抗体谱检测方法选择
参比实验室检测RA相关自身抗体谱采用方法统计如下:抗CCP抗体的检测方法主要为ELISA(96%),4%为胶体金法检测。RF的检测方法主要分为3种,58%的单位用免疫比浊法检测,23%为ELISA检测,19%为LA。APF和AKA的检测方法均为IFA。
检测结果正确率
抗CCP抗体的准确率最高,阳性或阴性预测值5支比对品的准确率平均为98.6%。RF的5支比对品准确率平均为95.3%。AKA及APF的平均检测准确率分别为73.4%及79.2%(表1~4)。
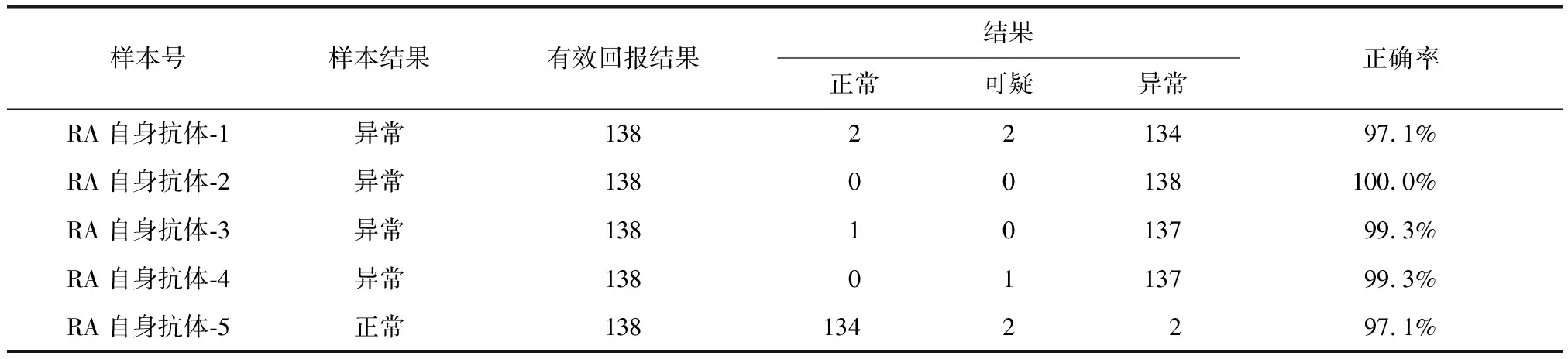
表1 抗CCP抗体检测结果正确率Table 1 Correct rates of anti-CCP antibody test results
CCP:环瓜氨酸肽;RA:类风湿关节炎
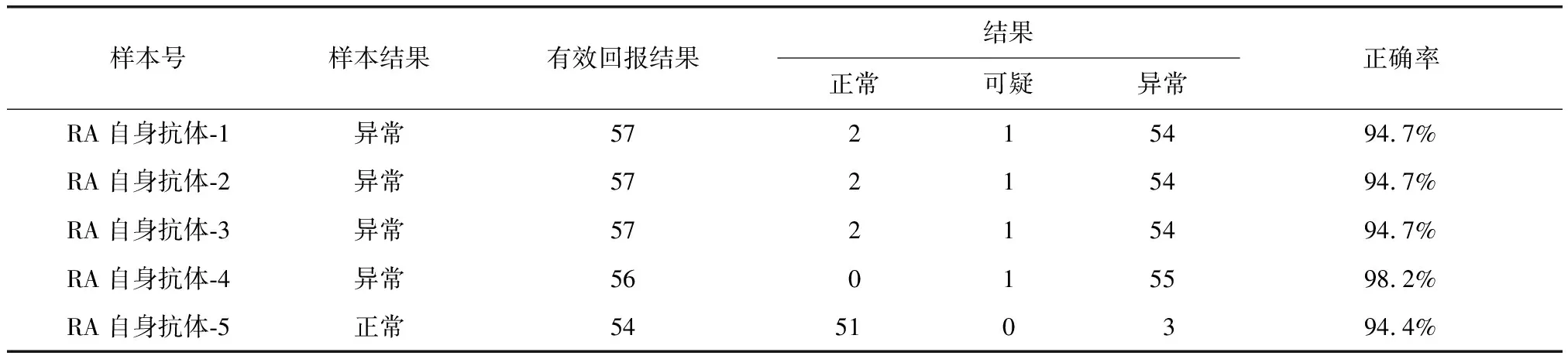
表2 RF检测结果正确率Table 2 Correct rates of RF test results
RF:类风湿因子;RA:类风湿关节炎
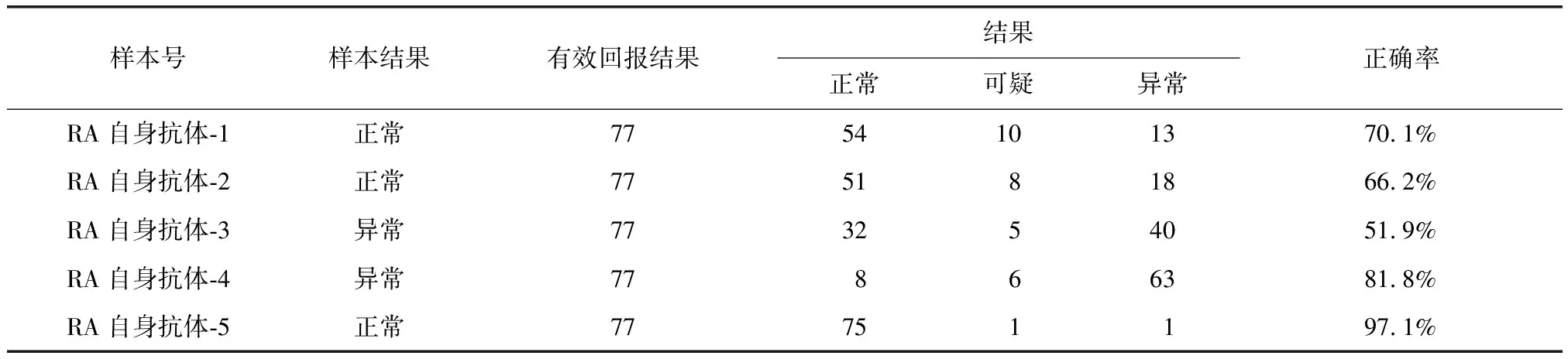
表3 AKA检测结果正确率Table 3 Correct rates of AKA test results
AKA:抗角蛋白抗体;RA:类风湿关节炎
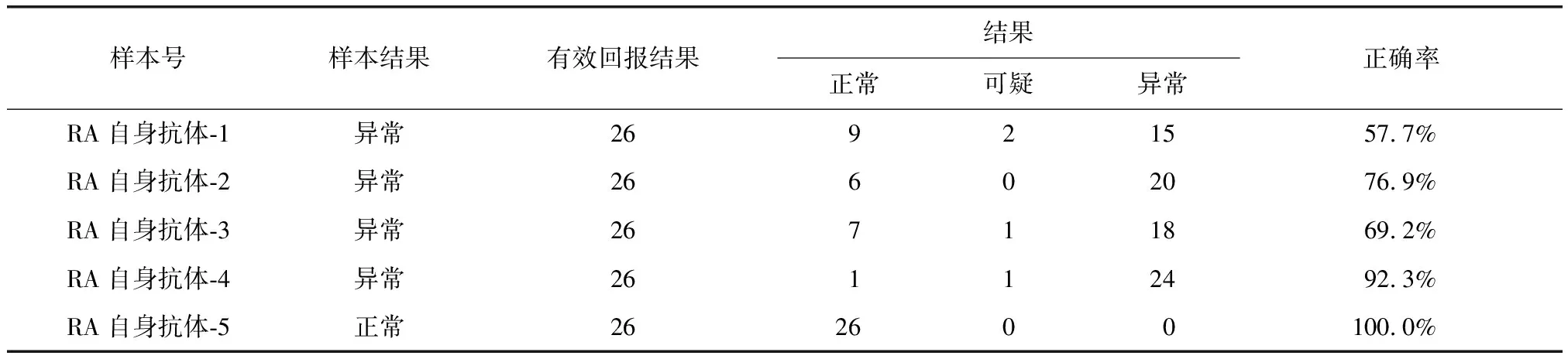
表4 APF检测结果正确率Table 4 Correct rates of APF test results
APF:抗核周因子抗体;RA:类风湿关节炎
方法学评价
在RA相关自身抗体谱参比实验室中,抗CCP抗体和RF不同检测方法的正确率见表5、6。
讨 论
1922年,Kurt Meyer首次描述了一种能促进亚凝集剂量兔抗体致敏的绵羊红细胞发生凝集反应的因子,几年后Waaler发现该现象与抗γ球蛋白抗体有关[2]。因该抗γ球蛋白抗体多发现在RA患者的血清中而命名为“类风湿因子”。随着进一步的研究发现,RF是诊断RA的重要血清学标志,其阳性率可高达80%[3],但RF还可见于其他疾病及健康人群。高效价的RF是RA的危险因子,可提示疾病活动。1964年,Nienhuis和Mandema[4]发现了一种抗人颊黏膜上皮细胞质内透明角质颗粒的抗体APF。1979年,Young等[5]报道了抗鼠食管上皮的角质层抗体对RA诊断的特异性。1998年,Schellekens等[6]通过结合包含瓜氨酸的抗原决定簇发现了抗CCP抗体对于RA的诊断具有特异性,并首次采用ELISA进行抗CCP抗体检测用于辅助诊断RA[7]。APF及AKA在诊断RA时特异性高,可达70%~99%,但敏感性差,只能达到30%~60%[8-9]。近年来研究发现,APF及AKA的靶抗原为丝集蛋白,该抗原位点用于合成CCP,所以也有学者认为抗CCP抗体是以上两种自身抗体共同靶抗原位点,可以替代APF及AKA[8,10-11]。
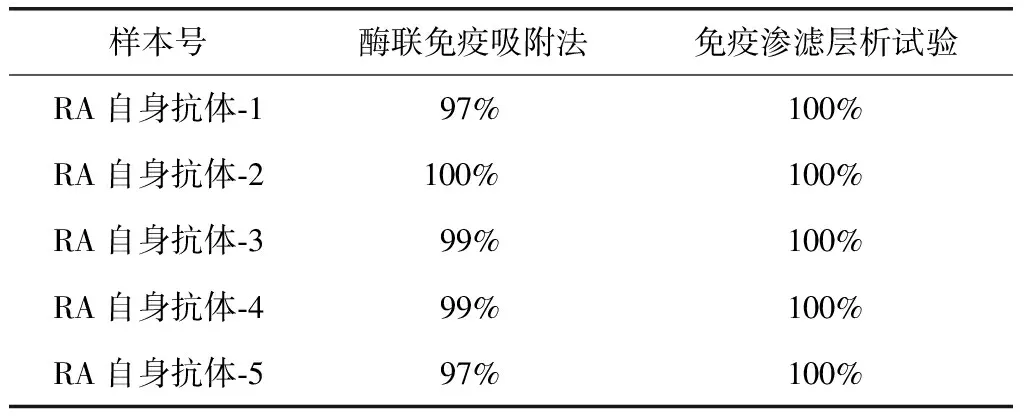
表5 抗CCP抗体不同检测法的正确率Table 5 Correct rates of anti-CCP antibody detection in different method
CCP:环瓜氨酸肽;RA:类风湿关节炎
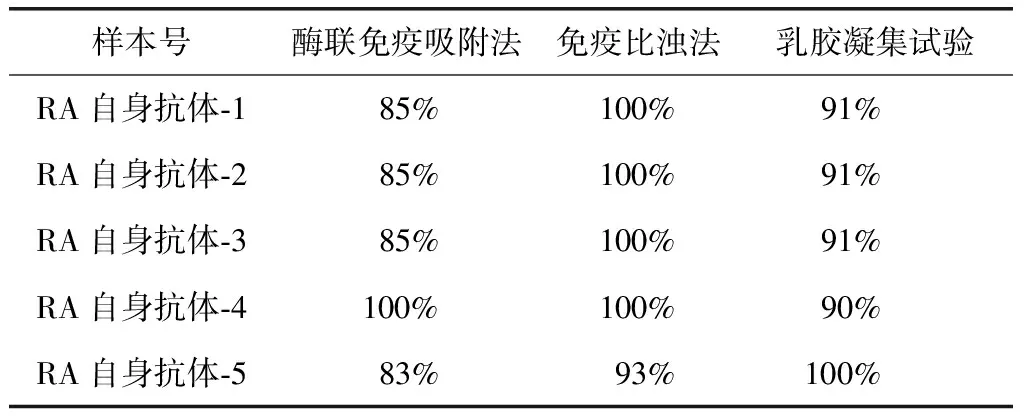
表6 RF不同检测方法的正确率Table 6 Correct rates of RF detection in different method
RF:类风湿因子;RA:类风湿关节炎
RA相关自身抗体的发现使RA早期诊断及早期治疗变成现实。RA的早期临床表现往往仅为关节滑膜炎,而关节滑膜炎只有少部分会发展为RA。因此,早期诊断不能只依靠临床表现。然而,在RA典型症状发作的前几年,患者体内就已经产生了自身抗体。研究发现,抗CCP抗体可以出现在疾病发作的几年甚至十几年前[12]。RA相关自身抗体是RA早期诊断的关键指标,一旦诊断可迅速进行早期治疗,以便更好地预防骨关节的侵袭破坏。由此,检测RA相关自身抗体的准确性直接影响了RA患者的诊断、治疗及预后。
本次比对结果分析显示,抗CCP抗体的准确率最高,无论是阳性或阴性预测值的准确率都高于97.0%。抗CCP抗体一代抗原为直线性瓜氨酸钛。2000年,Schellkens等[7]成功合成了含有二硫键的CCP,从而克服了一代抗原易被聚苯乙烯吸收及结构不稳定的缺点,提高了该抗体检测的敏感性与特异性。ELISA也成为目前抗CCP抗体最常用的检测方法。随着近十年来的不断发展,试剂盒的质量不断完善提高,逐渐采用酶标仪判读检测结果,减少了人为因素的影响。本次比对抗CCP抗体各医院的检测结果准确。
RF是RA相关自身抗体中最早且最广泛应用于临床检测的实验项目,在我国RF检测在RA相关自身抗体中也是开展最早,因此RF检测的技术和试剂质量都已经很成熟。本次比对发现回报结果较少,对此现象进行的调查发现,由于本次比对品血清量相对较少且运输过程中出现损耗,一些医院采用上机检测需要血清量大所以未能完成检测。本次比对结果中RF的准确率较高,5支比对品准确率均高于94.0%。
本次比对结果分析中发现,APF及AKA的准确率相对较低,其中用于AKA检测中的1个比对品的检测准确率仅为51.9%。分析原因,这两种抗体的检测方法均为IFA,检测结果需要通过人眼在荧光显微镜下进行观察判断。荧光显微镜的荧光强弱有所差异,各实验室无法统一;另外,由于结果为人为操作,增加了主观因素,存在水平差异,这些都影响了APF及AKA检测的准确性。各医院均应根据自身原因发现检测中的问题,及时进行自诊。
本次比对的参与医院级别主要为三级医院,所占比例为96%,二级医院仅有11家。为促进自身免疫病规范化诊疗技术在全国推广普及,全面掌握RA相关自身抗体的检测水平,更深入了解我国自身抗体检测现状,今后比对工作的开展需要进一步完善和改进,邀请更多医院尤其是二级医院参加。
[1]Neogi T, Aletaha D, Silman AJ, et al. The 2010 American College of RheumatologyEuropean League against Rheumatism classification criteria for rheumatoid arthritis: phase 2 methodological report[J]. Arthritis Rheum, 2010,62:2582-2591.
[2]Waaler E. On the occurrence of a factor in human serum actiwating the specific agglutination of sheep blood corpuscules[J]. Acta Patbol Microbiol Scand, 1940,1:172-188.
[3]Doner T, Egerer Keist E, Burmester GR. Rheumatoid factor revised[J]. Curr Opin rheumatol, 2004,16:246-253.
[4]Nienhuis RL, Mandema E. A new serum factor in patients with rheumatoid arthritis; The antiperinuclear factor[J]. Ann Rheum Dis, 1964, 23:302-305.
[5]Young BJ, Mallya RK, Leslie RD, et al. Anti-keratin antibodies in rheumatoid arthritis[J]. Br Med J, 1979,2:97-99.
[6]Schellekens GA, de Jong BA, van den Hoogen FH, et al. Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis-specific autoantibodies[J]. J Clin Invest ,1998, 101:273-281.
[7]Schellekens GA, Visser H, de Jong BA, et al. The diagnostic properties of rheumatoid arthritis antibodies recognizing a cyclic citrullinated peptide[J]. Arthritis Rheum, 2000, 43:155-163.
[8]Agrawal S, Misra R, Aggarwal A. Autoantibodies in rheumatoid arthritis: association with severity of disease in established RA[J]. Clin Rheumatol, 2007, 26:201-204.
[9]PoulsomH, Charles PJ. Antibodies to citrullinated vimentin are a specific and sensitive marker for the diagnosis of rheumatoid arthritis clinic[J]. Rev Allerg Immunol, 2008, 34:4-10.
[10] Szekanecz Z, Soos L, Szabo Z, et al. Anti-citrullinated protein antibodies in rheumatoid arthritis: As good as it gets?[J]. Clinic Rev Allerg Immunol, 2008, 34:26-31.
[11] Zhao J, Liu X, Wang Z, et al. Is it necessary to combine detection of anticitrullinated protein antibodies in the diagnosis of rheumatoid arthritis?[J]. J Rheumatol, 2010, 37:2462-2465.
[12] Barra L, Pope J, Bessette L, et al. Lack of seroconversion of rheumatoid factor and anti-cyclic citrullinated peptide in patients with early inflammatory arthritis: a systematic literature review[J]. Rheumatology, 2011, 50:311-316.
