高铁煤矸石酸浸液合成氧化铁红的实验研究*
2013-04-08孔德顺范佳鑫石开仪李志
孔德顺,范佳鑫,石开仪,李志
(六盘水师范学院化学与化工系,贵州省教育厅煤系固体废弃物资源化利用特色重点实验室,贵州六盘水 553004)
高铁煤矸石酸浸液合成氧化铁红的实验研究*
孔德顺,范佳鑫,石开仪,李志
(六盘水师范学院化学与化工系,贵州省教育厅煤系固体废弃物资源化利用特色重点实验室,贵州六盘水 553004)
以高铁煤矸石为原料,先用硫酸酸浸的方法获得含有铝离子的硫酸铁溶液;采用分步沉淀的方法,使Fe3+完全转化为氢氧化铁凝胶而与Al3+分离;再将获得的氢氧化铁凝胶烘干后高温煅烧;最后将煅烧产物磨粉过筛,获得了氧化铁红。确定了合成氧化铁红的工艺条件是:酸浸液中铁离子的浓度为0.31 mol/L;分离Fe3+与Al3+时,氢氧化钠溶液的浓度为1 mol/L,且控制终点pH在3.0左右;干凝胶焙烧温度为800℃,时间为60 min。XRD及化学分析结果表明:所得产物为氧化铁红,符合GB/T 1863—2008《氧化铁颜料》的相关要求。
高铁煤矸石;酸浸液;氧化铁红
由含铁原料制备氧化铁红的方法很多,常见的有干法和湿法。干法中的绿矾煅烧法[1]SO2和SO3的生成极易造成环境污染和设备腐蚀;湿法工艺中的硫酸盐法、硝酸盐法和混酸盐法均需制造晶种[2],缺点是工艺较为复杂、反应时间长、不经济等;最近研究较多的水热法则需要高压釜[3],对设备的要求较高。笔者以高铁煤矸石的酸浸液为原料,制得较纯净的氧化铁红产物。该法既利用了酸浸煤矸石的废液,又简化了氧化铁红的合成工艺。
1 实验部分
1.1 原料、药品及仪器
煤矸石取自六盘水矿区某煤矿,经850℃煅烧后,测定其煅烧粉的成分,结果如下:w(SiO2)= 49.47%;w(Al2O3)=18.9%;w(Fe2O3)=20.61%;w(MgO)= 2.03%;w(Na2O)=1.26%;w(CaO)=0.131%;w(TiO2)= 2.93%。
硫酸、盐酸、NaOH、氨水、乙二胺四乙酸二钠、碳酸钙、5-磺基水杨酸、三氯化铁,均为分析纯。
ARL9900XP+型X射线荧光光谱仪(XRF)、TD-2500型X射线多晶衍射仪(XRD)、XL-V型箱形高温炉、DZ-88型电热恒温真空干燥箱、PSH-3C型酸度计等。
1.2 实验方法
将粒度为75μm煤矸石粉在350℃低温氧化2 h后,按照固液体积比为1∶8加入到15%的硫酸中,在90℃下反应2 h[4];过滤后向滤液中加入一定量的碱液,控制终点pH,使Fe3+形成Fe(OH)3凝胶从而与Al3+分离;将Fe(OH)3凝胶水洗、烘干,然后在高温下煅烧一定时间,研磨后过筛,即得氧化铁红产物。
2 结果与讨论
2.1 煤矸石酸浸液中Fe3+与Al3+的分离
先向所得的酸浸液中逐滴加入H2O2,待其中的Fe2+完全转化为Fe3+后,再向滤液中加入过量氨水,此时形成了Fe(OH)3与Al(OH)3凝胶的共沉淀,无法实现Fe3+与Al3+的分离;在加入NaOH溶液时,也形成了Fe(OH)3和Al(OH)3的混合凝胶状沉淀;在加热搅拌的条件下继续用过量的NaOH溶液处理这二者的沉淀,由于Fe(OH)3凝胶与Al(OH)3凝胶互相包裹,即使长时间搅拌,也难以实现Al(OH)3的大量溶解,导致不能有效分离铁和铝。
研究发现,通过控制溶液的pH,使二者通过分步沉淀的方法,可以实现Fe3+、Al3+的有效分离。将煤矸石酸浸液进行Fe3+与Al3+的浓度分析,其余离子含量较低不予处理。Fe3+和Al3+的初始浓度分别为0.31、0.15 mol/L,这是由于采用350℃的低温氧化来活化煤矸石中的铁元素,铝元素主要存在于高岭石中,所以酸浸液中的Al3+含量较低。由于Fe(OH)3的Ksp= 2.8×10-39;Al(OH)3的Ksp=1.3×10-33。经计算可知,Fe(OH)3沉淀的pH范围是1.32~2. 81;而Al3+开始沉淀时,所需的pH为3.31。所以,控制沉淀终点pH≈3.0,实现了Fe3+与Al3+的分离。
2.2 凝胶及其烘干产物的XRD分析
将Fe(OH)3凝胶及其在80℃下烘干的产物用XRD进行分析,结果如图1所示。凝胶是一种体积庞大,疏松,含有较多水分的非晶型沉淀,所以Fe(OH)3凝胶的XRD谱图表现为弥散峰;当凝胶在80℃烘干以后,XRD显示其状态仍为无定形态,这说明在80℃烘干凝胶不会使其发生晶型转变。
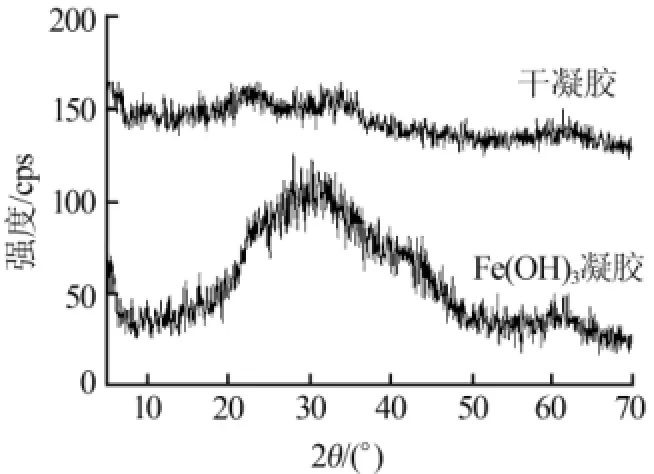
图1 凝胶及其烘干产物的XRD谱图
2.3 不同的碱对产物吸油量的影响
向两份相同的酸浸液中分别加入浓度均为0.5、1、1.5、2 mol/L的NaOH溶液和氨水,将所需的碱液平均分为4份,加碱间隔为20 min/次,至溶液的pH≈3时停止,将所产生的凝胶在80℃烘干后,再分别放入马弗炉中750℃恒温60 min,将所得产物进行吸油量测定,结果如图2所示。
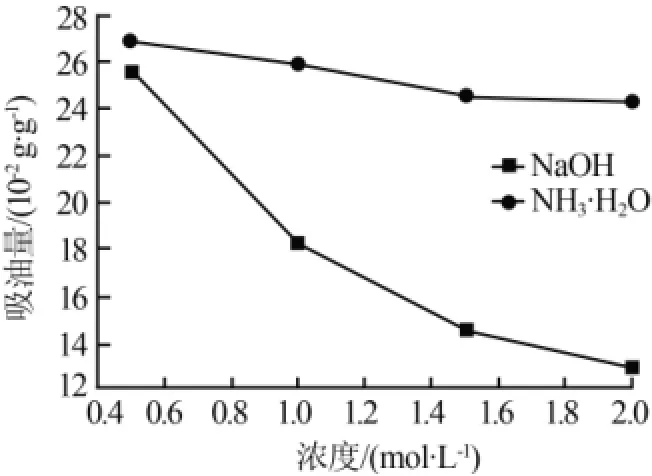
图2 不同浓度的两种碱对产物吸油量的影响
吸油量是反映氧化铁红表面性质的指标,吸油量大,说明氧化铁红表面积较大,表面羟基浓度较大。由图2可知,采用氨水作为沉淀剂时,产物的吸油量比采用NaOH作为沉淀剂时产物的吸油量大;随着两种碱浓度的增加,氧化铁红的吸油量均随之降低。若产物的吸油量太大,则用在油漆中会造成油漆假稠。所以,先确定沉淀剂为NaOH溶液。当NaOH溶液浓度相对较低时,最终的产物较为疏松、易于研磨、粒度较小、色泽鲜亮;当NaOH溶液浓度较高时,最终产物结块、不易磨碎,产物粒度较大,还不易于控制终点的pH。所以,采用1 mol/L的NaOH溶液作为Fe3+的沉淀剂。
2.4 煅烧温度、时间对产物纯度的影响
分别设定不同的煅烧温度,把烘干后的Fe(OH)3干凝胶放入到升温至设定温度的马弗炉中煅烧60 min,然后测定产物的纯度,结果如图3所示。由图3可知,随着温度的升高产物的纯度逐渐增高。当温度超过800℃时增加温度氧化铁红纯度基本稳定不变;在750~850℃煅烧所得到的氧化铁红产物活性好、纯度高、色光好;若煅烧温度过高则产物色泽发暗,所以确定煅烧温度为800℃。
在800℃的条件下煅烧不同的时间,将所得产物进行纯度分析。煅烧时间与纯度的关系如图4所示。在煅烧时间为40~50 min时,由于煅烧时间不足氢氧化铁不能充分脱水,也不能除去产物中易挥发的杂质,得到的产物纯度低,色泽暗淡;随着煅烧时间的增加产物颜色呈现暗—光亮—深灰的变化趋势,在煅烧时间为60 min时产物纯度为93.4%且色光度好。所以,确定煅烧时间为60 min。

图3 煅烧温度对产物纯度的影响

图4 煅烧时间对产物纯度的影响
2.5 产物的XRD分析
反应条件为:1 mol/L NaOH作沉淀剂、控制终点pH为3.0、80℃烘干凝胶、800℃煅烧60 min,得到的产物用XRD进行物相分析,测试结果如图5所示。将获得的谱图运用Jade5.0检索,发现其2θ与d值均与PDF卡片号为33-0664的物质Fe2O3吻合,无杂质峰。可见,该物质为较纯净的氧化铁红。
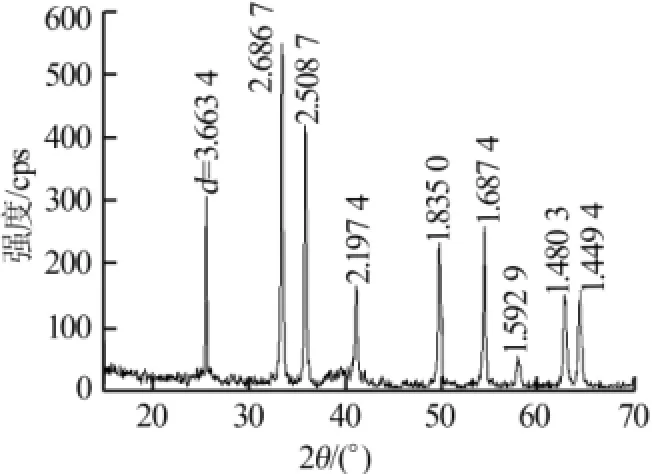
图5 产物的XRD谱图
2.6 氧化铁红产物的质量分析
按照GB/T 1863—2008《氧化铁颜料》的相关要求,对产物进行了检测,结果如表1所示。由表1可知,产物品质较好,符合国家相关标准。
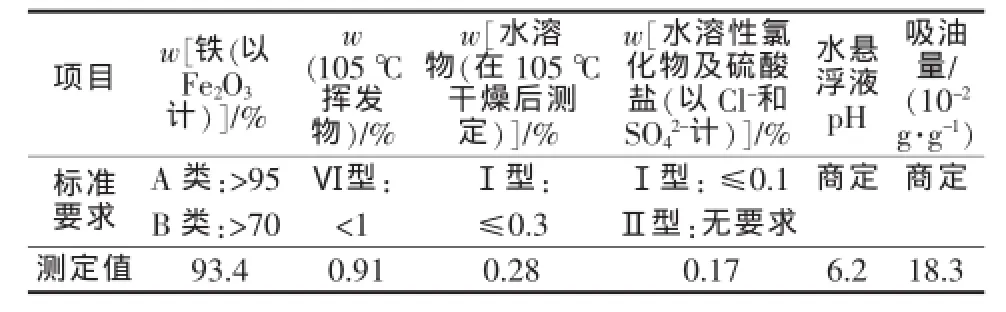
表1 产物质量检测结果
3 结语
1)采用1 mol/L氢氧化钠作为沉淀剂,对高铁煤矸石酸浸液进行分步沉淀,实现了Fe3+和Al3+的有效分离。2)Fe(OH)3凝胶经80℃烘干后,获得的干凝胶仍为无定形态,再在800℃的条件下将干凝胶煅烧60 min,获得了符合GB/T 1863—2008相关要求的氧化铁红产品。
[1]何苏萍,高倩,余晓婷,等.氧化铁红的制备方法及其在涂料中的应用[J].化工生产与技术,2011,18(1):29-32.
[2]Jong Yoon Jang,Young Kuk Jhon,In Woo Cheong,et al.Effect of process variables on molecular weight and mechanical properties of water-based polyurethane dispersion[J].Colloids and Surfaces A:PhysicochemicalandEngineeringAspects,2002,196(2):135-143.
[3]郑雅杰,刘昭成.用水热法从硫铁矿烧渣制备氧化铁红[J].金属矿山,2008(2):139-145.
[4]孔德顺,吴红,毕迎鑫.高铁高砂煤矸石除铁及碱融活化合成4A分子筛[J].无机盐工业,2011,43(5):52-54.
Experimental study on preparation of iron oxide red from acid leaching solution of high-iron coal gangue
Kong Deshun,Fan Jiaxin,Shi Kaiyi,Li Zhi
(Characteristics Key Laboratory of Coal Series Solid W aste Recycling Utilization of Guizhou Provincial Education Department,Department of Chemistry and Chemical Engineering,Liupanshui Normal University,Liupanshui 553004,China)
High-iron coal gangue was taken as the raw material to obtain ferric sulfate solution containing aluminum ions with sulfuric acid leaching method firstly.As totally turned into Fe(OH)3gel,the Fe3+was separated from Al3+by fractional precipitation,then the Fe(OH)3gel was calcined at high temperature after it was dried.At last,the iron oxide red was obtained after the calcined product being milled and sieved.The synthesis conditions of iron oxide red were determined:the concentration of Fe3+in the acid leaching solution was 0.31 mol/L;the concentration of NaOH was 1 mol/L and the endpoint of the pH was about 3.0,when separating the Fe3+from Al3+;the dry gel was calcined at 800℃for 60 min.XRD and chemical analysis showed that the product was iron oxide red,and met the requirements of Iron Oxide Pigment,GB/T 1863—2008.
high-iron coal gangue;acid leaching solution;iron oxide red
TQ138.11
A
1006-4990(2013)07-0056-03
2013-01-15
孔德顺(1974—),男,硕士,副教授,主要从事矿产资源的深加工与利用研究,已发表论文17篇。
六盘水市煤系固体废弃物资源化利用创新团队资助(52020-2012-04-01-02);贵州省教育厅重点科研项目资助(黔财教[2011]232);贵州省煤炭资源清洁高效利用科研实验平台资助(黔科平台[2011]4003);六盘水师范学院特色专业建设点资助(LPSSYtszy201102)。
联系方式:kongdeshun518@163.com
