盐湖卤水碳酸锂提取工艺过程研究*
2013-04-08李燕茹袁建军朱亮沙作良杨美洁左玥华
李燕茹,袁建军,朱亮,沙作良,杨美洁,左玥华
(天津科技大学天津市海洋资源与化学重点实验室,天津 300457)
盐湖卤水碳酸锂提取工艺过程研究*
李燕茹,袁建军,朱亮,沙作良,杨美洁,左玥华
(天津科技大学天津市海洋资源与化学重点实验室,天津 300457)
青藏高原的盐湖卤水锂储量丰富,通过盐田蒸发浓缩,去除卤水中的绝大部分Na+、K+、SO42-、Cl-、Mg2+,可以使镁锂比降到8~12,锂离子质量分数也可达到0.5%以上。以蒸发浓缩后的富锂卤水为原料,选用碳酸钠和氢氧化钠为沉淀剂分两步沉淀除镁,之后用碳酸钠为沉淀剂提锂,通过对此工艺过程中的各个阶段进行实验,最终可以得到纯度和收率较高的粗级碳酸锂产品。
盐湖卤水;提锂工艺;沉淀法;碳酸锂
盐湖卤水提锂的方法很多,主要有沉淀法、溶剂萃取法、离子交换(吸附)法等[1-2]。应用比较成熟的主要是沉淀法。提锂主要分成两大步:盐田蒸发浓缩和沉淀分离[3]。去除卤水中的绝大部分Na+、K+、SO42-、Cl-、Mg2+后,锂、硼元素得到高度富集[4]。对于高镁锂比体系,并有较多硼存在时,分离锂、硼一般都是先加盐酸酸化提取硼酸,然后加碱除镁,再加纯碱沉淀碳酸锂[5]。该路线不管是提锂成本,还是提锂收率方面都不经济。因而提出了对富锂、硼卤水先提锂,后提硼的工艺路线。由于镁和锂的化合物的性质也非常相近,给镁、锂的分离造成困难。一般而言,盐湖卤水中镁锂比的高低决定了利用卤水资源生产锂盐的可行性以及锂盐产品的生产成本和经济效益[6]。因此,对盐湖资源的综合开发而言,深入开展对锂镁分离创新工艺技术研究,建立快速、经济、高效、环保的分离提取技术将是今后的工作重点。
1 实验部分
1.1 主要仪器及设备
BT300-2J蠕动泵驱动器;DW-3数显电动搅拌器;SYC智能超级恒温水槽;SHB-IV双A型循环水式多用真空泵;WFX-120原子吸收分光光度计。
1.2 实验主要分析方法
Mg2+:EDTA容量法;Li+:原子吸收分光光度计(标准曲线)法。
1.3 实验过程
主要针对盐湖卤水经盐田蒸发除去钠、镁、钾盐后的富锂卤水,采用分步沉淀法制取碳酸锂。分为3个阶段分别进行工艺条件优化,包括除镁、蒸发浓缩和碳酸钠提锂。
1.3.1 除镁阶段
镁和锂都能生成难溶碳酸盐,Li2CO3的溶度积为2.5×10-2,比MgCO3的溶度积(3.5×10-8)大,因此在加碱的过程中,先与Mg2+生成MgCO3沉淀,由于Li2CO3也是难溶物质,如果利用加入过量的来进行深度除镁的话,有一部分Li+也会以Li2CO3的形式析出。因而需要控制纯碱的加入量,在防止Li2CO3析出的前提下利用来除镁,剩余的镁离子可用烧碱作为沉淀剂来去除。
用纯碱除掉大部分的Mg2+:

用烧碱除掉剩余的Mg2+:

碳酸镁和氢氧化镁颗粒大小影响母液夹带和抽滤的难易,为了保持溶液过饱和度比较均匀,沉淀剂的滴加过程在搅拌的条件下进行,并应该对滴加速度加以控制。
1.3.2 蒸发浓缩阶段
除镁后的母液氯化钠的量增加,锂离子浓度降低,通过加热蒸发,使NaCl结晶析出,与此同时卤液得到浓缩,为最后的提锂提供含高浓缩锂的卤液。
1.3.3 提锂阶段
析盐母液加入纯碱后发生沉淀反应,即可获得Li2CO3。
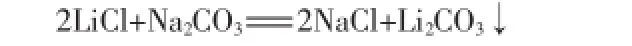
随着温度的升高碳酸锂的溶解度减小,沉淀剂浓度大且在高温下进行反应有利于碳酸锂的生成。卤水蒸发浓缩后,为了尽可能提高锂的收率,应向溶液中添加过量的碳酸钠。
2 实验结果及分析
实验所用卤液主要成分见表1。物性参数为:密度ρ=1.346 9 g/mL,黏度η=15.08 mPa·s。

表1 卤液主要成分
2.1 碳酸钠脱镁
以浓度为1.38 mol/L的碳酸钠溶液作为沉淀剂。反应条件:温度控制为室温(22℃);搅拌速率控制为60 r/min;沉淀剂滴加速率控制为0.08 mL/s。图1为碳酸钠用量(占理论用量的百分数,下同)与卤液中镁、锂离子含量的关系。图2为碳酸钠用量对除镁率和锂损失率的影响。由图1、图2可以看出:随着碳酸钠用量的增加,除镁后所剩卤液中镁离子含量呈明显下降趋势,其除镁率从78%一直增大到96.5%;于此同时卤液中所含锂离子量也会下降,碳酸钠用量从80%增加到95%时,锂离子含量下降趋势不明显,锂损失率保持在3%左右。分析其原因,锂离子的损失主要是由于母液夹带造成,碳酸钠用量增加到95%以后锂离子含量明显降低,碳酸钠用量为105%时锂损失率增加到了10%,原因是多余的碳酸钠与锂形成碳酸锂沉淀造成卤液中锂损失。纯碱脱镁阶段,碳酸钠的用量以94%~96%为宜。

图1 碳酸钠用量与卤液中镁、锂离子含量的关系
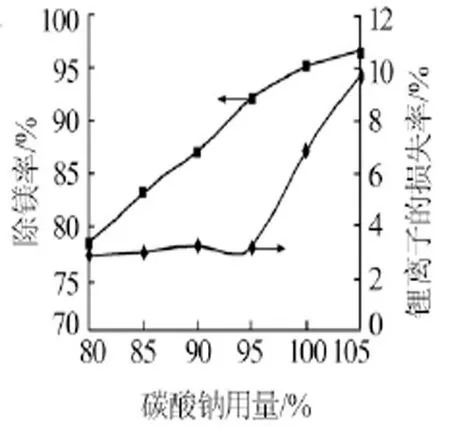
图2 碳酸钠用量对除镁率和锂损失率的影响
2.2 氢氧化钠脱镁
以添加95%碳酸钠除镁之后的卤液作为第二步氢氧化钠除镁阶段的卤液。考虑到氢氧化钠对卤液的稀释作用,选择尽量浓的氢氧化钠溶液作为沉淀剂,本文采用了12.5 mol/L的氢氧化钠溶液作为沉淀剂。反应条件:温度控制为室温(22℃);搅拌速率控制为60 r/min;沉淀剂滴加速率控制为0.08 mL/s。
图3为氢氧化钠用量(占理论用量的百分数,下同)与卤液中镁、锂离子含量的关系。图4为氢氧化钠用量对除镁率和锂损失率的影响。
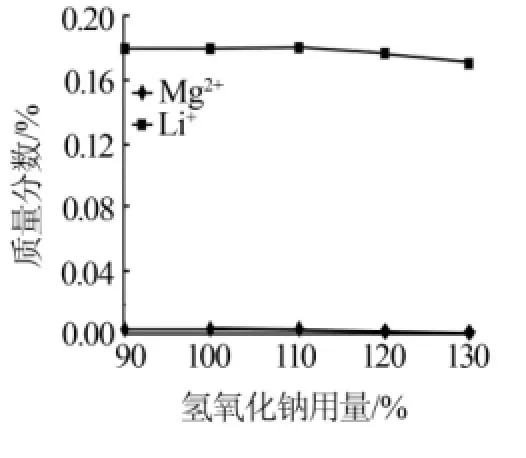
图3 氢氧化钠用量与卤液中镁、锂离子含量的关系

图4 氢氧化钠用量对除镁率和锂损失率的影响
由图3、图4可以看出:加入氢氧化钠后除掉了大部分镁,随着氢氧化钠用量的增加除镁率开始明显增大后趋于不变;于此同时卤液中所含锂离子量也会下降,氢氧化钠用量从90%增加到110%时,锂损失率保持在4%左右,氢氧化钠用量为130%时锂损失率增加到了8.5%。分析其原因,锂离子的损失主要是由于母液夹带造成,由于氢氧化镁的粒度比碳酸镁小,抽滤难度增加,所以这一步锂损失率比之前碳酸钠除镁大。而且随着形成的氢氧化镁量越多,锂损失越多。烧碱脱镁阶段,氢氧化钠用量为100%~105%为宜。
2.3 蒸发浓缩阶段
除镁阶段加入大量钠离子,卤液中锂离子浓度也在除镁阶段被稀释,为了提高最终产品的收率和纯度需要对除镁后得到的卤液进行蒸发浓缩,在锂离子不析出的情况下使卤液尽可能地浓缩。以首先添加95%的碳酸钠除镁后再添加100%的氢氧化钠除镁后的液相为起始卤液,首先用盐酸调pH为7,然后通过高温强制蒸发到一定蒸发率。图5为卤液中锂离子含量和锂离子损失率与蒸发率的关系。由图5可以看出:随着蒸发率的增大卤液中锂离子的浓度逐渐增大,与此同时锂离子的损失率也逐渐增大,锂离子浓度和锂损失率随蒸发率的变化趋势一致。蒸发率为60%及之前主要析出物为氯化钠,锂的损失主要原因是母液夹带,随着蒸发析盐量的增加锂损失率增加。蒸发率达到65%后,锂的损失率很快增大到10%;蒸发率达到77%后,锂的损失率达到22%,这阶段锂的损失是由于锂以锂盐的形式析出。蒸发率以50%~60%为宜。

图5 卤液中锂离子含量、锂离子损失率与蒸发率的关系
2.4 碳酸钠提锂阶段
反应条件:温度控制为85℃;搅拌速率控制为60 r/min;沉淀剂滴加速率控制为0.08 mL/s;沉淀剂碳酸钠浓度控制为3.08 mol/L;沉淀剂加入量按理论量的120%加入。
蒸发阶段选择不同的蒸发率可以得到不同浓度的提锂母液。蒸发阶段蒸发掉30%、45%、50%、60%、65%的水后得到的不同锂离子浓度的母液,分别以这些含锂离子浓度不同的母液进行碳酸钠提锂实验。图6为提锂前卤液的锂离子浓度与产品收率及纯度的关系。由图6可知:提锂前卤液中锂离子浓度对最终产品纯度和收率都有影响。原始锂离子浓度越大最终产品收率越高、纯度越低,且原始锂离子浓度对收率的影响比对纯度的影响大。图6中母液锂离子浓度分别对应蒸发阶段的蒸发率为30%、45%、50%、60%、65%,所以综合蒸发阶段和碳酸钠提锂阶段实验数据,蒸发率以60%左右为宜。
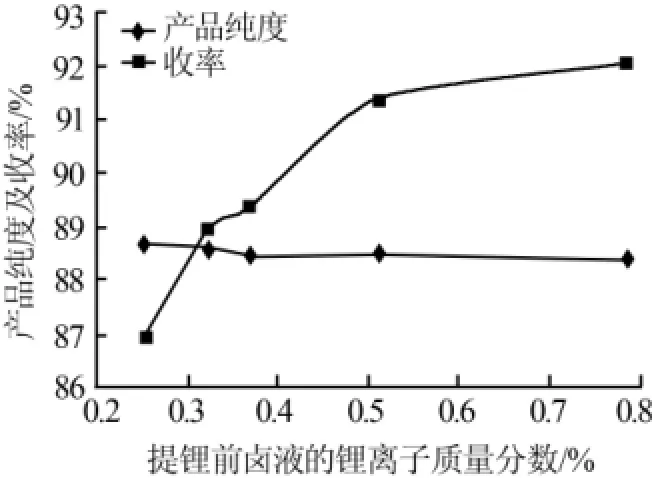
图6 提锂前卤液的锂离子浓度与产品收率及纯度的关系
3 总结
1)纯碱除镁阶段,考虑锂的损失率的控制,选取碳酸钠用量为95%,这个过程中锂的损失率为3%,除镁率可达到92%。2)在烧碱除镁阶段,氢氧化钠用量为100%,这个过程中锂的损失率为4.1%,除镁率达到99.68%。3)除镁后对溶液蒸发掉60%的水分来除掉NaCl同时使卤液中锂的浓度得到浓缩,这个过程中锂的损失率为4.8%,Li+质量分数达到0.512%。4)用理论用量120%的浓度为3.08 mol/L的碳酸钠浓溶液在85℃下提锂,最终得到纯度为88.5%、总收率为80.6%的碳酸锂产品。5)锂损失的主要原因是母液夹带,实际生产过程中应该着重考虑减少这一方面的影响,可采用洗涤操作,回收固相夹带母液,同时在除镁阶段应该尽量使沉淀出的碳酸镁和氢氧化镁的粒度变大,这样一方面便于过滤另一方面也可以大大提高产品收率。6)实际生产过程中可以利用热水或热余液多次洗涤,循环利用洗涤液的方式提高碳酸锂的纯度和收率。
[1]邢红,应毅,金芳.盐湖卤水提锂进展研究[J].科技资讯,2011(19):230-233.
[2]刘元会,邓天龙.国内外从盐湖卤水中提锂工艺技术研究进展[J].世界科技研究与发展,2006(5):69-75.
[3]杨天凤,袁建军.盐湖晶间卤水提锂工艺研究[J].海湖盐与化工,2002,31(1):21-23.
[4]钟辉,杨建元,张芃.高镁锂比盐湖卤水中制取碳酸锂的方法:中国,1335262[P].2002-02-13.
[5]李青林.柴达木盆地油田卤水提锂实验研究[J].化工矿物与加工,2006(8):16-17.
[6]李昱昀,狄晓亮,高洁.国内外盐湖卤水锂资源及开发现状[J].海湖盐与化工,2005,34(5):31-35.
Research on extraction process of lithium carbonate from salt lake brine
Li Yanru,Yuan Jianjun,Zhu Liang,Sha Zuoliang,Yang Meijie,Zuo Yuehua
(Tianjin Key Laboratory of Marine Resources and Chemistry,Tianjin University of Science&Technology,Tianjin 300457,China)
The salt lake brine in Tibetan Plateau has a rich lithium reserves.After the process of evaporation in the salt pan,the most impurities,such as Na+,K+,SO42-,Cl-,and Mg2+in the brine can be removed.At the same time,the ratio of Mg/Li is decreased to the range of 8~12 and the mass fraction of lithium ion can be concentrated to over 0.5%.The magnesium ions in the evaporated lithium-rich brine are precipitated with the sodium carbonate and sodium hydroxide as precipitators,and then the lithium is extracted with sodium carbonate as precipitator.After a series of experiments in all the stages of the process,coarse lithium carbonate with relatively higher purity and yield is finally obtained.
saline lake brine;extraction process of lithium;precipitation method;lithium carbonate
TQ131.11
A
1006-4990(2013)07-0012-03
2013-01-12
李燕茹(1987—),女,硕士研究生,研究方向为海卤水资源综合利用。
国家自然科学基金资助项目(21076157);天津市自然科学基金资助项目(12JCZDJC28200);天津市自然科学基金资助项目(12JCZDJC30000)。
联系方式:lyr_gpz@126.com
