Cripto-1在食管癌组织中的表达及其与上皮间质转化的关系
2013-04-01陈旺盛傅仲学黄春文坤明钱江冯继红李雷
陈旺盛,傅仲学,黄春,文坤明,钱江,冯继红,李雷
食管癌(esophageal carcinoma)是常见的消化道恶性肿瘤,预后差,病死率高[1-2]。我国是食管癌高发国家,研究食管癌的发生、发展具有重要意义。Cripto-1又称畸胎瘤衍生因子-1(teratocarcinoma-derived growth factor-1,TDGF-1),是表皮生长因子-CFC家族成员之一。研究发现Cripto-1可通过促进肿瘤细胞增殖、迁移、侵袭、血管生成以及诱导上皮-间质转化(epithelialmesenchymal transition,EMT)而在多种恶性肿瘤的发生、发展中起重要作用[3-8]。本研究通过检测Cripto-1、上皮标记物E-钙黏蛋白(E-cadherin)、间叶标记物N-钙黏蛋白(N-cadherin)和波形蛋白(vimentin)在食管癌中的表达,探讨Cripto-1在食管癌发生、发展过程中的作用及其与EMT的关系。
1 材料与方法
1.1 标本 收集2011年4-9月在重庆医科大学附属第一医院胸心外科行手术治疗的41例食管癌患者的癌灶中心组织、癌旁(距癌灶边缘5cm以内)组织及正常食管黏膜(手术切缘经病理证实无肿瘤细胞)组织标本。41例患者中,男28例,女13例,年龄42~75岁,平均54岁,所有患者术前均未进行新辅助放/化疗及生物治疗,均经病理检查明确诊断。标本离体后迅速采集并分为两份,一份置于液氮中,24h后转入-80℃冰箱保存,另一份用10%中性甲醛固定备用。
1.2 主要试剂 兔抗人Cripto-1、N-钙黏蛋白、E-钙黏蛋白、波形蛋白单抗购自美国Epitomics公司;内参GAPDH一抗购自北京四正柏生物科技有限公司;山羊抗兔二抗、凯基全蛋白提取试剂盒购自凯基生物科技有限公司;Western blotting配胶试剂盒、BCA蛋白定量试剂盒、ECL发光试剂盒、PVDF膜购自江苏碧云天公司;SP免疫组化试剂盒、DAB显色试剂盒、中性树胶、苏木素染液购自北京康为世纪公司;磷酸盐缓冲液、枸橼酸钠抗原修复液购自北京中杉金桥生物技术有限公司;Trizol、RTPCR反转录试剂盒、Premix Taq酶、DNA Marker购自TaKaRa(大连宝生物)公司。
1.3 RT-PCR检测Cripto-1 mRNA的表达 按照Trizol试剂盒说明书提取组织总RNA,采用TaKaRa公司反转录试剂盒合成cDNA。反应条件:94℃3min;94℃ 30s,61℃ 30s,72℃ 30s,40个循环;72℃ 4min。PCR扩增产物经2%琼脂糖凝胶电泳分离,采用Bio-Rad凝胶成像仪成像,Quantity-One软件对条带吸光度值进行半定量分析,以目的条带吸光度值/内参条带吸光度值的比值作为目的基因的相对表达量。引物由北京华大基因设计并合成,相关引物序列如下:Cripto-1上游引物5'-CACGATGTGCGCAAAGAGA-3',下游引物5'-TGACCGTGCCAGCATTTACA-3',扩增长度89bp;GAPDH上游引物5'-AAGGTGAAGGTCGGAAC-3',下游引物5'-GGGGTCATTGATGGCAACAAT-3',扩增长度102bp。
1.4 Western blotting检测Cripto-1蛋白表达 提取组织总蛋白,BCA法定量。上样量40μg,采用10%SDS-PAGE凝胶电泳分离,采用湿法转膜(1kD/min)至PVDF膜,用含5%脱脂奶粉的TBST封闭液封闭1h后加入一抗,抗体的稀释比例Cripto-1为1∶2000,GAPDH为1∶5000,4℃孵育过夜,TBST洗膜后加入山羊抗兔二抗(1∶5000),室温孵育1h,TBST洗膜后ECL发光。用Quantity-One软件对条带的吸光度值进行半定量分析,以目的蛋白条带的吸光度值/内参GAPDH蛋白条带的吸光度值的比值表示目的蛋白的相对量。
1.5 免疫组化检测Cripto-1、N-钙黏蛋白、E-钙黏蛋白、波形蛋白的表达 所有标本经10%中性甲醛固定,石蜡包埋,4μm连续切片,二甲苯脱蜡,梯度乙醇水化,0.01mol/L枸橼酸钠缓冲液抗原热修复,内源性过氧化物酶37℃封闭20min;加一抗(抗体稀释比例Cripto-1为1∶200,N-钙黏蛋白、E-钙黏蛋白、波形蛋白为1∶250),4℃孵育过夜;加二抗37℃孵育30min;加入辣根过氧化物酶(HRP)37℃孵育20min;DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下检测并拍照。染色结果根据阳性细胞染色强度及阳性细胞百分数进行分级[9]。阳性细胞百分数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;细胞染色强度:无着色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。阳性强度为两种计分乘积:0~2分为阴性(-)、3~5分为弱阳性(+)、6~8分为阳性()、9~12分为强阳性()。结果判定由两位病理科医师分别进行,取平均值。
1.6 统计学处理 采用SPSS 17.0软件进行统计分析,计量资料以x±s表示,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用Tukey检验,相关性分析采用Spearman分析,P<0.05为差异有统计学意义。
2 结 果
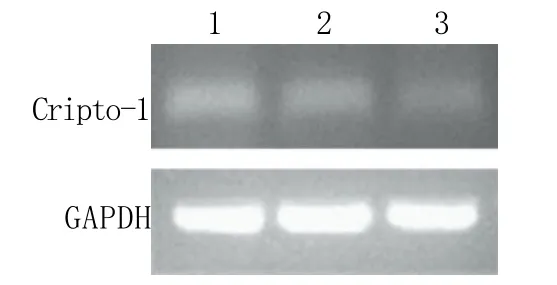
图1 Cripto-1 mRNA相对表达水平检测Fig.1 Expression of Cripto-1 mRNA detected by RT-PCR1. Esophageal carcinoma; 2. Paraneoplastic tissue; 3. Normal esophageal tissue
2.1 Cripto-1 mRNA表达检测结果 Cripto-1 mRNA在食管癌组织中的表达(0.35±0.08)明显高于癌旁组织(0.22±0.04)及正常食管黏膜组织(0.13±0.03,P<0.05),而癌旁组织与正常食管黏膜组织中的表达差异无统计学意义(P>0.05,图1)。
2.2 Cripto-1蛋白表达检测结果 Cripto-1蛋白在食管癌组织中的表达(0.62±0.06)明显高于癌旁组织(0.45±0.07)及正常食管黏膜组织(0.33±0.05,P<0.05),而癌旁组织与正常食管黏膜组织中的表达差异无统计学意义(P>0.05,图2)。
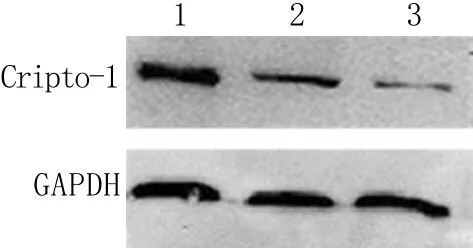
图2 Cripto-1蛋白表达水平检测Fig.2 Expression of Cripto-1 protein detected by Western blotting 1. Esophageal carcinoma; 2. Paraneoplastic tissue; 3. Normal esophageal tissue
2.3 Cripto-1、N-钙黏蛋白、E-钙黏蛋白、波形蛋白表达的免疫组化检测结果 Cripto-1、N-钙黏蛋白阳性着色位于细胞膜和细胞质,E-钙黏蛋白阳性着色位于细胞膜,波形蛋白阳性着色位于细胞质(图3)。Cripto-1、N-钙黏蛋白、波形蛋白、E-钙黏蛋白在食管癌组织中的阳性表达率分别为53.7%、51.2%、61.0%、36.6%。
2.4 Critpo-1在食管癌中的表达与临床病理资料的关系 Cripto-1在不同性别、年龄、侵袭范围及临床分期中的表达情况见表1。统计学分析显示,Cripto-1在食管癌中的表达与患者的年龄、性别和浸润范围无显著相关性(P>0.05),与淋巴结转移、远处转移及临床分期显著相关(P<0.05,表1)。
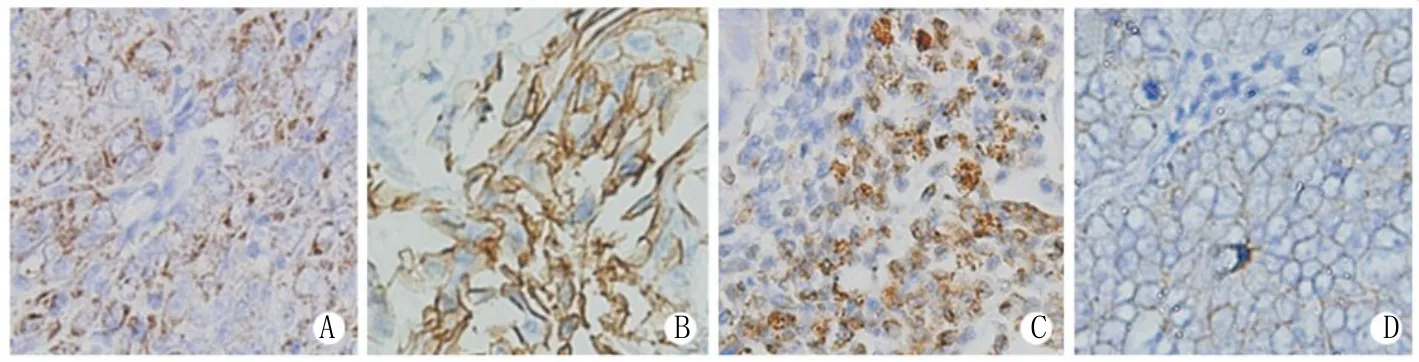
图3 Cripto-1、N-钙黏蛋白、波形蛋白、E-钙黏蛋白在食管癌组织中的表达(SP ×400)Fig.3 Expression of Cripto-1, N-cadherin, vimentin, E-cadherin protein in esophageal carcinoma tissue (SP ×400)A. Cripto-1; B. N-cadherin; C. Vimentin; D. E-cadherin
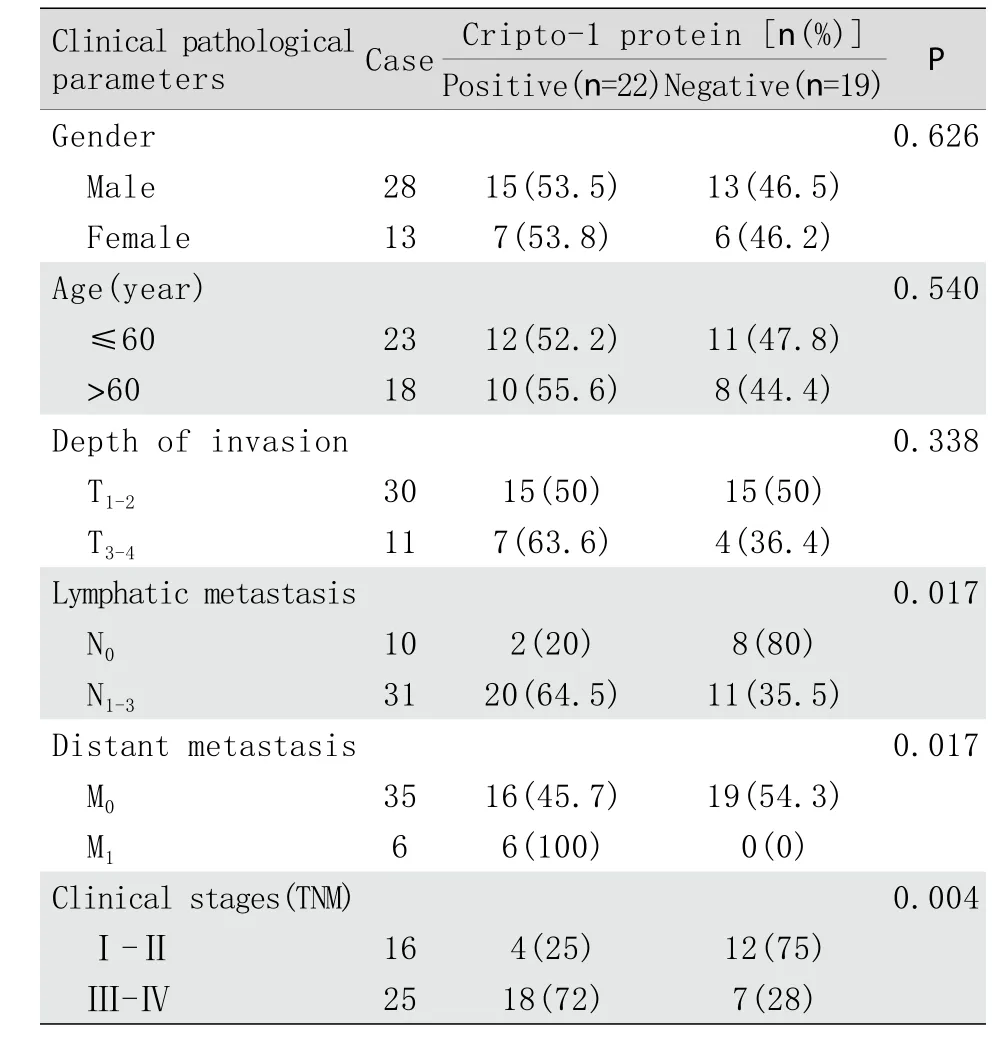
表1 食管癌组织中Cripto-1蛋白表达与临床病理资料的关系(n=41)Tab.1 Relationship between the expression of Cripto-1 protein and clinical pathological parameters in esophageal carcinoma tissue (n=41)
2.5 Cripto-1蛋白与N-钙黏蛋白、E-钙黏蛋白、波形蛋白表达的相关性 Spearman相关分析显示,食管癌组织中Cripto-1的表达与N-钙黏蛋白和波形蛋白的表达呈正相关(r=0.463,r=0.460,P<0.05),与E-钙黏蛋白的表达呈负相关(r=-0.310,P<0.05,表2)。

表2 食管癌中Cripto-1与N-钙黏蛋白、E-钙黏蛋白、波形蛋白表达的相关性分析Tab.2 The correlation between the expression of Cripto-1 and N-cadherin, E-cadherin, Vimentin in esophageal carcinoma
3 讨 论
Cripto-1基因位于人常染色体3p21.3,是表皮生长因子-CFC家族成员之一,最先由人畸胎瘤cDNA文库中分离出来,因此又称TDGF-1,具有调节细胞分化及胚胎发育的功能。Cripto-1在成人组织中的表达水平非常低,但在细胞发生恶变时的表达水平明显增高[3]。研究发现Cripto-1在多种恶性肿瘤,如胃癌、结肠癌、肺癌、乳腺癌、宫颈癌、皮肤黑色素瘤及口腔鳞状细胞癌等组织中过表达,而在正常组织中不表达或低表达[3-5],提示Cripto-1表达增高可能是这些恶性肿瘤发生过程中的早期事件。体外研究表明,过表达Cripto-1可提高人乳腺癌细胞的生长速度、抗凋亡及迁移、侵袭能力[6];体内研究发现,与对照组比较,Cripto-1基因沉默后的人鼻咽癌CNE-2细胞小鼠移植瘤生长明显受抑[7]。
本研究通过RT-PCR和Western blotting检测41例食管癌患者的癌组织、癌旁组织及正常食管黏膜组织中Cripto-1蛋白及mRNA表达情况,结果显示,Cripto-1 mRNA及蛋白在食管癌组织中的表达均高于癌旁组织和正常食管黏膜组织(P<0.05),提示Cripto-1可能在食管癌的发生中发挥作用,检测其表达水平可能为食管癌的早期诊断提供参考。
Cripto-1不仅与肿瘤的发生有关,还与肿瘤的侵袭转移潜能有关[3]。本研究采用免疫组化方法检测了Cripto-1在食管癌组织中的表达,并分析了其与患者临床病理资料的关系,结果显示Cripto-1在食管癌中的表达与患者的年龄、性别和浸润范围无明显相关(P>0.05),但与淋巴结转移、远处转移及临床分期(TNM)显著相关(P<0.05),提示Cripto-1在食管癌的侵袭、转移过程中可能具有重要作用,检测食管癌组织中Cripto-1表达水平可能对食管癌的恶性程度评估及预后判断有一定参考价值。
Strizzi等[10]发现Cripto-1在体外鼠乳房上皮细胞和体内鼠乳房肿瘤细胞中可通过调控EMT的发生而促进侵袭和转移。EMT是具有极性的上皮细胞转换成能够在细胞基质间自由移动的细胞的过程,细胞在此过程中获得浸润和迁移的能力[11]。EMT是肿瘤侵袭、转移的主要机制之一,以上皮细胞极性的消失及间质特性的获得为重要特征[12-13]。E-钙黏蛋白是常用的上皮标志物,而N-钙黏蛋白和波形蛋白是较为公认的间质标记物。我们采用免疫组化检测食管癌组织EMT标记物表达情况,并对Cripto-1与EMT标记物间的相关性进行分析,结果显示食管癌组织中Cripto-1表达与N-钙黏蛋白表达呈正相关(r=0.463,P<0.05),与波形蛋白表达呈正相关(r=0.460,P<0.05),与E-钙黏蛋白表达呈负相关(r=-0.310,P<0.05),提示Cripto-1可能通过调控间质和上皮细胞标记物的表达而促进EMT的发生,从而在食管癌的侵袭、转移中发挥重要作用。
综上所述,Cripto-1在食管癌的发生和侵袭转移过程中发挥了重要作用,可为食管癌的早期诊断、分子靶向治疗及预后判断提供重要参考。EMT的发生是多种基因、蛋白和微环境共同作用的复杂过程,Cripto-1可能与受其调控的EMT共同参与了肿瘤的侵袭转移,但具体机制有待进一步研究。
[1] Hongo M, Nagasaki Y, Shoji T. Epidemiology of esophageal cancer∶ Orient to occident. Effects of chronology, Geography and ethnicity[J]. J Gastroenterol Hepatol, 2009, 24(5)∶ 729-735.
[2] Chang KJ, Tian F, Yan R, et al. Effects of pyrrolidine dithiocarbamate on the proliferation,apoptosis and cell cycle in esophageal cancer EC1 cell line[J]. J Zhengzhou Univ (Med Sci), 2012, 47(1)∶ 4-6. [常凯杰, 田芳, 闫苒, 等. 吡咯烷二硫代氨基甲酸对食管癌细胞系EC1增殖、凋亡及细胞周期的影响[J]. 郑州大学学报(医学版), 2012, 47(1)∶ 4-6.]
[3] Strizzi L, Bianco C, Normanno N, et al. Cripto-1∶ a multifunctional modulator during embryogenesis and oncogenesis[J]. Oncogene, 2005, 24(37)∶ 5731-5741.
[4] De Luca A, Lamura L, Strizzi L, et al. Expression and functional role of CRIPTO-1 in cutaneous melanoma[J]. Br J Cancer, 2011,105(7)∶ 1030-1038.
[5] Yoon HJ, Hong JS, Shin WJ, et al. The role of Cripto-1 in the tumorigenesis and progression of oral squamous cell carcinoma[J]. Oral Oncol, 2011, 47(11)∶ 1023-1031.
[6] Normanno N, De Luca A, Bianco C, et al. Cripto-1 overexpression leads to enhanced invasiveness and resistance to anoikis in human MCF-7 breast cancer cells[J]. J Cell Physiol,2004, 198(1)∶ 31-39.
[7] Wu Z, Li G, Wu L, et al. Cripto-1 over-expression is involved in the tumorigenesis of nasopharyngeal carcinoma[J]. BMC Cancer, 2009, 9∶ 315-333.
[8] Rangel MC, Karasawa H, Castro NP, et al. Role of cripto-1 during epithelial-to-mesenchymal transition in development and cancer[J]. Am J Pathol, 2012, 180(6)∶ 2188-2200.
[9] Liu SZ, Wang YJ. Expression and significance of far upstream element binding protein 1 in human esophageal cancer[J]. Med J Chin PLA, 2012, 37(5)∶449-451. [刘世政, 王要军. 远端上游元件结合蛋白1在食管癌中的表达及意义[J]. 解放军医学杂志, 2012, 37(5)∶449-451.]
[10] Strizzi L, Bianco C, Normanno N, et al. Epithelial mesenchymal transition is a characteristic of hyperplasias and tumors in mammary gland from MMTV-Cripto-1 transgenic mice[J]. J Cell Physiol, 2004, 201(2)∶ 266-276.
[11] Damonte P, Gregg JP, Borowsky AD, et al. EMT tumorigenesis in the mouse mammary gland[J]. Lab Invest, 2007, 87(12)∶ 1218-1226.
[12] Tian Y, Zhu R, Wang RQ. Ascl2 knockdown in colon cancer cells led to the reversal of epithelial-mesenchymal transition[J]. Med J Chin PLA, 2013, 38(4)∶ 292-296. [田音, 朱蓉, 汪荣泉. 结肠癌上皮细胞Ascl2表达抑制致EMT逆转的研究[J]. 解放军医学杂志, 2013, 38(4)∶292-296.]
[13] Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002, 2(6)∶ 442-454.
