神经肽CRH对原代大鼠皮层小胶质细胞NO、TNF-α和IL-6释放的影响*
2013-03-28毕燕华宋婷婷陈学群杜继曾
毕燕华,宋婷婷,陈学群,杜继曾
(浙江大学基础医学系神经生物学和生理学研究室,杭州310058)
促肾上腺皮质激素释放激素(corticotropin-releasing hor-mone,CRH)及其受体CRHRs是HPA(hypothalamus-pituitaryadrenal,HPA)轴主要的调节因子,CRH通过其G蛋白偶联受体参与体内各种生理功能,其受体分 CRHR1和 CRHR2,CRHR两种受体在大脑及外周神经系统广泛分布。很多研究发现应激产生的CRH参与神经系统疾病的发生发展,如在阿尔茨海默病中和帕金森疾病中发现CRH的含量急剧下降、CRHR上调以及CRH神经元异常等。同时CRH在外周免疫系统中扮演着一个促炎症的角色,加剧LPS导致的巨噬细胞炎症因子TNF-α和IL-6的mRNA表达,激活粒细胞中的NF-κB活性,产生炎症介质参与免疫炎症反应。
小胶质细胞被认为是中枢神经系统最为重要的免疫细胞,时刻监督着脑内微环境,在生理状态下小胶质细胞呈静息的分枝状态,监督损伤的神经元、感染或斑块等,当小胶质细胞激活后呈现阿米巴样状态,产生神经毒性物质,释放促炎症因子如TNF-α、IL-1β和IL-6等,导致神经元的损伤和凋亡。Jiyeon Ock等发现0~100 nmol/L CRH不影响LPS诱导的BV2细胞NO和IL-1β的产生,而Wei Wang等实验显示10~100 nmol/L CRH可以明显促进原代大鼠小胶质细胞释放TNF-α。但CRH是否直接参与调节小胶质细胞的激活,至今不清楚,本研究试图探讨神经肽CRH是否调节原代大鼠皮层小胶质细胞的激活反应,增加促炎症反应,其受体机制如何?是否可以协同LPS进一步增加炎症反应。
1 材料与方法
1.1 细胞培养
取新生1~2 d的SD大鼠8只,经75%乙醇消毒后,用手术剪将其头剪下,置于铺有预冷解剖液HBSS(1%penicillin streptomycin)的35 mm培养皿中。打开颅骨,取出大脑,用解剖镊除去脑膜其他非皮层组织后,将剩余皮层组织迅速移入预冷的HBSS中。在解剖显微镜下,用解剖刀除去中脑,分离皮层,去除海马,将分离出的皮层放入2 ml 0.25%胰酶37℃消化12 min,消化后的细胞加入细胞培养基(MEM+10%FBS),离心重悬至T-75 cm2培养皿,培养10 d,待细胞培养瓶中细胞长至10 d约98%融合后,轻轻摇晃至小胶质细胞脱落,得到悬浮于培养液的小胶质细胞,2 800 r/min,离心 5 min,加入新鲜的培养基(DMEM+0.1%FBS)混匀,接种于24孔板,放入37℃的培养箱培养 16~24 h后,细胞呈现单级或双极静息分枝状态,胞体无明显空泡,且CD11b鉴定为纯度大于98%以上用于实验研究。
1.2 CRH处理
纯化后的小胶质细胞贴壁培养16~24 h之后,随机将细胞样品分为 5组(n=6):空白对照组;10-15mol/L CRH处理组;10-12mol/L CRH处理组;10-10mol/L CRH处理组和 10 ng/ml LPS处理组,处理24 h之后,收集细胞上清用于实验检测。
1.3 实验方法
1.3.1 NO检测 NO试剂盒来自碧云天生物技术研究所。取细胞培养液上清进行NO检测,取出格里斯试剂I和II,用前恢复至室温。用细胞培养液稀释标准品,使之浓度分别达到 0,1,2,3,4,5,6,8,10,20,40,60,100μmol/L。按照每孔 50 μl,在96孔板中加入标准品及样品,其次按照每孔50μl,在各孔中加入格里斯试剂I,再次按照每孔50μl,在各孔中加入格里斯试剂II。避光反应5 min。570 nm测定吸光度。
1.3.2 ELISA检测TNF-α和IL-6 将所需酶标板、稀释好的ABC和 TMB显色液在 37℃平衡 30 min。稀释标准品,将4 000 pg/ml,2 000 pg/ml,1 000 pg/ml,500 pg/ml,250 pg/ml,125 pg/ml,62.5 pg/ml,31.25 pg/ml依次加入孔中,另 1孔只加样品稀释液的作为零孔。加细胞上清100μl,10 ng/ml LPS处理过的细胞(阳性对照)上清稀释10倍之后加入100μl。酶标板上加盖,37℃反应90 min。弃酶标孔中的液体,不洗。将准备好的生物素抗大鼠TNF-α或IL-6抗体工作液按每孔0.1 ml依次加入。37℃反应 60 min。0.01 mol/L PBS洗涤 3次,每次浸泡1 min左右。将准备好的ABC工作液按每孔0.1 ml依次加入。37℃反应30 min。0.01 mol/L PBS洗涤5次,每次浸泡1~2 min。按每孔90μl依次加入已在37℃平衡30 min的TMB平衡液,37℃避光反应20~25 min。按每孔0.1 ml依次加入TMB终止液。用酶标仪在450 nm测定吸光值后换算为相应浓度。
1.4 统计学处理
数据用均数 ±标准误(¯x±s¯x)表示,用 SPSS 15.0软件分析,两组间比较采用 t检验。
2 结果
2.1 神经肽CRH刺激原代大鼠皮层小胶质细胞产生NO,TNF-α和 IL-6
不同浓度的 CRH(10-15、10-12和 10-10mol/L)孵育小胶质细胞24 h后,与空白对照组比较,发现10-15mol/L CRH可以促进小胶质细胞产生 NO、TNF-α和 IL-6(P<0.01,图 1 A、B和C)。不同浓度的 CRH(10-15、10-12和 10-10mol/L)孵育小胶质细胞30 min后,加入10 ng/ml LPS孵育24 h后,与单独 LPS组比较,10-15mol/L CRH可以促进小胶质细胞产生NO,TNF-α和IL-6(P<0.05,图 1 D、E和 F)。
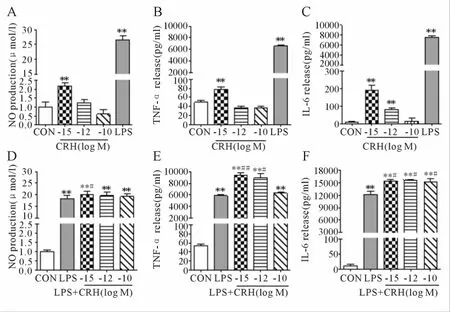
Fig.1 Effect of CRH on proinflammatory molecule NO,TNF-α and IL-6 production in microglia(¯x±s¯x,n=6)Microglia were treated by 10-15 mol/L CRH for 24 hours(A,B and C).Microglia were pretreated 10-15 mol/L CRH for 30 min followed by treatment with 10 ng/ml LPSfor 24 hours(D,E and F)
2.2 CRHR1拮抗剂可以阻断CRH诱导的原代大鼠皮层小胶质细胞NO的产生
CRHR1拮抗剂10-12mol/L CP154,526处理原代皮层小胶质细胞30 min后加入10-15mol/L CRH孵育 24 h,发现 10-12mol/L CP154,526能完全阻断 10-15mol/L CRH诱导皮层小胶质细胞产生的 NO(P<0.01 vs 10-15mol/L CRH组,图 2A)。此外10-12mol/L CRHR1拮抗剂CP154,526处理原代皮层小胶质细胞30 min后,加入10-15mol/L CRH孵育30 min,再加入10 ng/ml LPS孵育 24 h,发现 10-12mol/L CP154,526能完全阻断10-15mol/L CRH+LPS诱导皮层小胶质细胞NO的产生(P<0.01 vs 10-15mol/L CRH +LPS组,图 2B)。
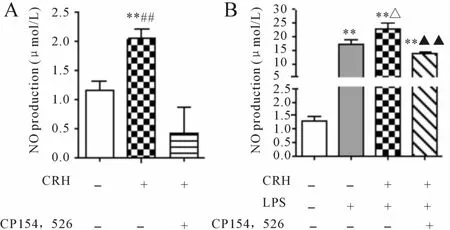
Fig.2 Inhibitory effect of CRHR1 specific antagonist CP154,526 on microglia NOproduction(¯x±s¯x,n=6)
3 讨论
小胶质细胞被认为是中枢神经系统的免疫细胞,参与脑内免疫炎症反应,调节神经元的保护或损伤,突触剪切和神经递质的释放等。静息的小胶质细胞在脑内起到免疫监督作用,时刻监督脑内微环境的变化,当小胶质细胞激活后,吞噬功能增强,促炎症因子和活性氧物质释放增多,导致神经元的凋亡甚至死亡。脑损伤、低氧、缺血以及神经退行性疾病(AD和PD),常伴随着脑内炎症的出现,诱导小胶质细胞激活,小胶质细胞的激活经常被认为是神经元凋亡的前期标志[1]。NO是由激活的小胶质细胞iNOS产生,同时参与调节小胶质细胞的吞噬功能变化,可致细胞毒性,损伤神经元[2]。本研究证明CRH能促进小胶质细胞释放促炎症介质NO、TNF-α和IL-6,并且在1 f mol/L浓度下明显刺激小胶质细胞产生NO,提示CRH在低浓度时即可参与小胶质细胞释放促炎症介质NO,可能是中枢神经系统异常的基础。
CRH参与了众多生理学应激反应,加重中风之后的损伤,CRH在外周参与免疫炎症反应[3-4],另外在LPS诱导的内毒素休克小鼠模型中,Agelaki S et al发现CRH增强巨噬细胞产生促炎症因子IL-1、TNF-α和IL-6的释放。Jiyeon Ock等发现CRH诱导小鼠前脑原代小胶质细胞和BV2细胞(小胶质细胞的小鼠细胞系)凋亡来调节神经炎症反应,但没有证实CRH是否直接参与小胶质细胞激活。早期Wei Wang等发表的结果认为CRH通过MAPK途径诱导原代大鼠小胶质细胞增殖和分泌TNF-α,以后Yang等报道CRH调节小鼠小胶质细胞分泌IL-18。Mei-Jen Wang等研究显示Urocortin调节大鼠和BV2小胶质细胞激活导致的神经元损伤是通过PI3/Akt通路和GSK-3β通路,而并非是经典的cAMP通路[5]。我们的结果显示CRH和 LPS可以协同刺激小胶质细胞激活,并产生TNF-α和IL-6,提示CRHR受体的信号通路和LPS的信号通路可能有交叉对话,P38/MAPK是CRH和LPS共同通路的交叉部分,CRH增强LPS诱导小胶质细胞激活过程中,CRH+LPS诱导产生的促炎症介质NO、TNF-α和IL-6比单独LPS明显升高,并且CRH和LPS协同诱导的小胶质细胞释放促炎症介质,也可被CRHR1特异性拮抗剂CP154,526完全阻断。
本实验提示CRH不仅通过CRHR1参与调节小胶质细胞的激活,还同时调节LPS诱导的小胶质细胞激活。CRH作为应激反应中的重要调控因子,可能通过小胶质细胞调节CNS的免疫反应,当脑内出现炎症反应时,CRH通过CRHR1和TRL4交叉对话,进一步加剧免疫炎症反应,导致神经系统功能失调。提示应激诱导的CRH变化可能通过CRHR1和TRL4分子交叉对话加剧神经系统功能失调和临床症状,信号通路的交叉对话点可能成为小胶质细胞功能相关分子机制研究的基础和未来临床干预的靶点。为改善中枢神经系统的神经退行性疾病进程提供新的研究思路和干预目标。
[1] Perry VH,Nicoll JA,Holmes C.Microglia in neurodegenerative disease[J].Nat Rev Neurol,2010,6(4):193-201.
[2] Monsonego A,Weiner HL.Immunotherapeutic approaches to Alzheimer’s disease[J].Science,2003,302(5646):834-838.
[3] Wang W,Nan X,Ji PD,et al.Corticotropin releasing hormone modulates endotoxin-induced inflammatory cytokine expression in human trophoblast cells[J].Placenta,2007,28(10):1032-1038.
[4] Chen XQ,Kong FP,Zhao Y,et al.High-altitude hypoxia induces disorders of the brain-endocrine-immune network through activation of corticotropin-releasing factor and its type-1 receptors[J].Chin J Appl Physiol,2012,28(6):481-487.
[5] Wang MJ,Lin SZ,Kuo JS,et al.Urocortin modulates inflammatory response and neurotoxicity induced by microglial activation[J].J Immunol,2007,179(9):6204-6214.
