长春地区部分医院革兰阴性杆菌16S rRNA甲基化酶基因的检测及其意义
2013-03-23周佳琦史红艳黄金凤孙延波
周佳琦,史红艳,徐 花,黄金凤,孙延波
(1.吉林大学白求恩医学院病原生物学系,吉林 长春 130021;2.辽宁省大连市科兴疫苗技术有限公司,辽宁 大连 116620)
氨基糖苷类抗生素对大多数革兰阴性菌及阳性菌均有较强的抗菌活性,由于其抗菌谱广、疗效好,受到临床医生的广泛欢迎。但抗生素的不合理使用所造成的细菌耐药性问题日益突出。近年来,革兰阴性杆菌的核糖体16S rRNA甲基化已成为一种对氨基糖苷类抗生素产生耐药的新机制。最新研究[1-2]显示:革兰阴性杆菌的核糖体30S亚基的甲基化是通过16S rRNA的甲基化酶来实现的。16S rRNA甲基化酶可以保护核糖体30S亚基的作用靶位,导致氨基糖苷类抗生素不能与核糖体30S亚基结合。16S rRNA甲基化酶armA型基因在法国首次发现[3]以来,其他基因类型如rmtB、rmtA和rmtC在革兰阴性杆菌中也相继被发现[4-5]。在我国的南方地区主要以armA型和rmtB型为主[6],而长春地区则未见报道。由于16S rRNA甲基化酶可使细菌对多种氨基糖苷类抗生素高水平耐药,而革兰阴性杆菌又是医院内感染重要的致病菌[7]。本研究通过测定革兰阴性杆菌对阿米卡星和庆大霉素的耐药性,进而阐明革兰阴性杆菌16S rRNA甲基化酶的分布和基因型,为本地区细菌耐药的流行病学和临床医师合理应用氨基糖苷类抗生素提供依据。
1 材料与方法
1.1 菌株和药品 116株革兰阴性杆菌分别来自吉林大学中日联谊医院、长春中医药大学附属医院和吉林省人民医院检验科(包括33株大肠埃希菌、25株肺炎克雷伯菌、14株阴沟肠杆菌、15株鲍曼不动杆菌、19株铜绿假单胞菌和10株黏质沙雷氏菌)。上述菌株经法国生物梅里埃公司VITEK-32全自动微生物分析系统鉴定。阿米卡星由中国药品生物制品检定所提供,批号130335-200204;庆大霉素由北京鼎国昌盛生物技术有限公司提供,批号1B310330。
1.2 药敏试验 采用琼脂稀释法测定116株革兰氏阴性杆菌对阿米卡星和庆大霉素的敏感性,药物浓度超过16mg·L-1细菌仍生长判定为耐药,2~8mg·L-1为中间,低于2mg·L-1为敏感。
1.3 细菌处理 取菌液1mL置于1.5mL离心管,10000r·min-1离心1min,弃上清加入100μL TE Buffer(1mol·L-1Tris-HCl,pH8.0;500mmol·L-1EDTA,pH8.0),加入等体积酚/氯仿/异戊醇(25∶24∶1),涡旋震荡30s,10000r·min-1离心5min,上清液即为基因检测的模板,-20℃冰箱保存备用。
1.4 16S rRNA甲基化酶基因的引物设计及检测根据GenBank查询6种16S rRNA甲基化酶基因序列,并利用Oligo 5.0软件设计引物。6种靶基因引物序列和产物长度见表1。PCR产物长度<500bp的反应条件:93℃、2min;93℃、1min,55℃、1min,72℃、1min,35个循环;72℃、5min。PCR产物长度<500bp的反应条件:93℃、5min;93℃、30s,55℃、30s,72℃、1min,35个循环;72℃、5min。PCR产物经2%琼脂糖凝胶电泳,通过凝胶成像仪观察PCR产物并拍照。
1.5 PCR产物测序 PCR产物送北京六合华大基因科技股份有限公司测序,利用Chromas读序软件将测得序列与GenBank发布的序列进行比对。

表1 不同16S rRNA甲基化酶基因型的引物序列Tab.1 Primer sequences of different genotypes of 16S rRNA methylase
2 结 果
2.1 药敏试验结果 116株革兰阴性杆菌中有16株大肠埃希菌、1株肺炎克雷伯菌、3株阴沟肠杆菌、11株鲍曼不动杆菌、9株铜绿假单胞菌和9株黏质沙雷氏菌对阿米卡星呈现耐药,即最低抑菌浓度超过16mg·L-1(表2)。庆大霉素的药敏试验显示:26株大肠埃希菌、11株肺炎克雷伯菌、8株阴沟肠杆菌、15株鲍曼不动杆菌、17株铜绿假单胞菌和10株黏质沙雷氏菌呈现耐药(表3)。
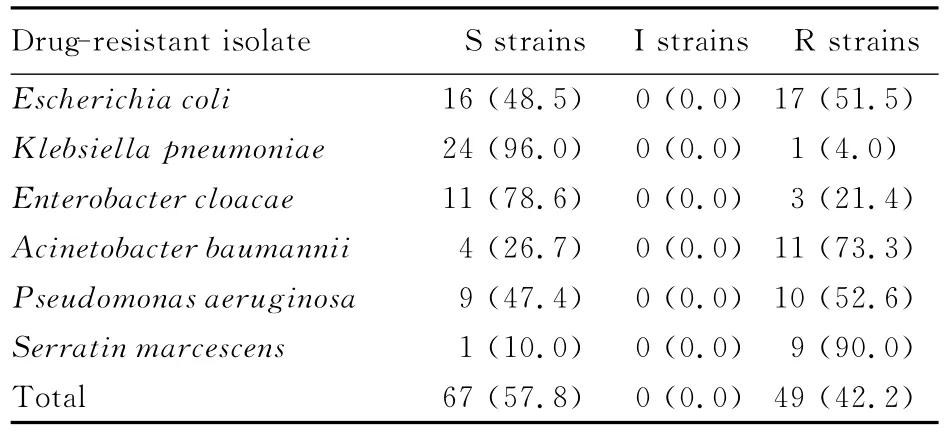
表2 革兰阴性杆菌对阿米卡星的药敏率Tab.2 Susceptibilities of gram-negative bacilli to amikacin[n(η/%)]

表3 革兰阴性杆菌对庆大霉素的药敏率Tab.3 Susceptibilities of gram-negative bacilli to gentamicin[n(η/%)]
2.2 16S rRNA甲基化酶基因检测结果 在116株革兰阴性杆菌中16S rRNA甲基化酶基因的总检出率为43.1%(50/116),其中armA和rmtB的检出率分别为12.1%(14/116)和31.0%(36/116),而rmtA、rmtC、rmtD与npmA基因均为阴性(表4)。此外,有3株黏质沙雷氏菌同时携带armA和rmtB基因,这3株细菌对阿米卡星和庆大霉素均呈高度耐药。armA和rmtB基因PCR扩增产物电泳结果见图1。
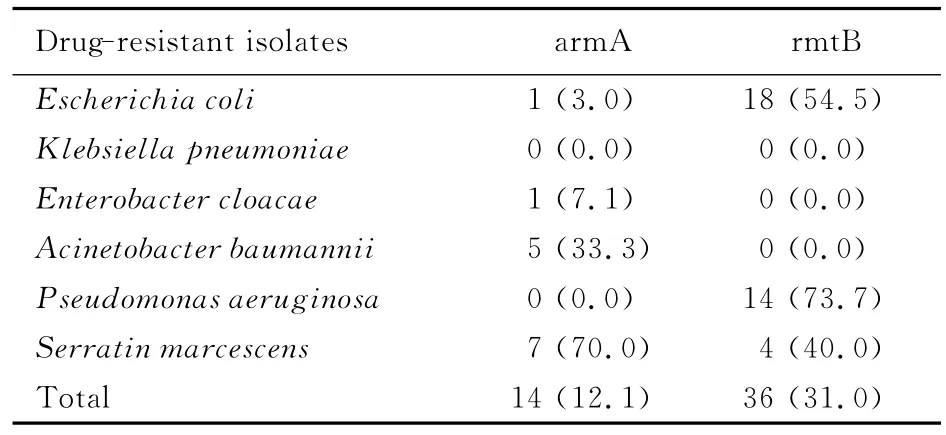
表4 16S rRNA甲基化酶基因检测结果Tab.4 Detection results of 16S rRNA methylase genes[n(η/%)]
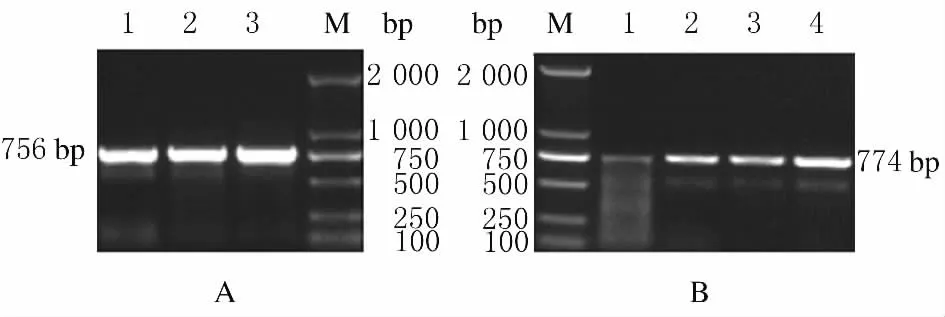
图1 16S rRNA甲基化酶基因的PCR扩增产物电泳图Fig.1 Electrophoregram of PCR products of 16S rRNA methylase genes
2.3 16S rRNA甲基化酶基因序列分析 2种16S rRNA甲基化酶基因测序结果与GenBank数据库比对,序列完全一致。
3 讨 论
氨基糖苷类抗生素通过与细菌核糖体30S亚基的16S rRNA的A位解码区核苷酸形成氢键,干扰细菌蛋白质的合成,从而发挥抗菌作用。此类抗生素抗菌谱广,与其他抗生素有协同作用[8],是目前治疗革兰阴性、阳性菌感染的重要药物,也是耐多药革兰阴性菌感染常用的联合治疗药物[9]。但由于逐年泛用和过度使用,细菌对氨基糖苷类抗生素耐药问题也日益严重,细菌对该类抗生素耐药可通过酶修饰、细胞膜渗透性改变、外排泵活性、phoP-phoQ系统和16S rRNA甲基化酶的活性来实现[10-12]。在这些机制中,以质粒或染色体介导的16S rRNA甲基化酶是较为普遍的。16S rRNA甲基化酶通常由质粒编码,质粒的转移可导致16S rRNA甲基化酶基因在细菌间的快速传播[13-15],给临床治疗造成极大的困难。
本研究结果显示:116株革兰阴性杆菌对阿米卡星与庆大霉素的耐药率分别为42.2%和75.0%,除肺炎克雷伯菌与阴沟杆菌对2种抗生素耐药率稍低,其他革兰阴性杆菌的耐药率均高于50%,说明本地区革兰阴性杆菌对氨基糖苷类抗生素耐药率较高。16S rRNA甲基化酶基因的检测结果表明:rmtB基因阳性率(31.0%)高于armA基因(12.1%),rmtB主要存在于大肠埃希菌(54.5%)和铜绿假单胞菌(73.7%)中,而armA主要存在于鲍曼不动杆菌(33.3%)与黏质沙雷氏菌(70%)中。在25株肺炎克雷伯菌中未检出16S rRNA甲基化酶基因;14株阴沟杆菌中仅检出1株rmtB基因,检出率为7.1%。此外,有3株黏质沙雷氏菌同时携带这2种基因,对2种抗生素均呈高度耐药。本研究显示:116株革兰阴性杆菌的耐药率高于16S rRNA甲基化酶基因的检出率,即细菌的耐药表型与16S rRNA甲基化酶基因之间并非完全一致,说明革兰阴性杆菌对氨基糖苷类抗生素耐药可能还存在其他的耐药机制,如产生AME基因、细胞膜渗透性改变、外排泵活性和phoP-phoQ系统等。
从16S rRNA甲基化酶基因类型的分布看,本研究只检出armA与rmtB基因,提示本地区16S rRNA甲基化酶基因主要是armA与rmtB,这与国内相关研究的结论是一致的[16-18]。目前,在亚洲其他国家如韩国[19]和日本[20]检出的基因型也以rmtB和armA为主。欧洲国家如比利时[21]和保加利亚[22]主要流行armA,而南美洲的巴西则以rmtB为主[23]。
总之,16S rRNA甲基化酶的出现给氨基糖苷类抗生素的临床应用带来挑战,临床医生应高度重视合理用药以减少细菌在抗菌药物选择性压力下不断产生的耐药性。
[1]Yokoyama K,Doi Y,Yamane K,et al.Acquisition of 16S rRNA methylase gene in Pseudomonas aeruginosa[J].Lancet,2003,362(9399):1888-1893.
[2]余方友.16S rRNA甲基化酶导致的氨基糖苷类抗生素高水平耐药研究进展[J].实验与检验医学,2011,29(5):463-468.
[3]Galimand M,Courvalin P,Lambert T.Plasmid-mediated high level resistance to aminoglycoside in Enterobacteriaceae due to 16S rRNA methylation[J].Antimicrob Agents Chemother,2003,47(8):2565-2571.
[4]Wachino J,Yamane K,Shibayama K,et al.Novel plasmidmediated 16S rRNA methylase,rmtC,found in a Proteous mirabilis isolate demonstrating extraordinary high-level resistance against various aminoglycosides[J].Antimicrob Agents Chemother,2006,50(1):178-184.
[5]Yamane K,Wachino J,Doi Y,et al.Global spread of multiple aminoglycoside genes[J].Emerg Infect Dis,2005,11(6):951-953.
[6]Yu F,Wang L,Pan J,et al.Prevalence of 16S rRNA methylase genes in Klebsiella pneumoniae isolates from a Chinese teaching hospital:coexistence of rmtB and armA genes in the same isolate[J].Diagn Microbiol Infect Dis,2009,64(1):57-63.
[7]李蓓涵,张学英,李菁华,等.长春地区部分医院革兰阴性杆菌超广谱β-内酰胺酶的基因类型及分布[J].吉林大学学报:医学版,2010,36(1):205-209.
[8]朱健铭,肖丹宇,姜如金,等.多药耐药肺炎克雷伯菌氨基糖苷类修饰酶与16S rRNA甲基化酶基因研究[J].中华医院感染学杂志,2012,22(17):3690-3693.
[9]何 龙,杨启文.革兰阴性杆菌16S rRNA甲基化酶耐药研究进展[J].检验医学与临床,2012,9(4):456-457.
[10]Kotra L,Haddad J,Mobashery S.Aminoglyeosides:perspectives on mechanisms of action and resistance and strategies to counter resistance[J].Antimicrob Agents Chemother,2000,44(12):3249-3256.
[11]Islam S,Oh H,Jalal S,et al.Chromosomal mechanisms of aminoglycoside resistance in Pseudomonas aeruginosa isolates from cystic fibrosis patients[J].Clin Microbiol Infect,2009,15(1):60-66.
[12]Macfarlan E,Kwasnicka A,Hancock R.Role of Pseudomonas aeruginosa PhoP-PhoQ in resistance to antimicrobial cationic peptides and aminoglycosides[J].Microbiology,2000,146(10):2543-2554.
[13]Doi Y,Ghilardi AC,Adams J,et al.High prevalence of metallo-β-lactamase and 16S rRNA methylase coproduction among imipenem-resistant Pseudomonas aeruginosaisolates in Brazil[J].Antimicrob Agents Chemother,2007,51(9):3388-3390.
[14]Wachino J Arakawa Y.Exogenously acquired 16S rRNA methyltransferases found in aminoglycoside-resistant pathogenic Gram-negative bacteria:an update[J].Drug Resist Update,2012,15(3):133-148.
[15]Park YJ.Aminoglycoside resistance in gram-negative bacilli[J].Korean J Clin Microbiol,2009,12(2):57-61.
[16]崔 进,赵水娣,秦 湧,等.多药耐药铜绿假单胞菌氨基糖苷类耐药相关基因研究[J].中华医院感染学杂志,2010,20(20):3099-3012.
[17]李玉珍,吴燕峰,李红玉,等.庆大霉素耐药阴沟肠杆菌16S rRNA甲基化酶基因的研究[J].中国微生态学杂志,2011,23(7):612-614.
[18]周佳琦,卢佳睿,徐 花,等.长春部分医院革兰阴性杆菌氨基糖苷类修饰酶基因的检测[J].吉林大学学报:医学版,2013,39(2):405-409.
[19]Gurung M,Moon D,Tamang M,et al.Emergence of 16S rRNA methylase gene armA and cocarriage of blaIMP-1in Pseudomonas aeruginosa isolates from South Korea[J].Diagno Microbiol Infect Dis,2010,68(4):468-470.
[20]Doi Y,Yokoyama K,Yamane K,et al.Plasmid-mediated 16S rRNA methylase in serratia marcescens conferring high level resistance to aminoglycosides[J].Antimicrob Agents Chemother,2004,48(2):491-496.
[21]Bogaerts P,Galimand M,Bauraing C,et al.Emergence of ArmA and RmtB aminoglycoside resistance 16S rRNA methylases in Belgium[J].J Antimicrob Chemother,2007,59(3):459-464.
[22]Sabtcheva S,Saga T,Kantardjiev T,et al.Nosocomial spread of armA-mediated high-level aminoglycoside resistance in Enterobacteriaceae isolates producing CTX-M-3betalactamase in a cancer hospital in Bulgaria[J].J Chemother,2008,20(5):593-599.
[23]Doi Y,Oliveira G,Adams J,et al.Coproduction of novel 16S rRNA methylase RmtD and metallo-β-lactamase SPM-1in apanresistant Pseudomonas aeruginosa isolate from Brazil[J].Antimicrob Agents Chemother,2007,51(3):852-856.
