辛伐他汀对血管内皮祖细胞复制性衰老的抑制作用及其机制
2013-03-23李自成
杜 岗,周 丽,常 青,李自成
(1.暨南大学附属第一医院心内科,广东 广州 510630;2.暨南大学医学院组织学与胚胎学系,广东 广州 510632)
血管内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮细胞的前体,是以CD133、KDR和CD34为标志的一类细胞[1]。EPCs于1997年首次在人体外周血中发现[2],其不仅参与胚胎血管生成,而且在出生后成体血管新生过程中也发挥重要作用。正常人外周血循环中有一定数量的来源于骨髓的EPCs维持血管壁的完整性,研究[3]表明:新生血管中有相当一部分内皮细胞是由EPCs直接分化而来的。EPCs在体内和体外都存在一个衰老的过程,故难形成稳定的细胞株。他汀类药物在临床广泛应用,其疗效明确,同时有文献[4]报道他汀类药物可以提高EPCs的数量和质量,但他汀类药物对EPCs复制性衰老的影响国内外尚未见报道。本研究通过观察辛伐他汀对体外EPCs复制性衰老的影响,进一步阐明他汀类药物延缓EPCs复制性衰老的机制。
1 材料与方法
1.1 血液、主要试剂和仪器 人脐静脉血采自暨南大学附属第一医院产科健康产妇;EGM-2MV培养基(LONZA公司,瑞士),人淋巴细胞分离液LymphoprepTM(AXIS-SHIELD公司,挪威),胎牛血清(HyClone公司,美国),小鼠抗人CD34(BD公司,美国),小鼠抗人CD133(Miltenyi公司,德国),兔抗人KDR(Bioworld公司,美国),AnnexinV/PI试剂盒(深圳晶美生物工程有限公司,中国),Bcl-2PE(Invitrogen公司,美国),羊抗兔IgG及DAB显色试剂盒(北京中杉公司,中国),其他试剂均为国产分析纯;流式细胞仪(Beckman-Coulter公司,型号:ELITE,美国),光学显微镜(Olympus公司,型号:BX51,日本)。
1.2 EPCs的分离与培养 肝素抗凝管采集人脐静脉血,将脐静脉血与0.9%氯化钠1∶1体积比例稀释混匀,平铺于LymphoprepTM分离液之上,800g离心20min,吸取单个核细胞层,0.9%氯化钠洗涤2或3次,250g离心10min,弃上清,用含10%胎牛血清的EGM-2MV培养基重悬,以1×107mL-1密度接种于培养瓶,置于37℃、5%CO2的培养箱中培养,72h后首次换液,以后每2或3d更换培养基,待细胞融合至70%时消化并传代。
1.3 细胞免疫化学染色法检测CD34、CD133和KDR 用0.25%胰蛋白酶消化第2代细胞,爬片成功后按免疫组织化学染色试剂盒步骤进行操作,DAB显色,苏木素复染,阴性对照组用PBS代替一抗。
1.4 实验分组 取第2代细胞为正常对照组;取第8代细胞作为实验组:高剂量辛伐他汀组(培养基中的辛伐他汀浓度为1×10-7mol·L-1)、低剂量辛伐他汀组(培养基中的辛伐他汀浓度为1×10-8mol·L-1)和复制性衰老细胞组(按常规培养),培养7d后进行试验。
1.5 流式细胞术测定细胞凋亡率 收集各组细胞,PBS洗细胞3次,将细胞重悬于500μL预冷的结合缓冲液,加入5μL AnnexinV-FITC和5μL PI,室温避光20min,1h内送流式细胞仪检测。早期凋亡细胞以An-nexinV-FITC染色为主,晚期凋亡细胞则为AnnexinV-FITC/PI双染色。
1.6 流式细胞术检测细胞周期 收集各组细胞,用PBS洗涤2次后悬浮于500μL PBS中,充分吹散混匀,缓慢加入5mL冷乙醇,4℃固定过夜,后离心弃乙醇,PBS洗涤2次后重悬于0.5mL PBS中,加入500μL PI,4℃避光反应30min,流式细胞仪检测细胞周期。
1.7 流式细胞术检测细胞Bcl-2表达 收集各组细胞,以4%多聚甲醛固定,固定后离心弃固定液,并以0.1%Triton-XI00增加细胞膜的通透性,PBS清洗后调整细胞密度为5×105L-1,加入标记后的Bcl-2抗体,避光反应30min,PBS洗2次,以鼠抗人IgG PE为标准管,以PBS为阴性对照,流式细胞仪检测免疫荧光的细胞,记录阳性细胞表达率和荧光强度。
1.8 统计学分析 采用SPSS 19.0统计软件进行统计学分析。各组细胞凋亡率、细胞周期中各期细胞所占百分比、Bcl-2蛋白表达的荧光强度和阳性表达率等均以表示,多组间样本均数比较采用单因素方差分析。
2 结 果
2.1 免疫化学染色鉴定 免疫细胞化学检测CD34、CD133和KDR均呈阳性反应,细胞浆呈棕黄色,苏木素衬染的胞核为蓝色(图1,见插页三)。
2.2 AnnexinV-FITC/PI双染检测EPCs凋亡正常对照组细胞的早期凋亡率和晚期凋亡率低于其他3组(P<0.05或P<0.01);高剂量辛伐他汀组、低剂量辛伐他汀组和复制性衰老细胞组间早期凋亡率比较差异无统计学意义(P>0.05);与复制性衰老细胞组比较,高剂量辛伐他汀组和低剂量辛伐他汀组细胞的晚期凋亡率降低(P<0.05或P<0.01),高剂量辛伐他汀组与低剂量辛伐他汀组的细胞晚期凋亡率比较差异无统计学意义(P>0.05)。见图2和表1。
2.3 流式细胞术检测细胞周期 与正常对照组比较,高剂量辛伐他汀组、低剂量辛伐他汀组和复制性衰老细胞组细胞G0/G1期比例增加,S期及G2/M期细胞比例减少(P<0.01);实验组3组间各期细胞比例分布比较差异无统计学意义(P>0.05)。见图3和表2。

图2 Annexin V-FITC/PI双染流式细胞术检测EPCs凋亡Fig.2 Apoptosis of EPCs detected by flow cytometry analysis with Annexin V-FITC/PI staining
表1 Annexin V-FITC/PI双染流式细胞术检测EPCs凋亡率Tab.1 Apoptotic rates of EPCs detected by flow cytometry analysis with Annexin V-FITC/PI staining[n=3,η/()%]
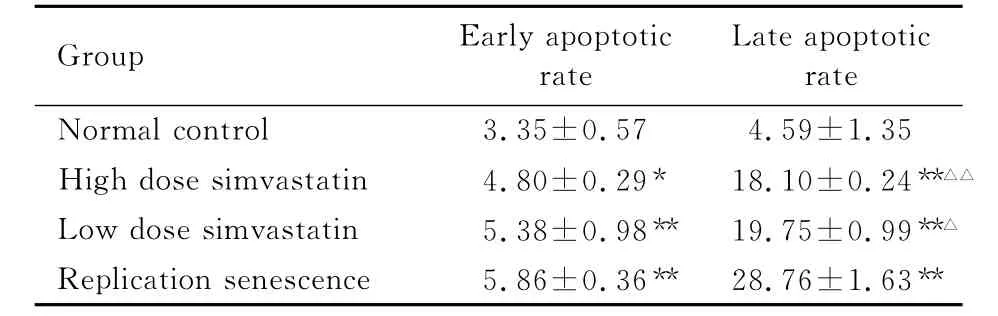
表1 Annexin V-FITC/PI双染流式细胞术检测EPCs凋亡率Tab.1 Apoptotic rates of EPCs detected by flow cytometry analysis with Annexin V-FITC/PI staining[n=3,η/()%]
*P<0.05,**P<0.01compared with normal control group;△P<0.05,△△P<0.01compared with replication senescentce group.
GroupEarly apoptotic rate Late apoptotic rate Normal control 3.35±0.574.59±1.35 High dose simvastatin 4.80±0.29*18.10±0.24**△△Low dose simvastatin 5.38±0.98**19.75±0.99**△Replication senescence 5.86±0.36**28.76±1.63**
2.4 流式细胞术检测Bcl-2蛋白的表达水平 正常对照组Bcl-2蛋白表达的荧光强度和阳性表达率均明显高于高剂量辛伐他汀组、低剂量辛伐他汀组和复制性衰老细胞组(P<0.01);高剂量辛伐他汀组的荧光强度和阳性表达率高于复制性衰老细胞组(P<0.05或P<0.01),低剂量辛伐他汀组的阳性表达率高于复制性衰老细胞组(P<0.01),但荧光强度与复制性衰老细胞组比较差异无统计学意义(P>0.05)。见图4和表3。

图3 流式细胞术检测EPCs细胞周期流式细胞图Fig.3 Cell cycle of EPCs detected by flow cytometry
表2 流式细胞术检测各组EPCs细胞周期细胞比例Tab.2 Percentages of EPCs at different phases in various groups detected by flow cytometry[n=3,η/()%]

表2 流式细胞术检测各组EPCs细胞周期细胞比例Tab.2 Percentages of EPCs at different phases in various groups detected by flow cytometry[n=3,η/()%]
*P<0.01compared with normal control group.
Group Percentag 3.05 High dose simvastatin 79.30±1.01*7.57±1.05*13.13±10.46*Low dose simvastatin 81.07±1.31*8.33±0.91*10.60±0.44*Replication senescence 82.00±0.57*7.87±0.35*M S Normal control 52.77±2.7120.93±2.0126.30±e of EPCs G0/G1G2/10.13±0.81
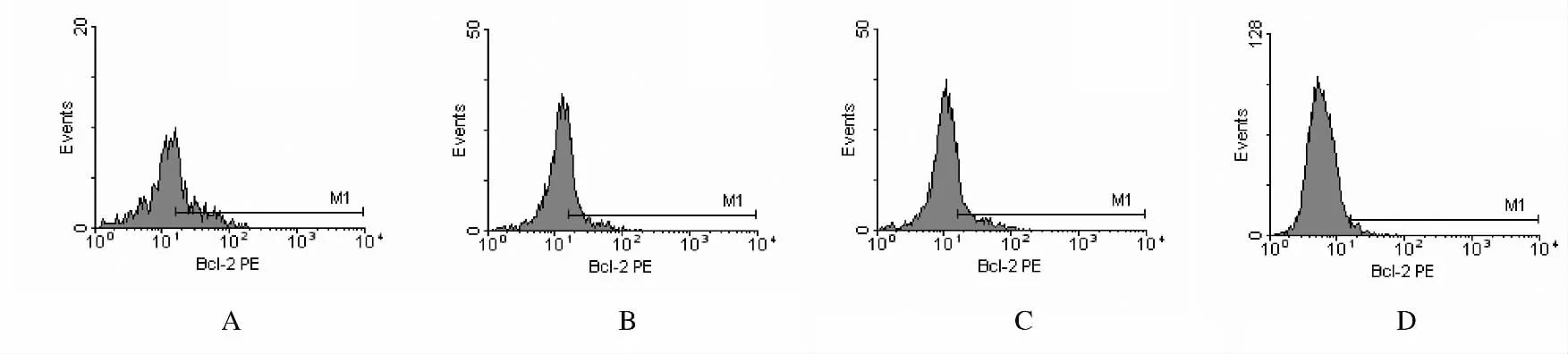
图4 流式细胞术检测各组细胞Bcl-2的表达Fig.4 Expressions of Bcl-2protein in various groups detected by flow cytometry
表3 流式细胞术检测各组细胞Bcl-2的表达水平Tab.3 Expression levels of Bcl-2protein in various groups by flow cytometry[n=3,η/()%]

表3 流式细胞术检测各组细胞Bcl-2的表达水平Tab.3 Expression levels of Bcl-2protein in various groups by flow cytometry[n=3,η/()%]
*P<0.01compared with normal control group;△P<0.05,△△P<0.01compared with low dose simvastatin group;#P<0.01compared with replication senescence group.
GroupMean fluorescence intensity Positive expression rate Normal control 28.64±1.4937.60±0.85 High dose simvastatin 24.20±1.04*△#29.62±1.0*△△#Low dose simvastatin 21.97±0.40*19.47±0.87*#Replication senescence 20.55±0.41*5.72±1.99*
3 讨 论
细胞复制性衰老是指细胞经历一段快速增长期和有限次数的分裂之后,细胞增生能力下降,伴随一定程度的形态学和生物学行为的改变及适应环境能力的下降,但仍然在很长一段时间内保持一定的代谢活性[5]。血管内皮细胞衰老和功能下降是血管衰老和动脉粥样硬化的重要机制之一,老年人群心血管疾病风险的增加与年龄呈正相关关系,也充分说明细胞衰老和凋亡在血管衰老发生、发展中发挥至关重要的作用[6]。EPCs在冠心病、糖尿病及高血压病患者中明显减少,药物或者非药物方法增加体内EPCs治疗缺血性疾病是目前的研究热点[7],EPCs移植治疗各种缺血性疾病也在实验室进行[8-9],但远期疗效尚缺乏有说服力的证据。他汀类药物是目前临床上常用的调节血脂代谢紊乱和保护血管内皮的最有效的一类药物,长期应用他汀类药物能够降低高脂血症发病率,减少冠心病患者的死亡率和心血管事件发生率,但对于他汀类药物干预EPCs复制性衰老的研究尚无报道。Bcl-2是正常细胞的凋亡抑制基因,通常情况下稳定的Bcl-2蛋白表达起到防止细胞凋亡的功能;在各种病理或特殊的生理状态下,Bcl-2表达下调,抗凋亡能力下降,细胞凋亡增加;细胞衰老的过程也伴随着凋亡启动,Bcl-2家族在凋亡过程中的作用至关重要,结合文献[10-12],本文作者推测他汀类药物可能在一定程度上调控着Bcl-2家族的表达。本研究在体外构建EPCs复制性衰老的细胞模型,辛伐他汀干预已经发生衰老的EPCs,结果显示:辛伐他汀能够降低复制性衰老的EPCs的晚期凋亡率,同时发现辛伐他汀能不同程度地提高Bcl-2蛋白的表达,提示该药物抑制细胞晚期凋亡的机制可能与通过Bcl-2这一经典途经有关。但本研究未发现辛伐他汀能够降低复制性衰老细胞的早期凋亡率,可能是因为早期凋亡和晚期凋亡的机制并不相同。反应细胞早期凋亡的磷脂酰丝氨酸(phosphatidylserine,PS)在正常生理状态下只分布在细胞膜的内侧,细胞发生凋亡早期,PS由脂膜内侧翻向细胞膜外侧,细胞凋亡晚期DNA发生断裂,伴有细胞的继发性坏死[13-14]。辛伐他汀可能是延缓了细胞早期凋亡到晚期凋亡的过程以及之后出现的继发性坏死,但对细胞复制性衰老伴有的早期凋亡的作用目前尚不能肯定。但他汀类药物对于其他原因所致的细胞早期和晚期凋亡的保护作用已经比较明确和肯定,国内的谢彬等[15-16]研究发现:阿托伐他汀能够通过上调Bcl-2蛋白表达和下调Bax蛋白表达,延缓AngⅡ和高糖诱导的内皮细胞凋亡,证实了他汀类药物可能通过延缓内皮细胞凋亡和衰老而起到心血管保护作用。另外也有文献[17-18]报道:Bcl-2通过细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK)途径参与调节细胞周期进程,与细胞生存和转归有关,但本研究并未发现辛伐他汀可以影响EPCs的细胞周期,提示EPCs复制性衰老的机制复杂,需要更多的研究以明确其机制;另一方面,随着细胞传代的增加,越来越多的细胞停滞在G0/G1期,辛伐他汀干预后不能改变EPCs的周期,这也说明了他汀类药物在这方面的局限性。本研究的不足之处在于仅观察了EPCs的凋亡情况,细胞的黏附、增殖、迁移以及一氧化氮的合成和分泌等项目还需后续实验进一步完善。
总之,细胞的复制性衰老是人体衰老的重要内容之一,血管内皮祖细胞的复制性衰老和凋亡也许是一个不可逆的过程,但他汀类药物在一定程度上可以延缓这一过程。
[1]Anjum F,Lazar J,Zein J,et al.Characterization of altered patterns of endothelial progenitor cells in sickle cell disease related pulmonary arterial hypertension[J].Pulm Circ,2012,2(1):54-60.
[2]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[3]Murayama T,Asahara T.Bone marrow-derived endothelial progenitor cells for vascular regeneration[J].Curr Opin Mol Ther,2002,4(4):395-402.
[4]Henrich D,Seebach C,Wilhelm K,et al.High dosage of simvastatin reduces TNF-alpha-induced apoptosis of endothelial progenitor cells but fails to prevent apoptosis induced by IL-1beta in vitro[J].J Surg Res,2007,142(1):13-19.
[5]Schellenberg A,Lin Q,Schuler H,et al.Replicative senescence of mesenchymal stem cells causes DNA-methylation changes which correlate with repressive histone marks[J].Aging(Albany NY),2011,3(9):873-888.
[6]李 蓉,蔡 辉.内皮细胞凋亡与动脉粥样硬化关系的研究进展[J].中国老年学杂志,2012,32(12):2649-2652.
[7]Koutroumpi M,Dimopoulos S,Psarra K,et al.Circulating endothelial and progenitor cells:Evidence from acute and longterm exercise effects[J].World J Cardiol,2012,4(12):312-326.
[8]Schuh A,Kroh A,Konschalla S,et al.Myocardial regeneration by transplantation of modified endothelial progenitor cells expressing SDF-1in a rat model[J].J Cell Mol Med,2012,16(10):2311-2320.
[9]Decano JL,Moran AM,Giordano N,et al.Analysis of CD45-CD34+/KDR+endothelial progenitor cells as juvenile protective factors in a rat model of ischemic-hemorrhagic stroke[J].PLoS One,2013,8(1):e55222.
[10]吴 刚,薛荣亮,吕建瑞,等.全脑缺血再灌注后Fas、TNFR1蛋白的表达与细胞凋亡的关系及Bcl-2过度表达对其的影响[J].南方医科大学学报,2011,31(8):1298-1303.
[11]Zeng H,Kong X,Peng H,et al.Apoptosis and Bcl-2 family proteins,taken to chronic obstructive pulmonary disease[J].Eur Rev Med Pharmacol Sci,2012,16(6):711-727.
[12]李相军,杨 莉,任立群,等.Bcl-2及Bax在异丙肾上腺素致心肌坏死模型大鼠心肌中的表达及意义[J].吉林大学学报:医学版,2009,35(6):1044-1047.
[13]Maioral MF,Gaspar PC,Rosa SG,et al.Apoptotic events induced by synthetic naphthylchalcones in human acute leukemia cell lines[J].Biochimie,2013,95(4):866-874.
[14]Palma PF,Baggio GL,Spada C,et al.Evaluation of annexin V and Calcein-AM as markers of mononuclear cell apoptosis during human immunodeficiency virus infection[J].Braz J Infect Dis,2008,12(2):108-114.
[15]谢 彬,吕 湛,苟连平,等.阿托伐他汀通过调节Bcl-2/Bax蛋白表达抑制高糖诱导的人脐静脉内皮细胞凋亡[J].中国动脉硬化杂志,2010,18(12):943-947.
[16]单海燕,刘 姝,白小涓,等.阿托伐他汀通过调节Bcl-2/Bax蛋白表达延缓血管内皮细胞衰老[J].中国动脉硬化杂志,2012,20(1):11-15.
[17]Tchernev G,Orfanos CE.Downregulation of cell cycle modulators p21,p27,p53,Rb and proapoptotic Bcl-2-related proteins Bax and Bak in cutaneous melanoma is associated with worse patient prognosis:preliminary findings[J].J Cutan Pathol,2007,34(3):247-256.
[18]Roset R,Gil-Gomez G.Measurement of changes in Cdk2 and cyclin o-associated kinase activity in apoptosis[J].Methods Mol Biol,2009,559:161-172.
