20(s)-原人参二醇对体外培养宫颈癌Siha细胞的增殖抑制作用及其机制
2013-03-23鲁育铭赵丽晶王贺彬赵丽娟
鲁育铭,赵丽晶,王贺彬,许 多,赵丽娟,董 妍
(1.吉林大学白求恩医学院病理生理学教研室,吉林 长春 130021;2.美国杜兰大学细胞生物学教研室,美国 新奥尔良 LA70062)
在发展中国家,子宫颈癌约占女性癌症的24%[1]。人参的主要生物活性成分为人参皂苷,研究[2-3]表明:人参皂苷经机体代谢所产生的次级皂苷——20(s)-原人参二醇(proto-panaxdiol,PPD)具有抗肿瘤活性,可抑制肿瘤细胞增殖,诱导肿瘤细胞分化,促进肿瘤细胞凋亡。本课题组前期研究[4-6]结果显示:PPD可诱导体外培养的Siha细胞发生凋亡和自噬,而PPD对体外培养Siha细胞周期影响的研究尚未见报道。为了进一步阐述PPD的抗肿瘤作用,本实验通过检测PPD对人宫颈癌Siha细胞p53、p21及细胞周期素E(cyclin-E)基因表达的影响,进一步探讨PPD对Siha细胞增殖抑制作用的机制。
1 材料与方法
1.1 细胞和主要试剂 Siha细胞购自协和医科大学。PPD由吉林大学化学学院有机化学教研室制备,乙醇溶解。IMDM培养液和胎牛血清购自美国Hyclon公司;Trizol购自美国Invitrogen公司;抗体购自美国Santa Cruz公司。
1.2 Siha细胞的培养与传代 Siha细胞于含10%胎牛血清的IMDM培养液中,于37℃、5%CO2孵箱中培养,采用0.25%胰酶消化传代。
1.3 流式细胞术检测Siha细胞周期 将生长状态良好的处于静止期Siha细胞分为阴性对照组和实验组,分别用等体积的乙醇和20μg·L-1PPD处理48h后收集细胞,1000r·min-1离心5min,用冷PBS清洗2次,弃上清,向细胞沉淀中加入70%冷乙醇,4℃固定12h,PBS清洗2次去除乙醇,RNase消化后,加入1.5mL PI(0.5mg·L-1)染色,过滤,混匀后行流式细胞仪检测,ModFit LT软件分析结果,实验结果以Siha细胞各期细胞比例表示。
1.4 Real time PCR法检测Siha细胞中p53、p21和cyclin-E mRNA表达水平 分别用等体积的乙醇和20μg·L-1PPD处理Siha细胞48h后,使用Trizol提取RNA,逆转录为cDNA,进行PCR反应。p53,上游引物:5′-CCATCTACAAGCAGTCACAG-3′,下游引物:5′-CCAAATACTCCACACGCAA-3′;p21,上游引物:5′-TGAGTTGGGAGGAGGCA-3′,下游引物:5′-AGCGAGGCACAAGGGTA-3′;Cycline-E,上游引物:5′-CTGGATGTTGACTGCCTTGA-3′,下游引物:5′-CCGCTGCTCTGCTTCTTAC-3′;GAPDH,上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′。反应条件:94℃、5min退火,94℃、30s,58℃、30s,72℃、45s,共30个循环,在延伸阶段收集荧光数据。以GAPDH为内参照,用PCR仪自带的SDS软件(v1.4)收集数据。p53、p21和cyclin-E mRNA的表达水平采用2—△△Ct法计算。
1.5 Western blotting法检测Siha细胞中P53、P21和Cyclin-E蛋白表达水平 Siha细胞分别用乙醇和20μg·L-1PPD处理48h后,用PBS洗3次,用蛋白刮将细胞刮下,超声裂解细胞,12000r·min-1离心40min,取上清蛋白溶液,蛋白定量后取45μg蛋白加入5×SDS-PAGE上样缓冲液,100℃煮沸5min,12%SDS-PAGE电泳分离,100V转膜1.5h,用3%BSA的TBST封闭,TBST洗膜,依次加入一抗、二抗进行免疫结合,AP显色。以β-actin为内参照,计算相对光密度(A)值。目的蛋白的A值=(目的蛋白条带光强度×平均光密度)/(同一样品β-actin条带光强度×平均光密度)。实验重复3次,计算各组A值。以目的蛋白的A值间接表示蛋白表达水平。A值越大,蛋白表达水平越高。
1.6 统计学分析 采用SPSS 10.0软件对数据进行分析处理。细胞周期比例、mRNA表达水平和目的蛋白A值均以表示,两组间样本均数比较采用t检验。
2 结 果
2.1 流式细胞术检测Siha细胞各周期的分布20μg·L-1PPD处理48h后,与阴性对照组比较,实验组G1期细胞比例明显增加(P<0.01),S期细胞比例明显降低(P<0.01),G2期细胞比例无明显差异(P>0.05)。实验组与阴性对照组各期细胞比例见表1和图1(插页三)。
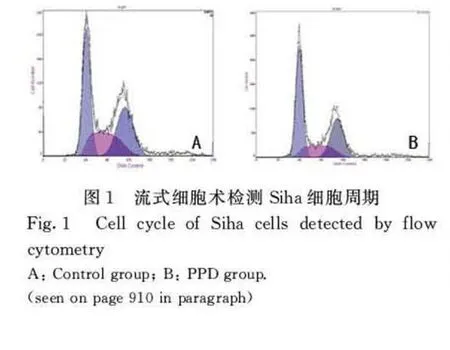
表1 各组Siha细胞不同细胞周期比例Tab.1 Proportions of Siha cells at different cell cycle in various groups[n=3,η/()%]

表1 各组Siha细胞不同细胞周期比例Tab.1 Proportions of Siha cells at different cell cycle in various groups[n=3,η/()%]
*P<0.01 vs control group.
GroupProportion of Siha cells G1S G2 Control 40.1±4.128.6±2.532.4±3.7 PPD 46.7±4.5*21.0±2.9*31.5±3.2
2.2 Real time PCR法检测Siha细胞中p53、p21和cyclin-E mRNA表达水平 与对照组(1)比较,实验组Siha细胞中p53mRNA表达水平增加至(2.93±0.26)(P<0.01),p21mRNA表达水平增加至(2.31±0.17)(P<0.01),cyclin-E mRNA表达水平降低至(0.25±0.03)(P<0.01)。
2.3 Western blotting法检测Siha细胞中P53、P21和Cyclin-E蛋白表达水平 与对照组比较,实验组Siha细胞内P53、P21蛋白表达水平显著增加(P<0.01),Cyclin-E蛋白表达水平显著减少(P<0.01)。见表2和图2。
表2 Western boltting法检测各组Siha细胞中P53、P21和Cyclin-E蛋白表达水平Tab.2 Expression levels of P53,P21,and cyclin-E in Siha cells in various group detected by Western blotting method()
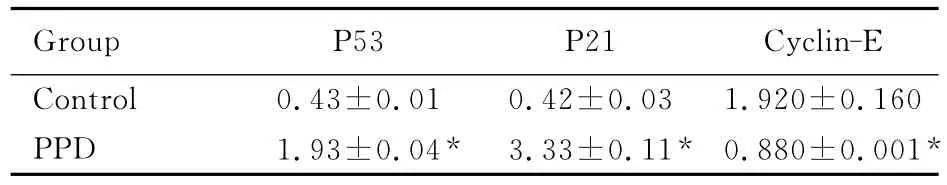
表2 Western boltting法检测各组Siha细胞中P53、P21和Cyclin-E蛋白表达水平Tab.2 Expression levels of P53,P21,and cyclin-E in Siha cells in various group detected by Western blotting method()
*P<0.01 vs control group.
Group P53P21Cyclin-E Control 0.43±0.010.42±0.031.920±0.160 PPD 1.93±0.04*3.33±0.11*0.880±0.001*
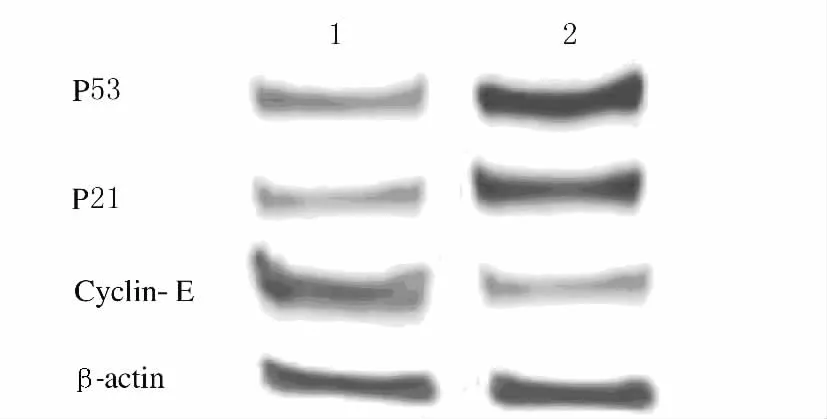
图2 Siha细胞中P21、P53及Cyclin-E蛋白表达电泳图Fig.2 Electrophoregram of expressions of P21,P53and Cyclin-E in Siha cells
3 讨 论
细胞周期调控异常是肿瘤发生的内在原因,在细胞周期中,G1/S、G2/M期的调控点是细胞内外信号经过传递、整合汇集到细胞核,对细胞的增殖进行调控的关键点,该点调控的异常与肿瘤的发生发展关系密切[7]。正常情况下,当细胞受损时,通过激活调控点,导致G1期和G2期延长,使细胞有时间完成复制前和有丝分裂前的修复,以保证细胞正常存活,当损伤超出细胞的修复能力,则促使细胞凋亡[8]。本研究结果显示:20μg·L-1PPD处理48h后,实验组G1期细胞比例明显增加,S期细胞比例明显降低,G2期细胞比例无明显变化,提示PPD可使Siha细胞G1/S调控点的调控作用增强,G1期相对延长。
细胞周期过程中,P53蛋白可作为转录因子或与其他转录因子结合,直接或间接影响细胞周期相关基因的转录,使细胞滞留在G1期[9]。p53基因可被细胞活动中多种有害因素所激活,而DNA损伤与癌基因的表达是p53基因激活的主要刺激因素[10]。p53基因激活后可作用调控p53下游的p21,共同调整细胞周期[11]。虽然p53抑癌作用的分子机制还未得到完全证实,但其在细胞周期中的抑制作用被广泛接受[12],其是迄今为止发现与人类肿瘤细胞的发生高度相关的基因[13]。本实验结果显示:PPD处理后,Siha细胞p53mRNA及蛋白表达水平上调,提示PPD诱导的Siha细胞G1/S调控点调控作用改变可能是通过p53的表达上调而实现。
研究[14]发现:野生型p53可调控p21的转录。p21基因是调控细胞周期的相关基因,属于细胞周期蛋白依赖性激酶抑制因子的cip/kip家族,其第21~26及49~72个氨基酸处分别与Cyclin和CDK结合,从而使cyclin-CDK复合物的激酶活性丧失,进而对细胞周期进行负调控[15]。本研究结果显示:PPD处理后Siha细胞p21基因转录及蛋白表达水平上调,表明p53上调了p21mRNA及蛋白的表达水平。
Cyclin-E是G1期特异性蛋白,其表达升高始于G1中期,至G1晚期的G1/S交界处达到高峰,后随细胞进入S期并开始下降,至G2/M期降为零。Cyclin-E在细胞由G1向S期进展中起重要作用,其与细胞周期蛋白依赖性激酶2(Cdk2)形成活性复合物Cyclin-E/CDK2参与G1期和S期的pRb磷酸化作用,可使细胞增殖加快[16-17]。本研究结果显示:PPD处理后Siha细胞cyclin-E mRNA及蛋白表达水平下调,表明p21进一步抑制了cyclin-E基因的转录与表达。
本研究为了进一步阐述PPD对体外培养siha细胞增殖抑制作用的机制,利用流式细胞术检测了细胞周期,利用Real time PCR和Western blotting法检测p53、p21及cyclin-E基因转录和蛋白表达的改变,结果显示:PPD处理后Siha细胞G1期细胞比例明显增加,G2期细胞比例保持不变;p53、p21基因的转录和表达显著增强;cyclin-E基因的转录和表达明显下调。以上结果提示:PPD可能通过增加p53的表达,上调p21基因的转录,p21基因进一步抑制cyclin-E,从而延长细胞的G1期,进而抑制Siha细胞的增殖。关于PPD抑制Siha细胞增殖的具体机制还有待进一步研究。
[1]Bosch FX,Lorince A,Munoz N,et al.The causal relation between human papillonmavirus and cervical cancer[J].Clin Pathol,2002,55(4):244-265.
[2]Tang Y,Li XH.Inhibitory effects of Zedoray Rhizome abstracts on hepatic cell line HepG2and their mechanisms[J].Chin Pharmacol Bull,2007,23(6):790-794.
[3]Zhao Y,Bu L,Yan H,et al.20S-protopanaxadiol inhibits P-glycoprot erin in multidrug resistant cancer cells[J].Planta Med,2009,75(10):1124-1128.
[4]赵丽晶,许 多,梁作文,等.20(S)-原人参二醇诱导体外培养Siha细胞凋亡的作用[J].吉林大学学报:医学版,2010,36(2):345-348.
[5]赵丽晶,许 多,程 宏,等.20(S)-原人参二醇对体外培养Siha细胞caspase-3表达激活的影响[J].吉林大学学报:医学版,2011,37(1):128-131.
[6]许 多,赵丽晶,程 宏,等.20(S)-原人参二醇对体外培养Siha细胞自噬的影响[J].吉林大学学报:医学版,2010,36(6):1055-1058.
[7]McKay JA,Douglas JJ,Ross VG,et al.Analysis of key cell cycle checkpoint in colorectal tumours[J].J Pathol,2002,196(4):386-393.
[8]柳有清,邢 辉,韩晓病,等.顺铂诱导宫颈癌SiHa细胞周期阻滞及凋亡的研究[J].中华肿瘤防治杂志,2006,13(4):248-251.
[9]陈誉华.医学细胞生物学[M].4版.北京:人民卫生出版社,2011:301-302.
[10]Maria FL,Leticia YP,Maria FT,et al.Tumor-specific MAGE proteins as regulators of p53function[J].Cancer Lett,2012,325(1):11-17.
[11]Michaele JA,Michaele TS,Ye L,et al.Interferon regulatory factor 1(IRF-1)induces p21WAF1/CIP1 dependent cellcycle arrest and p21WAF1/CIP1independent modulation of survivin in cancer cells[J].Cancer Lett,2012,319(1):56-65.
[12]Tongyuan L,Ning K,Le J,et al.Tumor suppression in the absence of p53-mediated cell-cycle arrest,apoptosis,and senescence[J].Cell,2012,149(9):1269-1283.
[13]Smith DR,Ji CY,Gob HS.Prognostic significance of P53 Overstatement and mutation in eoloreetal adenocarcinomas[J].Br J Cancer,1996,74(2):216-223.
[14]刘晓娇,董小萍,周海孝.p21和p27基因在眼睑皮脂腺腺癌中的表达及意义[J].中国组织化学与细胞化学杂志,2010,19(5):477-482.
[15]Radhakrishnan SK,Gierut J,Gartel AL.Multiple alternate p2l transcripts are regulated by p53in human cells[J].Oneoxgene,2006,25(12):1812-1815.
[16]Dirks PB,Rutka MD.Current concepts in neuro-oncelogy:the cell cycle-review[J].Neurosurgery,1997,40(5):1000-1015.
[17]张 谭,周生健,魏莎莉,等.小鼠孕早期Cyclin-E表达规律及意义[J].重庆医科大学学报,2008,33(8):954-958.
