洛伐他汀对TNF-α诱导人脐静脉内皮细胞MCP-1和IL-10表达的影响
2013-03-23赵铁柱陶致侃赵丹丹
赵铁柱,沈 焕,陶致侃,王 为,赵丹丹
(沈阳医学院沈洲医院血管外科,辽宁 沈阳 110032)
动脉粥样硬化(atherosclerosis,AS)是一种多因素疾病,是血管内皮损伤导致的过度炎症反应性血管疾病。AS的病因包括内皮损伤、脂质代谢异常、血流动力学损伤、遗传和物理化学损伤等,而多种复杂因素网络交叉样作用于血管壁,其结果是血管壁的慢性炎症,是对血管壁损害的反应和修复过程[1]。炎症反应贯穿于AS的启动、形成和发展以及不稳定斑块,在AS的发生和发展过程中扮演着极为重要的角色[2]。目前,慢性炎症学说的研究主要集中于炎性细胞、各种细胞因子及免疫机制的交互作用[3-4]。粥样斑块内单核细胞的黏附、迁移和浸润,是引起AS的主要原因[5]。单核细胞的活性主要由趋化因子,如单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)调节,MCP-1是一种内皮细胞分泌的促炎性细胞因子,大量的研究[6]也表明:单核细胞的趋化主要是由MCP-1来实现,在动脉粥样硬化发展中的作用十分重要。实验[7]证明:MCP-1可促使进入血管壁的单核细胞转变为巨噬细胞,吞噬大量修饰的脂蛋白,形成泡沫细胞。活化的白细胞和血管壁本身的细胞还可以释放多种生长因子,促进血管平滑肌细胞的增生和向内膜下迁移,最终形成AS病变。核因子NF-κB可调控AS斑块炎症反应中MCP-1的转录表达。此外,作为重要的促炎症细胞因子,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)存在于AS斑块形成和破裂的过程中[2,5]。研究[5]表明:TNF-α与内皮细胞胞膜上的TNF受体(TNFR)相结合,发挥生物学效应,从而诱导内皮细胞的衰老和凋亡。血管内皮细胞在受刺激后,产生明显的病理和生理学变化,从而启动局部的炎症反应和粥样斑块的形成[8]。同时,炎症介质白细胞介素10(IL-10)对慢性血管炎症有重要影响。IL-10是重要的炎症调控因子,具有抗炎和免疫调节作用,IL-10在AS病变形成和稳定方面发挥重要功能,是AS的保护因子。在人AS发生过程中IL-10的表达上调,提示除了致炎因子外,抗炎因子如IL-10等也参与了AS的发生[9]。近年来,在AS的抗炎治疗中,他汀类药物具有重要的抗炎作用,能够减少内皮对炎症细胞的吸附作用,减少斑块内的炎性细胞浸润,抑制血小板聚集[4,10]。因此早期应用他汀类药物成为关注的热点。结合相关文献报道以及本课题组前期工作基础,本研究采用TNF-α刺激内皮细胞模拟炎症条件,通过对MCP-1、IL-10和NF-κB等炎症相关因子的研究,探讨洛伐他汀(lovastatin,LVT)保护人脐静脉内皮细胞(HUVECs)功能的作用,阐明LVT抗炎的可能机制,为AS的抗炎治疗提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器 HUVECs(中国科学院上海细胞所)。LVT(产品批号:75330-75-5,粉剂,20mg,上海纯优生物科技有限公司);2′,7′-二氯氢化荧光素二酯(20,70-dichlorofluorescin diacetate,DCFH-DA)(美国Sigma公司);胎牛血清(FBS,美国Hyclone公司);RPMI 1640培养基和胰蛋白酶(美国Gibco公司);Trizol总RNA提取试剂盒(美国Invitrogen Life Technologies公司);RIPA蛋白裂解液、BCA蛋白定量测定试剂盒和MCP-1、IL-10单克隆抗体及辣根过氧化物酶(HRP)标记的二抗(美国Santa Cruz公司)。ABI 7500Fast Real-Time PCR仪(美国ABI公司);Bio-rad 680酶标仪、聚丙烯酰胺凝胶电泳垂直电泳槽和转移电泳槽(美国Bio-Rad公司)。
1.2 HUVECs培养 在无菌条件下,细胞常规培养于含10%FBS的RPMI 1640培养液中,含青、链霉素双抗(1%)。在37℃、5%CO2的细胞培养箱内培养。实验采用第2~4代细胞,待细胞生长融合成单层后进行实验。
1.3 细胞分组及干预 用含10%FBS的RPMI 1640培养液在37℃、5%CO2的细胞培养箱内培养18h,待细胞融合成单层后,分为对照组、TNF-α处理组和LTV干预组。对照组细胞仅用含10%FBS的RPMI 1640培养液培养;TNF-α处理组细胞用含10%FBS的RPMI 1640培养液+TNF-α(20μg·L-1)处理;LVT干预组,用含10%FBS的RPMI 1640培养液+TNF-α(20μg·L-1)+LVT(10μmol·L-1)处理(加入LVT 1h后加入TNF-α)。每组均设5个复孔,培养24h后收集细胞。
1.4 活性氧(ROS)含量测定 参照说明书,各组细胞分别培养预定时间后,用0.125%胰酶∶0.02%EDTA按1∶1比例的混合液消化细胞,无血清的培养基洗2次,重悬于PBS中。调整细胞数至每升4×108个细胞。加入DCFH-DA(无水乙醇配置)1μL,避光,置于37℃水浴30min。流式细胞术检测荧光强度(激发光波长488nm,发射光波长530nm)。每次获取1.5×104个细胞,采用BD公司的Sinmul SET软件进行测定及分析,结果取5次的平均值。
1.5 实时定量RT-PCR检测MCP-1和IL-10 mRNA表达水平 用Trizol提取总RNA,逆转录,应用SYBR荧光定量PCR方法测定mRNA的表达。使用ABI 7500Fast Real-Time PCR System两步法PCR标准程序扩增:95℃变性30s(95℃变性30s、60℃退火30s)×40个循环。本实验以GAPDH作为内参照,引物由大连宝生物工程有限公司合成。内参GAPDH引物序列:上游引物5′-AACGGATTTGGTCGTATTG-3′,下游引物5′-GCTCCTGGAAGATGGTGAT-3′,产物长度为214bp;MCP-1引物序列:上游引物5′-TGCCGCCCTTCTGT-3′,下游引物5′-TTGGGTTTGCTTGTCC-3′,产物长度为274bp;IL-10引物序列:上游引物5′-AGCCTACATGACAATGAAGA-3′,下游引物5′-GGTTGAGGTATCAGAGGTAAT-3′,产物长度为180bp。采用2-△△CT法进行计算,计算公式:①改变的倍数=2-ΔΔCT;②ΔΔCT=(CT靶基因-CT内参)处理组-(CT靶基因-CT内参)未处理组。
1.6 Western blotting法检测MCP-1、IL-10和磷酸化NF-κB蛋白表达水平 收集各组HUVECs后加入预冷的细胞裂解液,收集蛋白,用BCA法检测蛋白浓度。以40μg总蛋白上样,经SDSPAGE电泳,然后转膜。加入1∶500的兔抗人MCP-1、IL-10和磷酸化NF-κB(p65NF-κB)一抗稀释液,4℃孵育过夜。TBST洗膜3次,再加入HRP标记的羊抗兔二抗稀释液(1∶10000),置室温2h显色。光密度分析软件处理分析。
1.7 统计学分析 采用SPSS 18.0统计软件对数据进行分析,蛋白表达灰度值、基因表达水平以表示,多组间样本均数比较采用单因素方差分析。
2 结 果
2.1 ROS测定结果 对照组、TNF-α处理组和LVT干预组的ROS含量分别为310.01±93.26、659.81±92.57和401.11±83.08。与对照组比较,TNF-α处理组ROS含量明显增高(P<0.05);与TNF-α处理组比较,LVT干预组ROS含量明显降低(P<0.05)。
2.2 MCP-1和IL-10mRNA表达水平 TNF-α作用于HUVEC后,TNF-α处理组细胞中MCP-1 mRNA表达(1.42±0.11)明显高于对照组(0.99±0.12)和LVT干预组(1.11±0.09),差异有统计学意义(P<0.05);而TNF-α处理组中IL-10 mRNA表达(0.61±0.05)明显低于对照组(0.99±0.17)和LVT干预组(0.81±0.08),差异有统计学意义(P<0.05);与TNF-α处理组比较,LVT干预组MCP-1mRNA表达降低(P<0.05),IL-10 mRNA表达增加(P<0.05)。
2.3 MCP-1、IL-10和p65NF-κB蛋白表达水平TNF-α作用于HUVECs后,TNF-α处理组细胞中的MCP-1蛋白和p65NF-κB蛋白表达明显高于空白对照组和LVT干预组(P<0.05),而IL-10蛋白表达明显低于对照组和LVT干预组(P<0.05);与TNF-α处理组比较,LVT干预组MCP-1和p65NF-κB蛋白表达降低(P<0.05),IL-10蛋白表达增加(P<0.05)。见图1和表1。
3 讨 论
在AS斑块形成过程中,炎症反应是其主要特征并起着关键性的作用,各种炎性介质和抗炎因子相互作用决定着斑块的形成速度和稳定性[11]。单核巨噬细胞系统特别是与单核巨噬细胞浸润有关的因子,对于AS形成至关重要。MCP-1是属于趋化因子类细胞因子,是一种特异性单核细胞趋化因子。人类MCP-1基因位于17号染色体含有3个外显子和2个内含子,编码99个氨基酸残基的蛋白质。成熟、有活性的MCP-1由76个氨基酸构成,最前的23个氨基酸残基具有疏水性,是一种信号肽的典型表现。MCP-1通过与单核细胞表面的趋化因子受体2(CCR2)结合,使血液中的单核细胞迁入血管内膜下,并活化为巨噬细胞,摄取已进入内膜并发生修饰的脂蛋白形成单核细胞源泡沫细胞,促使AS的形成,而且能促进血管壁平滑肌细胞(SMC)的增殖[12],在AS的早期起重要作用[13]。MCP-1已经被认为是AS起始炎症过程的关键因子。
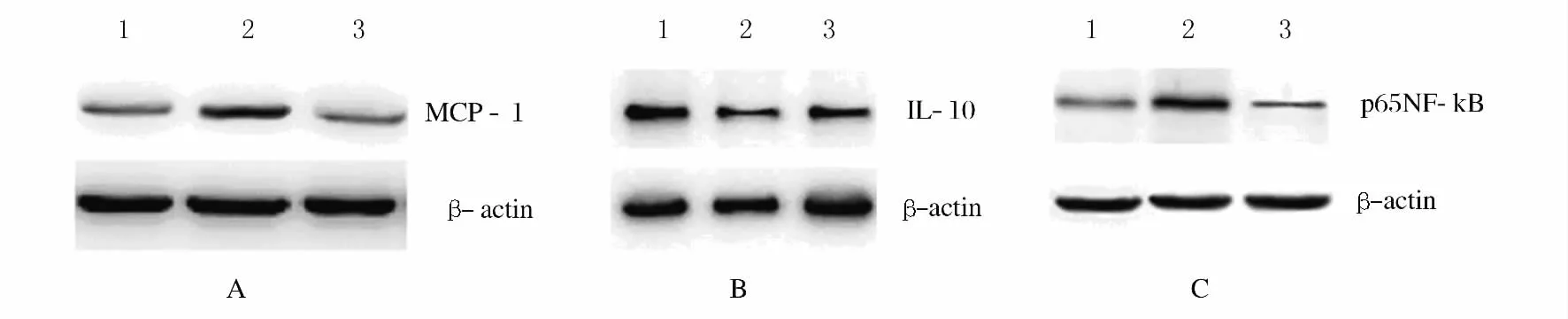
图1 各组HUVECs中MCP-1、IL-10和p65NF-κB蛋白表达Fig.1 Expressions of MCP-1,IL-10,and p65NF-κB protein in HUVECs in various groups
表1 各组HUVECs中MCP-1、IL-10和p65NF-κB蛋白表达Tab.1 Expression levels of MCP-1,IL-10and p65NF-κB in HUVECs in various groups(n=5,)

表1 各组HUVECs中MCP-1、IL-10和p65NF-κB蛋白表达Tab.1 Expression levels of MCP-1,IL-10and p65NF-κB in HUVECs in various groups(n=5,)
*P<0.05compared with control group;△P<0.05compared with TNF-αtreated group.
GroupMCP-1/β-actin IL-10/β-actin p65NF-κB/β-actin Control 0.45±0.0410.91±0.0870.56±0.049 TNF-αtreated 0.67±0.051*0.52±0.051*1.02±0.081*LVT treated 0.44±0.036△0.61±0.054△0.37±0.026△
内皮细胞是防止AS的第一道防线,内皮细胞损伤或功能障碍被认为是AS的始发因素,与AS之间的关系日益受到重视。内皮细胞对血循环和动脉壁局部的微环境变化敏感,如氧化应激、炎症等,从而调节一些能影响血管壁功能的分子的表达和活性。
他汀类药物又名羟甲基戊二酸单酰辅酶A(hydroxy-methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂,体内外研究提示:他汀类药物有一定的抗炎作用,可抑制SMC增殖、改善血管内皮的功能、抑制细胞凋亡和降低患者C反应蛋白等。
本研究发现:在TNF-α刺激下HUVECs中MCP-1mRNA和蛋白表达增高。同时在TNF-α刺激下,NF-κB蛋白表达水平增高,而NF-κB是炎症的核心调节因子,AS的炎症反应过程所涉及的许多基因都是由NF-κB激活。TNF-α刺激HUVECs增加ROS含量,而ROS也可通过活化转录因子NF-κB上调MCP-1表达[5]。在LVT的干预下,可下调MCP-1mRNA和蛋白的表达以及降低ROS含量,这说明LVT能够抑制炎症因子TNF-α所诱导的MCP-1高表达,因而可能减轻MCP-1对HUVECs的炎性损伤,同时也降低了ROS本身所带来的损伤作用,从而起到保护内皮细胞的作用。
在人AS发生过程中IL-10的表达上调,提示除了致炎因子外,抗炎因子如IL-10等也参与了AS的发生,是AS的保护因子[14]。IL-10是重要的炎症调控因子,具有抗炎和免疫调节作用。王飞等[15]研究发现:IL-10对趋化因子MCP-1表达有显著的抑制作用。同时发现IL-10能抑制泡沫细胞中氧化型低密度脂蛋白(ox-LDL)导致的NF-κB活化,表明IL-10对趋化因子的抑制作用部分是对NF-kB活性的抑制而达到,从而降低趋化因子mRNA转录及蛋白合成。临床研究[16]发现:在AS患者中如血清中IL-10浓度偏高者,其病程及预后较好。本研究发现:TNF-α刺激下HUVECs中IL-10mRNA和蛋白表达水平均降低,而在LVT干预下IL-10mRNA和蛋白表达水平有所增高,但NF-κB的表达水平降低。说明LVT可能通过增加IL-10的表达、降低NF-κB的表达而起到保护内皮细胞的作用。
综上所述,LVT可能通过降低MCP-1的表达和ROS含量同时增高IL-10的表达,保护内皮细胞,这些作用可能通过对NF-κB的调节而实现。因此,LVT对AS的形成和发展能够起到抑制作用。
[1]Papafaklis MI,Koskinas KC,Chatzizisis YS,et al.In vivo assessment of the natural history of coronary atherosclerosis:vascular remodeling and endothelial shear stress determine the complexity of atherosclerotic disease progression[J].Curr Opin Cardiol,2010,25(6):627-638.
[2]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Atherosclerosis as an inflammatory disease[J].Curr Pharm Des,2012,18(28):4266-4288.
[3]Saely CH,Drexel H,Sourij H,et al.Key role of postchallenge hyperglycemia for the presence and extent of coronary atherosclerosis:An angiographic study[J].Atherosclerosis,2008,199(2):317-322.
[4]褚现明,李 冰,安 毅,等.炎症与动脉粥样硬化关系研究进展[J].中国分子心脏病学杂志,2010,11(3):184-188.
[5]程海涛,杨 彤,赵 军.TNF-α对人脐静脉内皮细胞表达MCP-1及IL-8的影响[J].中国实验血液学杂志,2009,17(2):479-482.
[6]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Atherosclerosis as an inflammatory disease[J].Curr Pharm Des.2012;18(28):4266-4288.
[7]Samson S,Mundkur L,Kakkar VV.Immune response to lipoproteins in atherosclerosis[J].Cholesterol,2012:571846.DOI:10.1155/2012/571846[Epub 2012Aug 23]
[8]张 涛,李自成,巫少荣.基质金属蛋白酶-9和C反应蛋白与冠心病的相关性研究[J].临床心血管病杂志,2008,24(2):88-90.
[9]高瑞利,张国华.IL-10与动脉粥样硬化性缺血性脑卒中[J].脑与神经疾病杂志,2010,18(2):158-161.
[10]Han X,Kitamoto S,Wang H,et al.Interleukin-10 overexpression in macrophages suppresses atherosclerosis in hyperlipidemic mice[J].FASEB J,2010,24(8):2869-2880.
[11]Rocha VZ,Libby P.Obesity,inflammation,and atherosclerosis[J].Nat Rev Cardiol,2009,6(6):399-409.
[12]官秀梅,钱民章.单核细胞趋化蛋白1对人脐静脉平滑肌细胞增殖的影响[J].中国动脉硬化杂志,2005,13(3):309-312.
[13]李琴山,刘 洋,冯赞杰,等.金雀异黄素抑制单核细胞趋化蛋白-1诱导的人脐静脉内皮细胞凋亡[J].中国病理生理杂志,2007,23(5):874-879.
[14]李枚娟,王 焱,巩 燕.白介素10在粥样斑块形成机制中的研究进展[J].心血管病学进展,2009,30(suppl 1):11-14.
[15]王 飞,戴亚蕾.白细胞介素10对巨噬细胞源泡沫细胞趋化因子表达的影响[J].中国动脉硬化杂志,2007,15(1):19-22.
[16]Farkouh ME,Boden WE,Bittner V,et al.Risk factor control for coronary artery disease secondary prevention in large randomized trials[J].J Am Coll Cardiol,2013,61(15):1607-1615.
