油茶果皮多酚粗提物对DNA 氧化损伤的影响
2013-03-20侍银宝钟海雁
侍银宝 钟海雁
(中南林业科技大学食品工程学院,湖南 长沙 410004)
油茶属山茶科植物,有“东方橄榄”之称。在中国,油茶分布广泛,具有悠久的栽培历史。油茶果皮,又称油茶蒲,作为油茶加工过程中的最大副产物,含有丰富的多酚类物质,而多酚因具有清除与多种疾病相关的活性氧自由基的功能[1-3],且具有独特的药理活性和生物活性[4-6],已得到科学界的普遍关注。因此,油茶果皮中所含的多酚是一类值得开发的天然抗氧化剂。
目前对油茶果皮多酚的提取、成分分析、抗氧化性等已有初步的研究[7-11]。本研究拟利用单细胞凝胶电泳技术(SCGE)探究 油茶果皮多酚粗提物(camellia pericarp polyphenol crude extracts,CPPCE)对H2O2诱导HUVEC DNA氧化损伤的保护作用,以及利用琼脂糖凝胶电泳技术(AGE),研究不同浓度的油茶果皮多酚粗提物对APPH 损伤质粒DNA的保护作用,从而从细胞分子和分子水平上研究油茶中多酚的抗氧化性,为油茶的研究提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
人脐静脉内皮细胞(HUVEC)、pGL6质粒:由中南林业科技大学食品学院分子营养实验室提供;
低熔点琼脂糖凝胶、正常熔点琼脂糖凝胶、Triton-100:美国Sigma公司;
肌氨酸钠:上海梯希爱公司;
APPH:上海Aladdin公司;
溴化乙锭:美国Fluka公司;
Tris碱:美国Genview 公司;
RPMI1640和胎牛血清:美国Gibco公司;
其他化学试剂:均为中国产分析试剂。
1.1.2 主要仪器设备
紫外分光光度计:UV-1800型,日本岛津公司;
荧光显微镜:BX-51型,日本Olympus公司;
电泳仪:JY300C型,北京君意东方电泳设备仪器厂;
电泳槽:JY-SPCT 型,北京君意东方电泳设备仪器厂;
恒温水浴锅:HHD-2型,上海比朗公司;
高速离心机:5418R 型,德国Eppendorf公司;
冷冻干燥机:MODULYO 型,美国Thermo Fisher公司;
凝胶成像仪:Gel Doc型,美国伯乐公司。
1.2 方法
1.2.1 多酚纯度的测定 采用福林酚法,以没食子酸为标品,测得标准曲线为A =0.113 7C+0.058 8,R2=0.999 6,其中A 表示吸光值,C 表示没子酸的浓度(μg/mL),多酚浓度计算公式见式(1):

式中:
N—— 稀释倍数;
A′—— 样品稀释液吸光值;
c′—— 样品多酚浓度,mg/mL。
称取一定质量的冻干粉并复溶,复溶后多酚浓度按式(1)计算,其纯度计算公式见式(2):

式中:
c″—— 复溶后多酚浓度,mg/mL;
v—— 复溶后多酚的体积,mL;
m—— 称取的冻干粉的质量,mg;
w—— 多酚纯度,%。
1.2.2 油茶果皮多酚提取物的制备以及纯度的测定 称取已晒干的新鲜油茶果皮,经粉碎机粉碎,过120目筛,按料液比1∶15(m∶V)加入70%的乙醇溶液,超声时间40min,提取温度35℃,然后真空抽滤,残渣再用1∶15(m∶V)的料液洗涤,重复上述操作。合并提取液,于40 ℃下旋转蒸发浓缩。将浓缩液用D101大孔树脂进一步分离纯化,得提取液,冷冻干燥制得多酚粗制品。称取一定质量的冻干粉并复溶,多酚纯度按式(1)、(2)计算,得多酚纯度为34.5%。
1.2.3 HUVEC 细胞的培养 HUVEC 培养于培养基(含体积分数为5%牛血清,1 000kU/L青霉素,100mg/L 链霉素)中,置于37 ℃,含5% CO2的培养箱中培养,每3~4d传代1次。选取对数生长期细胞进行试验。
1.2.4 不同浓度的H2O2对HUVEC DNA 损伤的检测
在24孔板上选取12个孔,随机分为空白对照组,H2O2染毒组I、II、III,每组3孔,每孔各加入1mL 培养基(细胞密度为1×105个/mL),细胞贴壁后加入不同浓度的H2O2(终浓度分别为25,50,100μmol/L)作用30min,之后用胰酶将每个孔里细胞消化取出,放入1.5 mL 离心管离心弃去上清液,SCGE检测分析。
1.2.5 油茶果皮多酚提取物对HUVEC DNA 氧化损伤保护的检测 取一块24孔板,选取21个孔,随机分为空白对照组,阳性对照组、阴性对照组I、II、III、IV、V,共7组,每组3孔,每孔各加入1mL培养基(细胞密度为1×105个/mL),细胞贴壁后,阴性对照组和阳性对照组均加入相应浓度的油茶果 皮 多 酚 粗 提 物(终 浓 度 分 别 为50,100,500,1 000,1 500mg/L)。加药1h后阳性对照组和阴性对照组均加入终浓度50μmol/L H2O2作用30 min,然后胰酶消化取出,放入1.5mL离心管离心弃去上清液。SCGE检测(所有药物均溶于DMSO,培基DMSO 含量均不超过1%,不会对细胞造成影响,且空白组与阳性对照组均加入同样含量的DMSO)。
1.2.6 SCGE分析 将细胞调整到1×105个/mL 的密度,采用三明治式铺胶法,待胶凝固后,浸入新配置的细胞裂解液(临用前加10% DMSO,1% Triton 100,调节pH=10)置于4 ℃冰箱中避光裂解1.5h,裂解完毕后取出置于新配置的电泳液(300mmol/L NaOH,1mmol/L Na2EDTA,pH=13)中避光解旋15min,然后25V,300mA 下电泳10min,电泳结束后置于Tris-HCl(0.4mol/L,pH=7.5)中浸泡15min,用超纯水冲洗3次,无水乙醇浸泡5 min后晾干,用EB 染色,在荧光显微镜下采集图片,随机计数100 个细胞,用CASP软件分析,以细胞拖尾细胞率、彗星尾长作为分析指标。
1.2.7 油茶果皮多酚提取物对·OH 损伤质粒DNA 的保护作用 根据文献[11],作如下修改:将100ng pGL6质粒与溶于PBS(pH =7.4)的APPH 于37 ℃孵育0.5h,总体积25μL,抑制试验中待测试剂在加入APPH 之前加入,孵育之后立即点样电泳(0.8%琼脂糖以TEA 缓冲液配制),水平电泳1h,于凝胶成像分析系统中观察照相。
1.3 数据与结果分析
数据采用EXCEL进行统计学分析,采用T 检验对组间数据进行显著性分析,若P<0.01差异极显著,P<0.05差异显著,P>0.05无显著性差异。
2 结果
2.1 不同浓度的H2O2 对HUVEC DNA 氧化损伤的影响
经荧光显微镜所采集的图片分析发现,图中细胞DNA被EB染成红色,未损伤的DNA 是一个完整的接近圆形的头部,而受损伤的DNA 则为彗星状,空白对照组拖尾细胞量几乎为0,而H2O2染毒组的拖尾细胞含量较高,且随着H2O2浓度的加大(终浓度为25,50,100μmol/L),与空白对照组比较,拖尾细胞量随之加大,彗星尾长也明显随之增长,当H2O2损伤浓度为50μmol/L 时拖尾细胞率接近100%,而H2O2损伤浓度为100μmol/L时细胞全部损伤。故选择H2O2终浓度为50μmol/L 为最佳损伤浓度(P<0.01)见表1,图1。

表1 H2O2 诱导HUVEC DNA 损伤SCGE检测结果Table1 The SCGE analysed results Of HUVEC DNA damage induced by H2O2(X ±sd,n =100)

图1 不同浓度H2O2 诱导HUVEC DNA 损伤的彗星图片Figure1 Comet inmages of HUVEC DNA damage induced by different concentrations of H2O2
2.2 油茶果皮多酚粗提物对HUVEC DNA 氧化损伤的保护
经分析采集的图片发现,阴性对照组,加了不同浓度药物预处理后,细胞拖尾率、彗尾长较之阳性对照组均明显的下降,在50~500mg/L的浓度范围内,随着浓度的增加抗损伤能力加强,与阳性对照组比较,有显著性差异(P<0.01或P<0.05),说明油茶果皮多酚粗提物能显著降低H2O2对HUVEC DNA 的氧化损伤,经1 000mg/L 油茶果皮多酚粗提物预处理后,拖尾细胞率、彗尾长有所增加,但仍然具有一定的保护效果,但当浓度达到1 500 mg/L 时,无保护效果,与阳性对照组比较差异无统计学意义(P>0.05),见表2,图2。
2.3 由APPH 引起的质粒pGL6DNA 的断裂
图3显示:APPH 可以引起质粒DNA 的断裂,未经处理的质粒只有环形结构,电泳时跑在最前端,经APPH 处理之后,环形DNA 残留变少,直链型DNA 增加,且随着APPH浓度的增加,环状DNA 逐渐减少,链状DNA 增加。B 和C泳道,DNA 残留量相似,说明试验时的操作过程,几乎不会改变质粒pGL6 DNA 的结构,最终选择终浓度为10mmol/L的APPH 为损伤浓度。

表2 油茶果皮多酚粗提物对HUVEC DNA抗氧化损伤SCGE检测结果Table2 The SCGE analyzed results of CPPCE antioxidant to HUVEC DNA damage induced by H2O2(X ±sd,n =100)
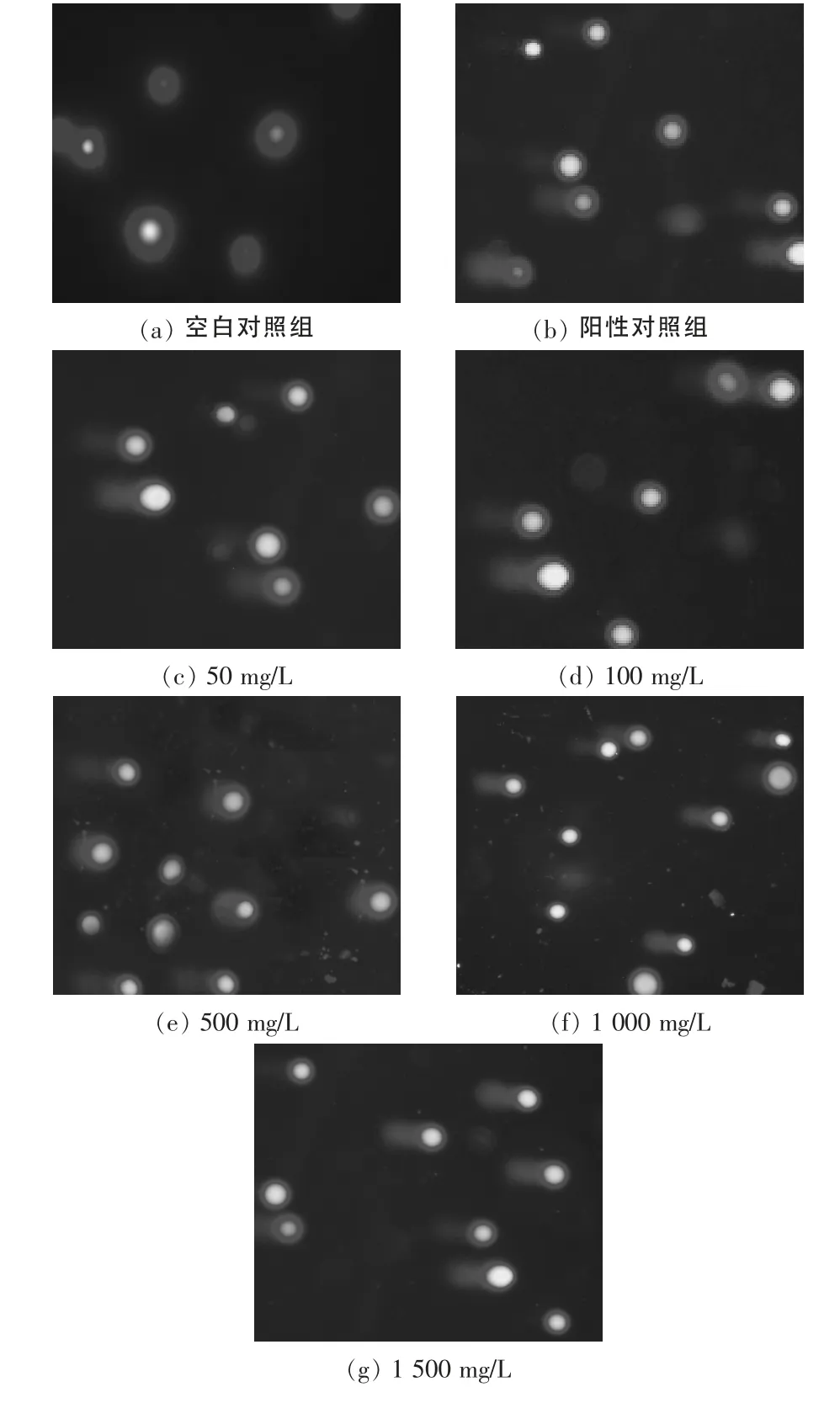
图2 不同浓度油茶果皮多酚粗提物对H2O2(50μmol/L)致HUVEC DNA 损伤的彗星图片Figure2 Comet images of H2O2-induced(50μmol/L)HUVEC DNA treated with different concentrations of CPPCE

图3 不同浓度的APPH 对质粒pGL6DNA 的损伤Figure3 pGL6plasmid DNA damage induced by different concentrations of APPH
2.4 油茶果皮多酚粗提物对质粒DNA 的保护作用
由图4可知,阴性对照组的环形质粒含量比阳性对照组(10mmol/L APPH)的含量高,当CPPCE的浓度为50 mg/L时保护效果不显著,但随着药物浓度的增加,环形质粒的含量在增加,且当药品浓度为1 500mg/L时,保护效果最为显著,环形DNA 的含量几乎与空白组相当。充分说明了CPPCE具有清除自由基的作用,对DNA 氧化损伤具有显著的保护效果。

图4 不同浓度的油茶果皮多酚粗提物对APPH造成的DNA 损伤的影响Figure4 Effects of different concentrations of CCPCE on pGL6plasmid DNA damage induced by APPH(10mmol/L)
3 讨论
本试验通过体外试验方法,利用单细胞凝胶电泳技术(SCGE)验证油茶果皮多酚粗提物对细胞DNA 氧化损伤的保护作用。H2O2在细胞传代过程中,通过氢氧基与DNA分子结合,经过Feton反应而引起DNA 片段的断裂[12,13]。
H2O2+Fe2+→·OH +OH +Fe3+
通过本研究发现:H2O2能显著的增加细胞拖尾率和彗尾长,且随着浓度的增加,损伤程度增加,确定了H2O2最佳损伤终浓度50μmol/L。而油茶果皮多酚粗提物在50~500mg/L浓度范围内,能显著的降低H2O2的诱导损伤程度,表明油茶果皮多酚粗提物对H2O2诱导的DNA 损伤具有一定的保护作用,当用1 000 mg/L 油茶果皮多酚粗提物预处理后,虽拖尾细胞率、彗尾长有所增加,但仍然具有一定的保护效果,当浓度达到1 500 mg/L 时,无保护效果,可能是因为高浓度的油茶多酚粗提物增加H2O2对DNA 诱导损伤的敏感性,也可能与粗提物具有一定毒理作用有关。对于利用琼脂糖凝胶电泳技术研究的体外保护DNA 的研究发现,随着CPPCE 浓度的增加,保护效果也在增加,说明了CPPCE具有较强的清除自由基的能力,对DNA 的抗氧化损伤具有显著的保护作用。
本研究从细胞分子以及分子水平上证明了油茶果皮多酚粗提物抗氧化作用,在一定的浓度范围内对氧自由基诱导的DNA 损伤具有保护作用,但对其保护作用机制以及是否是药物中的多酚成分在起作用还有待进一步的研究。
1 Xiao-Yu Su,Zhen-Yu Wang,Jia-Ren Liu.In vitro and in vivo antioxidant activity of pinus koraiensis seed extract containing phenolic compounds[J].Food Chemistry,2009,117(4):681~686.
2 Matkowski A.Plant in vitro culture for the production of antioxidants[J].Biotechnology Advances,2008,26(6):548~560.
3 Hatano T,Kusuda M,Inada K.Effects of tannins and related polyphenols on methicillin-resistant Staphylococcus aureus[J].Phytochemistry,2005,66(17):2 047~2 055.
4 Seerama N P,Adams L S,Henning S M.In vitro antiproliferative,apoptotic and antioxidant activities of punicalagin,ellagic acid and a total pomegranate tannin extract are enhanced in combination with other polyphenols as found pomegranate juice[J].Journal of Nutritional Biochemistry,2005,16(6):360~367.
5 Bhupinder P S V,Satya P S,Vinod K K.Maharishi amrit Kalash rejuvenates ageing central nervous systen’s antioxidant defence system:an in vivo atudy[J].Pharmacological Research,1999,40(6):497~502.
6 KonatéK,Souza A.Polyphenol contents,antioxidant and antiinflammatory activities of six malvaceae species traditionally used to treat hepatitis B in Burkina Faso[J].Eur.J.Sci.Res,2010,44(4):570~580.
7 廖义秀,钟海雁.茶油储藏稳定性及高校液相色谱分析[J].食品与机械,2013,29(1):173~176.
8 曾献,袁英姿,曹清明,等.油茶籽多酚的提取研究[J].食品与机械,2008,24(4):69~72.
9 赵清洁,龙奇志,钟海雁,等.半制备液相色谱法分离制备油茶果皮多酚的优化条件[J].经济林研究,2012,30(2):73~77.
10 陈跃龙,唐玲,李红兵,等.油茶果皮多元酚富集工艺研究[J].时珍国医国药,2008,19(6):1 369~1 370.
11 刘国安,杨艳,丁兰,等.几种天然抗氧化剂对DNA 氧化损伤的保护作用[J].四川大学学报,2006,43(1):238~241.
12 Silva E M,Souza J N S,Rogez H,et al.Antioxidant activities and polyphenolic contents of fifteen selected plant species from the Amazonian region[J].Food Chemistry,2007,101(3):1 012~1 018.
13 S J Duthie,A R Collins,G G Duthie,et al.Quercetin and myricetin protect against hydrogen peroxide-induced DNA damage(strand breaks and oxidised Pyrimidines)in human lymphocytes[J].Mutation Research,1997,393(3):223~231.
