超高效液相色谱-串联质谱法测定葡萄中氯吡脲的残留
2013-03-20陈兴连李彦刚樊建麟
林 涛 陈兴连 李彦刚 樊建麟
刘兴勇2 兰珊珊1,2 刘宏程1,2
(1.农业部农产品质量安全风险评估实验室(昆明),云南 昆明 650223;
2.云南省农业科学院质量标准与检测技术研究所,云南 昆明 650223)
氯吡脲(结构见图1),别名脲动素、吡效隆等,具有加速细胞有丝分裂、促进细胞的增大和分化、防止落花落果等作用[1,2],常作为猕猴桃、葡萄、西瓜、黄瓜等果蔬的生长调节剂而应用于农业生产中[3-6],但是残留于果蔬中的氯吡脲可能会对人类及其他生物造成潜在的威胁,如对人、畜和鸟类等有低毒性,对皮肤和眼睛有轻度的刺激作用,而对鱼类有中等毒性等[7-9]。因此,近年来对于氯吡脲在农业生产中的用量,各国都制定了严格的最大残留限量要求。

图1 氯吡脲结构Figure1 The structure of forchlorfenuron
目前,用于氯吡脲残留检测的方法较多,主要包括免疫学方法[10,11]、气相色谱法[12]、液相色谱法[13,14]和液相色谱-质谱联用法[15,16]等,其中液相色谱-质谱联用法因其测定快速精确、检出限较低而广泛应用于氯吡脲残留的检测中。本研究基于超高效液相色谱-质谱联用仪,拟采用快捷简便的样品提取方法,比较3种固相萃取柱的净化富集效果,并在测定过程中对串联质谱仪的相关条件进行优化,以建立快速检测葡萄中氯吡脲残留的分析方法。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜葡萄:购于云南省昆明市五华区江岸小区农贸市场和江北农贸市场;
乙腈、甲醇:色谱纯,德国Merck公司;
二氯甲烷、丙酮、正己烷、乙酸铵、氯化钠:分析纯,国药集团化学试剂北京有限公司。
1.1.2 主要仪器设备
超高压液相色谱仪:Agilent 1290型,美国Agilent公司;
三重四级杆串联质谱仪:Agilent 6460 型,美国Agilent公司;
氮吹仪:OA-SYS型,美国Organomation公司;
电子分析天平:AE-100型,瑞士Mettler Toledo公司;
高速匀浆机:IKA T18ULTRA-TURRAX型,德国IKA集团;
食品加工机:HR7625型,荷兰Philips电子公司;
回旋式震荡仪:HY-5 型,江苏省金坛市环宇科学仪器厂;
LC-NH2 SPE tubes:500 mg/3 mL,美 国Supelclean公司;
LC-Florisil SPE tubes:1g/6mL,美国Supelclean公司;
Bond Elut Alumina-B SPE tubes:500 mg/3 mL,美 国Varian公司。
1.2 方法
1.2.1 标准溶液配制
(1)标准储备溶液:准确称取0.05g氯吡脲的标准品,用甲醇溶解并定容至10 mL,得到质量浓度为5 mg/mL 的标准储备液,于低温下避光保存。
(2)标准工作溶液:用移液管准确吸取一定量的标准储备溶液,用甲醇逐级稀释,分别配制成0.5,1.0,2.0,5.0,10.0ng/mL的系列标准工作溶液。
1.2.2 色谱条件 采用Agilent 1290 超高压液相色谱仪,Agilent SB-C18色谱柱(50mm ×2.1mm,1.8μm);流动相A:1mmoL醋酸铵水溶液,流动相B:乙腈;梯度洗脱参数见表1;流速:0.2mL/min,柱温:40 ℃,进样量:2μL。
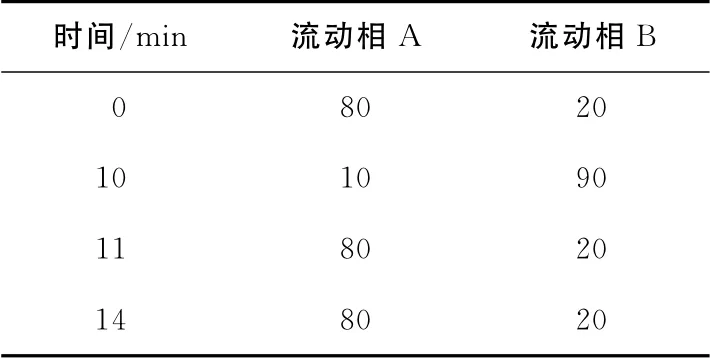
表1 梯度洗脱参数Table1 Gradient elution parameters
1.2.3 质 谱 条 件 优 化 采 用Agilent 6460 Ttiple Quad LC-MS/MS,电喷雾离子源(ESI),首先将2μL氯吡脲的标准溶液(1μg/mL)直接进行质谱分析(流动相A/B =50/50),在Q1SCAN 模式下确定母离子的质荷比(分子量扫描范围:200~600),并比较在ESI+和ESI-两种电离方式下氯吡脲的响应值;同时在合适的电离方式下采用Product Ion Scan模式进行子离子及相关条件的优化(Coarse range from 30to 50,Collision energy from 5to 40),得到MRM 离子对。样品测定时采用上述优化得到的MRM 离子对及相关参数,在多反应检测(MRM)模式下进行分析。
1.2.4 样品前处理 参照文献[17]、[18]的方法,葡萄经食品加工机充分粉碎后,准确称取15.0g葡萄样品于250 mL的锥形瓶中,加入提取溶剂30 mL,高速匀浆1 min后用滤纸过滤,收集滤液到装有5.0~7.0g氯化钠的100mL 具塞量筒中,剧烈振荡1min,在室温下静置1h,待分层完全后准确吸取10.0 mL 上层提取液于150 mL 烧杯中,氮气吹干,待固相萃取柱净化。
1.2.5 固相萃取柱洗脱条件优化 本试验中以回收率为指标,优化比较了LC-NH2、LC-Florisil和碱性氧化铝固相萃取柱的洗脱条件,并比较了LC-NH2、LC-Florisil和碱性氧化铝固相萃取柱对于氯吡脲的富集净化效果,洗脱条件优化步骤如下:
(1)LC-NH2 固相萃取柱:LC-NH2 固相萃取柱首先用5.0mL 5%甲醇-二氯甲烷溶液活化,样品用2.0mL 5%甲醇-二氯甲烷溶液溶解后加入LC-NH2 固相萃取柱,洗脱时分别采用不同比例的甲醇-二氯甲烷溶液(5%,10%,15%,20%)进行并比较洗脱效果,用15mL离心管收集洗脱液;将离心管置于氮吹仪上,于50 ℃水浴条件下,氮吹蒸发至近干,用甲醇定容至2.0mL,过有机滤膜待测。
(2)LC-Florisil固相萃取柱:LC-Florisil固相萃取柱首先分别用5.0mL 10%丙酮-正己烷溶液和5.0mL 正己烷活化,样品用2.0 mL 10%丙酮-正己烷溶液溶解后加入LC-Florisil固相萃取柱,用15 mL 离心管收集洗脱液,洗脱时分别采用不同比例的丙酮-正己烷溶液(10%,20%,30%,40%)冲洗烧杯后淋洗LC-Florisil固相萃取柱并比较洗脱效果;将离心管置于氮吹仪上,于50 ℃水浴条件下,氮吹蒸发至近干,用甲醇定容至2.0mL,过有机滤膜待测。
(3)碱性氧化铝固相萃取柱:碱性氧化铝固相萃取柱首先分别用5.0 mL 10%丙酮-正己烷溶液活化,样品用2.0mL 10%丙酮-正己烷溶液溶解后加入碱性氧化铝固相萃取柱,用15mL离心管收集洗脱液,洗脱时分别采用不同比例的丙酮-正己烷溶液(10%,20%,30%,40%)冲洗烧杯后淋洗碱性氧化铝固相萃取柱并比较洗脱效果;将离心管置于氮吹仪上,于50 ℃水浴条件下,氮吹蒸发至近干,用甲醇定容至2.0mL,过有机滤膜待测。
1.2.6 样品测定 待超高效液相色谱-串联质谱仪稳定后,在优化的色谱和质谱条件下,将一定浓度的氯吡脲标准溶液重复进样,当相邻两针进样后的响应值变化小于3.0%时,分别按照标准溶液、样品溶液、样品溶液和标准溶液的顺序进样,以标准品的保留时间和定性离子的相对丰度对氯吡脲进行定性分析,以标准溶液和样品溶液定量离子的峰面积进行定量分析。
1.2.7 结果计算 参照文献[17]的计算方法,对氯吡脲浓度进行计算,并按式(1)计算样品中的氯吡脲残留含量:

式中:
ω—— 氯吡脲残留含量,mg/kg;
ρ—— 氯吡脲标准溶液的质量浓度,mg/L;
A—— 样品中氯吡脲的峰面积,mAu·s;
As—— 氯吡脲标准溶液中的峰面积,mAu·s;
V1—— 提取溶液总体积,mL;
V2—— 吸取用于检测的提取溶液的体积,mL;
V3—— 样品溶液定容体积;mL;
m—— 称样量,g。
2 结果与讨论
2.1 质谱条件的优化选择
根据氯吡脲的化学结构特征,通过Q1SCAN 模式分别对其标准溶液采用ESI+和ESI-两种模式分析,结合氯吡脲的分子量,分析发现氯吡脲在ESI+模式下m/z 248[M +H]+处出现分子离子峰,而在ESI-模式下出现了m/z 246[M - H]–的分子离子峰,但是通过比较两种模式下的响应值(图2),可知氯吡脲在ESI+模式下明显比ESI-模式下的响应值大,因此选择ESI+模式进行后续的相关分析。
同时通过Product Ion Scan模式进行子离子及相关条件的优化,得到MRM 离子对和优化后的相关条件,见表2、3。
根据以上优化得到的相关质谱条件,将10ng/mL 的氯吡脲标准工作溶液进样分析,得到氯吡脲标准在MRM 模式下的总离子流图谱(TIC)见图3,保留时间为5.468min,图4为MRM 模式下248→93、248→129母离子和两种子离子组合的图谱,其中248→129为定量离子。
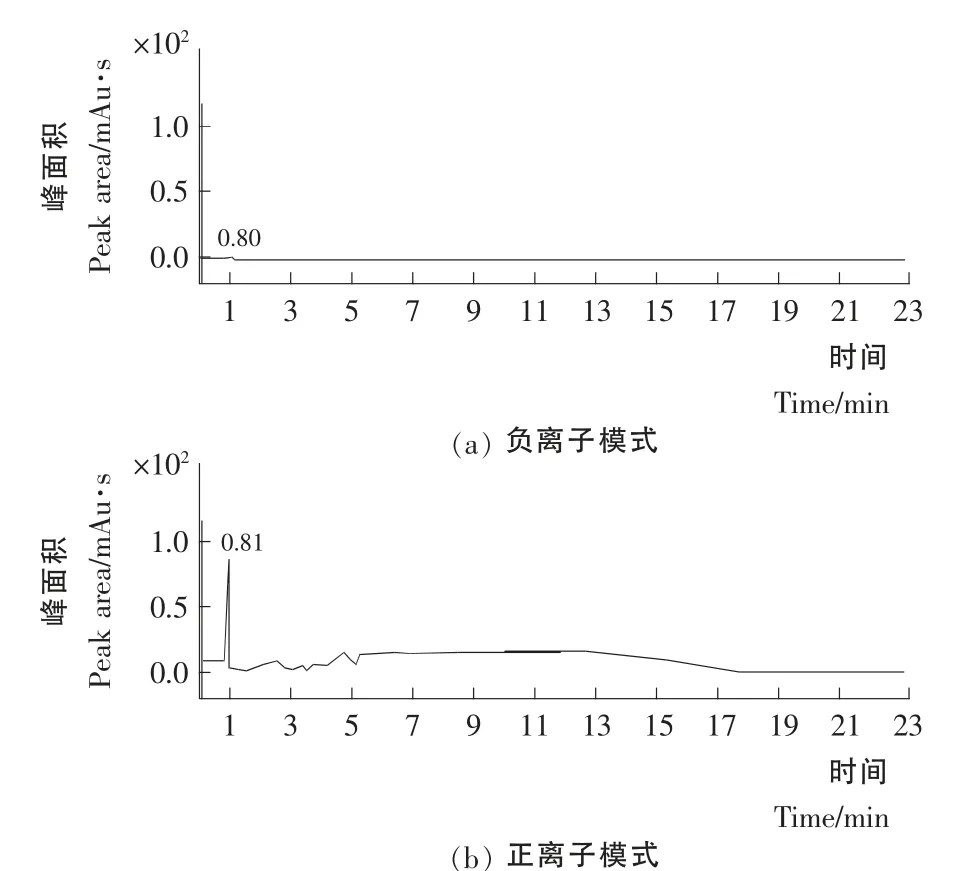
图2 两种电离方式下氯吡脲的响应值Figure2 The response of forchlorfenuron by two ionization mode

图3 氯吡脲标准溶液超高效液相色谱-串联质谱总离子流图谱(10ng/mL)Figure3 The UPLC-MS/MS total ion current spectrum of the forchlorfenuron stand ard solution(10ng/mL)
2.2 提取溶剂的选择
在氯吡脲残留检测分析中常用的提取溶剂主要有乙腈[19]和甲醇[20]等,本试验中以葡萄样品为试验对象,分别选用了乙腈、甲醇、丙酮和乙酸乙酯4种农药残留检测中常用的提取溶剂,并在相同的试验条件下,以10.0μg/kg的添加水平进行加标回收试验,提取效果图谱见图5,4种常规提取溶剂的回收率依次为93.1%,85.3%,69.8%,67.5%,表明丙酮和乙酸乙酯的提取效果比乙腈和甲醇差,而乙腈的提取效果比甲醇好,因此本试验中采用乙腈作为氯吡脲残留检测中的提取溶剂。

表2 氯吡脲检测条件优化结果Table2 The optimization results of forchlorfenuron determination conditions

表3 MRM 模式下氯吡脲的质谱参数优化结果Table3 The optimization results of forchlorfenuron MS parameters by MRM mode
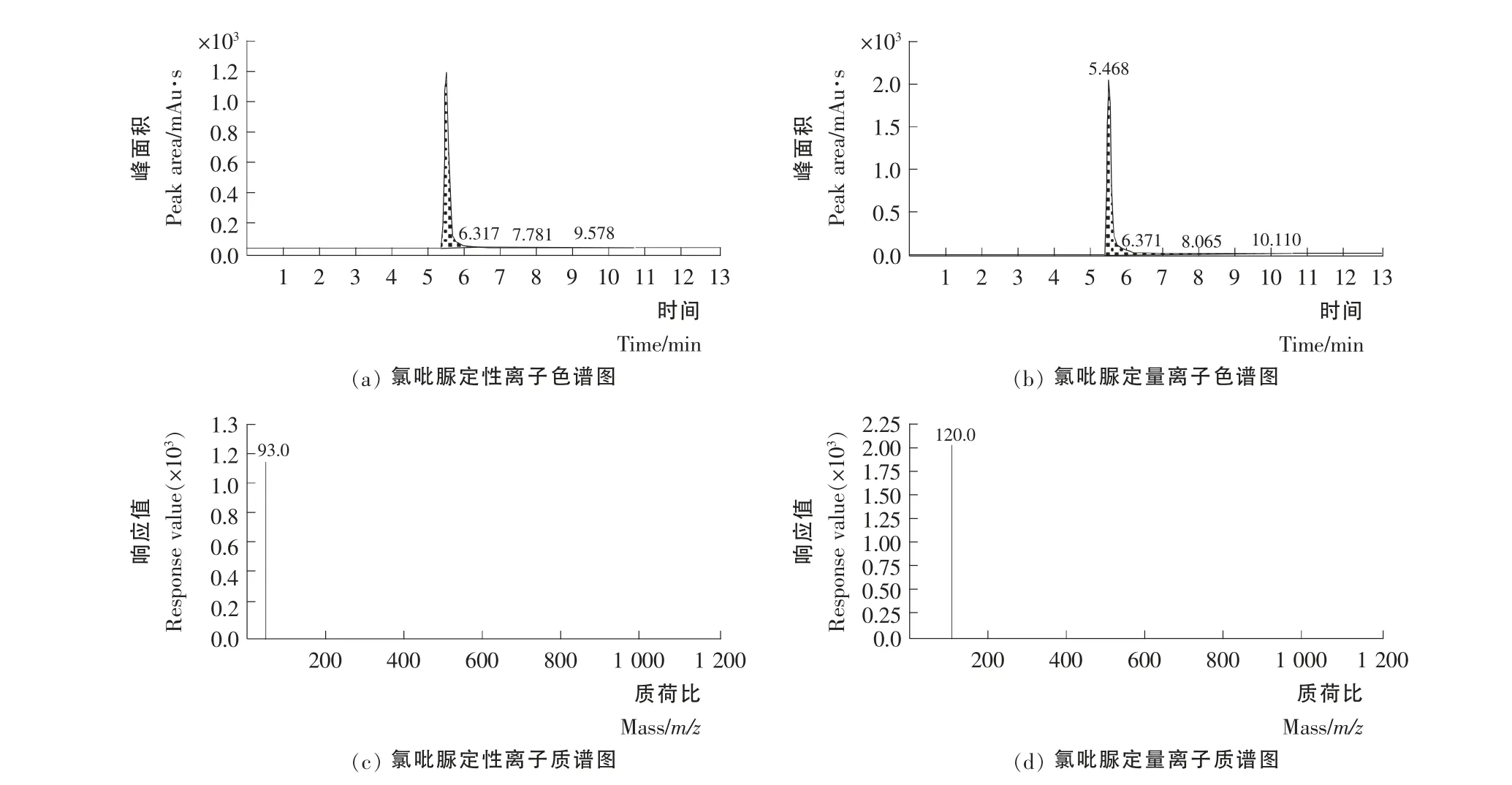
图4 氯吡脲标准溶液超高效液相色谱-串联质谱子离子图谱(10ng/mL)Figure4 The UPLC-MS/MS product ion spectrum of the forchlorfenuron standard solution(10ng/mL)
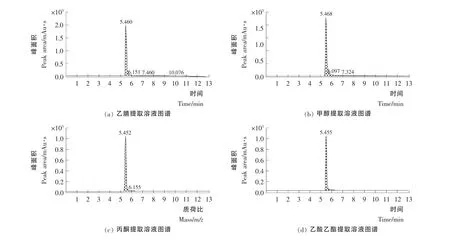
图5 不同提取溶剂的提取效果比较Figure5 The comparison of the extraction effect of different extraction solvent
2.3 固相萃取柱洗脱条件优化
本试验中以葡萄样品为试验对象,以10.0μg/kg的添加水平进行加标回收试验,在相同的试验条件下分别优化了LC-NH2、LC-Florisil和碱性氧化铝固相萃取柱的洗脱条件,由图6可知:LC-NH2固相萃取柱随着甲醇比例的增大回收率逐渐增大,但是当甲醇比例超过15%以后其回收率降低;LC-Florisil固相萃取柱随着丙酮比例的增大回收率逐渐增大,但是当丙酮比例超过20%以后其回收率增大趋势变缓,甚至没有变化;碱性氧化铝固相萃取柱随着丙酮比例的增大回收率逐渐增大,其回收率在丙酮比例为30%时最大。因此确定LC-NH2、LC-Florisil和碱性氧化铝固相萃取柱的洗脱条件分别为:15%甲醇-二氯甲烷溶液,20%丙酮-正己烷溶液,30%丙酮-正己烷溶液。

图6 3种固相萃取柱洗脱条件优化Figure6 The elution condition optimization of there kinds of solid phase extraction column
2.4 固相萃取柱净化富集效果比较
试验分别比较了LC-NH2、LC-Florisil和碱性氧化铝固相萃取小柱的净化富集效果,以葡萄样品的加标回收率为比较指标,最终确定了NH2固相萃取柱对葡萄中氯吡脲的净化富集效果较优,不同固相萃取柱在不同添加浓度下的回收率见表4。

表4 3种固相萃取小柱的加标回收率及相对标准偏差Table4 The spiked recoveries and relative standard deviation of three kinds of solid phase extraction column(n =3)
2.5 线性范围和检出限
将不同浓度的标准工作溶液进行UPLC-MS/MS 分析,以浓度为横坐标、峰面积为纵坐标作图,得到氯吡脲的标准曲线、线性回归方程、相关系数。结果表明氯吡脲在0.5~10ng/mL质量浓度范围内线性关系较好(见图7),检出限为0.1μg/kg,定量限为0.3μg/kg。

图7 氯吡脲标准溶液工作曲线Figure7 The standard solution curve of forchlorfenuron
2.6 回收率和精密度
采用标准添加回收的方法,在不含氯吡脲的水果基质中添加不同浓度的氯吡脲标准物质,每种样品设置3个添加水平,分别为0.5,2.0,5.0μg/kg,按照上述的样品前处理、固相萃取和UPLC-MS/MS 方法测定并计算回收率和精密度,结果见表4。由表4可知,3种固相萃取柱的净化富集效果均能达到常规的检测要求,但是LC-NH2固相萃取柱对于氯吡脲的净化富集效果相对较好,回收率范围为81.2%~96.4%,相对标准偏差范围为3.7%~4.5%。
2.7 水果样品的测定
对市场上购买的10个葡萄样品中氯吡脲残留情况进行测定,测定结果为10个葡萄样品中均未检测出氯吡脲。
3 结论
本试验以葡萄为基质,首先针对氯吡脲的化学性质,分别比较了乙腈、甲醇、丙酮和乙酸乙酯4种常规提取溶剂对氯吡脲的提取效果,同时根据LC-NH2、LC-Florisil和碱性氧化铝固相萃取柱中填料性质的不同,在不同的洗脱溶剂比例下分别比较了3种固相萃取柱对氯吡脲的富集净化效果,并在此基础上对串联质谱的相关条件进行优化。结果表明,乙腈对葡萄中的氯吡脲具有较好的提取效果,LC-NH2固相萃取柱对氯吡脲具有较好的富集净化效果;优化后的串联质谱条件对氯吡脲的检测具有较高的灵敏度,该方法操作简便,准确度高、重现性好,适于水果中氯吡脲残留的分析检测。
1 Cruz-Castillo J,Woolley D,Lawes G.Kiwifruit size and CPPU response are influenced by the time of anthesis[J].Scientia Horticulturae,2002,95(1):23~30.
2 Adaniya S,Minemoto K,Moromizato Z,et al.The use of CPPU for efficient propagation of pineapple[J].Scientia Horticulturae,2004,100(1):7~14.
3 Blank R,Richardson A,Oshima K,et al.Effect of a forchlorfenuron dip on kiwifruit fruit size[J].New Zealand Journal of Crop and Horticultural Science,1992,20(1):73~78.
4 Chen W,Jiao B,Su X,et al.Dissipation and residue of forchlorfenuron in citrus fruits[J].Bulletin of Environmental Contamination and Toxicology,2013,90(6):756~760.
5 Peppi M C,Fidelibus M W.Effects of forchlorfenuron and abscisic acid on the quality of‘Flame Seedless’grapes[J].Hort-Science,2008,43(1):173~176.
6 Um Y,Lee J,Kang K,et al.Effects of forchlorfenuron application on the induction of parthenocarpic fruit and fruit quality in watermelon(Citrullus vulgaris S.)under greenhouse condition[J].Journal of the Korean Society for Horticultural Science,1995,36(3):293~298.
7 Hu Q,Nelson W J,Spiliotis E T.Forchlorfenuron alters mammalian septin assembly,organization,and dynamics[J].Journal of Biological Chemistry,2008,283(43):29 563~29 571.
8 Mohamed M F,Read P E,Coyne D P.Effect of thidiazuron(TDZ)and forchlorfenuron (CPPU)on shoot organogenesis from nodal tissue cultures of common and faba beans[J].Hort Science,1991,26(6):681~681.
9 张志恒,汤涛,徐浩,等.果蔬中氯吡脲残留的膳食摄入风险评估[J].中国农业科学,2012,45(10):1 982~1 991.
10 Suárez-Pantaleón C,Wichers J,Abad-Somovilla A,et al.Development of an immunochromatographic assay based on carbon nanoparticles for the determination of the phytoregulator forchlorfenuron[J].Biosensors and Bioelectronics,2012,42:170~176.
11 Surez-Pantalen C,Mercader J V,AgullC,et al.Hapten synthesis and polyclonal antibody-based immunoassay development for the analysis of forchlorfenuron in kiwifruit[J].Journal of Agricultural and Food Chemistry,2010,58(15):8 502~8 511.
12 龚勇,单炜力,简秋,等.黄瓜,西瓜和土壤中氯吡脲残留分析方法[J].农药科学与管理,2011,32(11):30~34.
13 Hu J-Y,Li J-Z.Determination of forchlorfenuron residues in watermelon by solid-phase extraction and high-performance liquid chromatography[J].Journal of AOAC International,2006,89(6):1 635~1 640.
14 周艳明,忻雪.高效液相色谱法测定果蔬中7种植物激素的残留量[J].食品科学,2010,31(18):301~304.
15 Valverde A,Aguilera A,Ferrer C,et al.Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the buffered quechers method[J].Journal of Agricultural and Food Chemistry,2010,58(5):2 818~2 823.
16 Valverde A,Piedra L,Aguilera A,et al.Analysis and residue levels of forchlorfenuron(CPPU)in watermelons[J].Journal of Environmental Science and Health,2007,42(7):801~807.
17 邵金良,黎其万,刘宏程,等.高效液相色谱法测定蔬菜中8种氨基甲酸酯类农药残留[J].现代食品科技,2011,27(7):856~860.
18 纪淑娟,于基成,高兴,等.高效液相色谱法测定甘蓝中多菌灵残留[J].食品与机械,2011,27(2):65~67.
19 Shi X,Jin F,Huang Y,et al.Simultaneous determination of five plant growth regulators in fruits by modified quick,easy,cheap,effective,rugged,and safe(QuEChERS)extraction and liquid chromatography–tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,2011,60(1):60~65.
20 张莹,鹿毅,杨涛,等.高效液相色谱-串联质谱法测定果蔬中7种植物生长促进剂残留[J].分析测试学报,2012,31(4):442~447.
