均匀试验设计优化酶法提取燕麦全粉蛋白质研究
2013-03-19刘建垒李英杰郝利平
刘建垒 李英杰 郝利平
(山西农业大学食品科学与工程学院,太谷 030801)
燕麦,学名Avena sativaL.,又被称为莜麦、雀麦、玉麦、铃铛麦。燕麦被称为“第三主粮”,现代研究表明燕麦具有降血脂、降血糖、免疫增强、抗氧化、益生等多种保健功能[1-2],是美国《时代》专刊推荐现代人十大最健康的食品之一。
燕麦中蛋白质含量高达15%,在禾谷类粮食中居首位[3],且同时具备人体8种必需氨基酸,其配比接近FAO/WHO推荐的模式;限制性氨基酸赖氨酸和色氨酸含量高[4-5];燕麦蛋白质净利用率(NPU)达69.1~72.4;功效比(PER)达2.25~2.38;氨基酸分数(AAS)高达68.2,生物价(BV)为 74.5~79.6,均是植物蛋白中的佼佼者[6-8]。
以往研究报道主要以燕麦麸为原料[3,9],对燕麦全粉的研究较少,且多数用碱提酸沉法[10-11],而酶法提取燕麦全粉蛋白的研究鲜见报道。与碱提酸沉法相比,酶法具有提取率高,反应条件温和,易于控制等优点,且产品的营养价值及生物功能较优[12]。本研究选用产量高、抗旱性好,适应性强的燕麦新品种晋燕14号为研究对象,用均匀试验设计对酶法提取燕麦蛋白的工艺进行优化,以期为燕麦全粉中蛋白质的提取和利用提供理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
燕麦:晋燕14号,山西省农业科学院高寒区作物研究所(脱脂燕麦全粉中蛋白质含量15.6%)。
碱性蛋白酶、中性蛋白酶、酸性蛋白酶:北京奥博星生物技术有限责任公司;中分子质量蛋白Marker:北京康为世纪生物科技有限公司;其他试剂均为分析纯。
1.2 主要仪器与设备
KDN型定氮仪(HYP8.14.20孔消化装置、2C型蒸馏装置):上海钎检仪器有限公司;JY-15A 750克多功能粉碎机:永康市江业制造有限公司;UV-2100型紫外可见分光光度计:尤尼柯(上海)仪器有限公司;pHS-25型数显pH计:上海精密科学仪器有限公司;JDG-0.2真空冻干试验机:兰州科近真空冻干技术有限公司;SHY-2A水浴恒温振荡器:江苏金坛市金城国胜实验仪器厂;DYCZ-24D型电泳槽、DYY-6C型电泳仪:北京市六一仪器厂;Image LabTM4.0.1全自动图像获取和分析软件,Molecular Imager Gel DocTMXR+成像系统:美国Bio-Rad Laboratories公司等。
1.3 试验方法
1.3.1 工艺流程
脱脂燕麦全粉的制备:将新鲜燕麦清理后用JY-15A型多功能粉碎机粉碎30 s,用正己烷按1∶3(m/V)比例室温下振荡脱脂3 h,过滤,并用冷的正己烷冲洗3次,冲洗后置于通风橱中风干,4℃保存备用。
工艺流程:脱脂燕麦全粉→酶法提取→灭酶→离心→上清液等电点沉淀→离心→沉淀物→水洗至中性→真空冷冻干燥→燕麦蛋白。
1.3.2 酶制剂的筛选
试验所用蛋白酶及其反应条件如表1所示。以0、20、40、60、80、100、120、140 U/g分别加入碱性蛋白酶、中性蛋白酶、酸性蛋白酶,液料比15∶1,调至各蛋白酶的适宜条件,恒温水浴震荡反应60 min,85℃灭酶 10 min,4 000 r/min离心 15 min,测上清液中蛋白含量,计算蛋白提取率。

表1 试验所用蛋白酶的活性及反应条件
1.3.3 均匀设计优化酶法提取燕麦蛋白的工艺参数
根据单因素试验结果选择试验条件,对加酶量、液料比、pH、浸提温度、浸提时间进行五因素十水平U10(1010)均匀设计[13],因素水平表见表 2,以蛋白提取率为评价指标,确定酶法制备燕麦蛋白的最佳工艺条件。

表2 U10(1010)均匀试验因素水平表
1.3.4 燕麦蛋白等电点的确定
在得到的最佳提取条件下提取燕麦蛋白,取11等份蛋白提取上清液,分别用0.2 mol/L HCl缓慢调其 pH至 3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8,静置6 h,4 000 r/min离心15 min,测定沉淀前后上清液中蛋白质的含量,计算蛋白分离率。
1.3.5 测定与计算方法
固体中蛋白质含量测定:凯氏定氮法,参照GB 5009.5—2010。
溶液中蛋白质含量测定:Bradford法[14],其标准曲线见图1。

图1 Bradford法测定蛋白含量标准曲线
蛋白质提取率=(提取液中蛋白质的含量-添加酶中蛋白质的含量)/(燕麦粉中蛋白质的含量)×100%
产品纯度=固形物中总蛋白的质量/总固形物质量×100%
蛋白分离率=(沉淀前上清液中蛋白含量-沉淀后上清液中蛋白含量)/(沉淀前上清液中蛋白含量)×100%
1.3.6 燕麦蛋白的SDS-PAGE电泳分析
采用5%浓缩胶、15%分离胶对得到的燕麦蛋白质进行SDS-PAGE电泳分析。凝胶厚度1.5 mm,燕麦蛋白上样15μL(预先标准化为1 mg/mL)。稳压电泳,初始电压80 V,样品进入分离胶后改为100 V,电泳3.5 h。用考马斯亮蓝R-250染色1 h,用脱色液(乙醇∶乙酸∶蒸馏水 =5∶2∶13)脱色 12 h。用图像获取和分析软件拍照并进行分子质量分析。
1.4 数据处理
每个试验重复3次,以估计试验误差。
2 结果与分析
2.1 不同蛋白酶对提取率的影响
从表3可以看出,3种蛋白酶对燕麦蛋白提取率的影响大小依次为碱性蛋白酶>中性蛋白酶>酸性蛋白酶,且中性蛋白酶和酸性蛋白酶的提取率远低于碱性蛋白酶,这是由于中性和酸性条件下,蛋白质溶解度低造成的。
当碱性蛋白酶的用量小于100 U/g时,燕麦蛋白提取率随着加酶量的增加而增加,可能是由于加酶量的增加提高了酶对不溶性蛋白的作用能力,促进了燕麦蛋白的溶出[15]。当加酶量超过100 U/g时,随着加酶量的增加燕麦蛋白的提取率降低,可能是由于过多的酶将蛋白质过度水解,空间结构发生改变,疏水性基团暴露出来,使蛋白质溶解度下降。因此,选定碱性蛋白酶为提取酶类,在加酶量为100 U/g条件下进一步研究其他因素对燕麦蛋白提取的影响。
2.2 酶法提取燕麦蛋白单因素试验结果
2.2.1 液料比对蛋白质提取率的影响
从图2可以看出,蛋白提取率随液料比的增加而升高,当液料比达18∶1时,提取率最高,可达79.71%;当液料比超过18∶1后,提取率略有降低。这是由于液料比较小时,体系黏度较大,不利于传质;但液料比过大,酶与底物的接触几率下降,使蛋白质的提取率降低[16]。
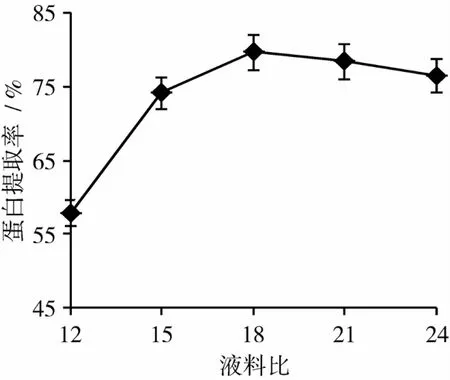
图2 液料比对蛋白质提取率的影响
2.2.2 pH对蛋白质提取率的影响
从图3可以看出,燕麦蛋白的提取率随pH的增大而提高,当pH值为11时,燕麦蛋白的提取率最大,达79.90%,之后随着pH的增加,提取率变化不大。pH超过11时,燕麦蛋白提取液呈黄褐色,有异味,且变得黏稠,不利于下一步的分离。这可能是因为过高的pH使蛋白质-蛋白质之间的相互作用加强造成溶液黏度增加[17],蛋白质发生了变性。

图3 pH值对蛋白质提取率的影响
2.2.3 浸提温度对蛋白质提取率的影响
从图4可以看出,40℃至50℃时,燕麦蛋白的提取率随温度的升高而增大,从50℃至55℃,提取率变化不大,仅由79.70%升高到79.99%,之后随着温度的升高,提取率反而降低。一方面,温度过高时,由于热动能的增加导致蛋白质结构展开、非极性基团暴露、聚集和沉淀作用[17],使蛋白的溶解度降低和酶活力减弱;另一方面,温度过高使淀粉糊化,不利于蛋白的溶出,反应速度迅速下降。

图4 浸提温度对蛋白质提取率的影响
2.2.4 浸提时间对蛋白质提取率的影响
从图5可以看出,20~60 min内,蛋白质的提取率随着时间的延长迅速增大,其原因可能为开始时底物浓度相对较高,且淀粉的结构随着时间的延长而越来越松散,从而有利于酶解的传质过程。60 min时提取率达最大值,为79.87%;60 min后,随时间的进一步延长,提取率反而略有下降,原因可能是酶作用时间的延长,使蛋白质过度水解,空间结构发生改变,疏水性基团暴露出来,造成溶解度降低的缘故。
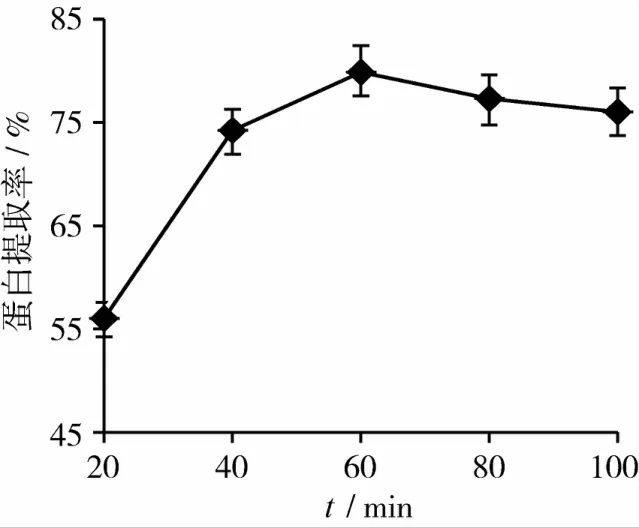
图5 浸提时间对蛋白质提取率的影响
2.3 均匀设计优化酶法制备燕麦蛋白的工艺参数
在以上单因素试验基础上,选定均匀试验设计的条件,确定因素水平表(表4)。表4显示了均匀设计方案与结果,用直观分析法可以看出,试验5的提取率最高,达83.41%,即加酶量90 U/g,pH 11.2,温度52℃,液料比17∶1,时间45 min。但由于 pH过高,得到的燕麦蛋白提取液颜色加深,呈黄褐色,有异味,且变得黏稠,不利于下一步的分离。为得到更优的结果,进一步用SAS8.1对试验结果进行逐步回归分析,建立逐步回归的多项式模型。
得到回归方程:Y=2.339X1+4.864X2+28.019X3+0.596X4-0.012 8X12-0.262X32+0.012 4X1X4-0.001 6X4X5-854.672,校正后的决定系数 R2=0.998 7。

表4 U10(1010)均匀设计方案与结果(D=0.428 6)
进一步对回归关系及各偏回归系数进行显著性检验。对回归关系进行方差分析(表5)可知,由于F0.01(8,1)=5 982,F0.05(8,1)=238.9,故 F0.01(8,1)>F>F0.05(8,1),0.05>P>0.01,回归关系显著。

表5 回归关系的方差法分析
对各偏回归系数进行t检验(表6),结果表明:X1(加酶量)、X2(pH)、X3(温度)对燕麦蛋白提取率的影响达显著水平,X4(液料比)和X5(时间)影响不显著。根据t检验的显著程度及偏回归平方和的大小可判断,各因素对指标影响的主次顺序为温度>加酶量>pH>液料比>时间。
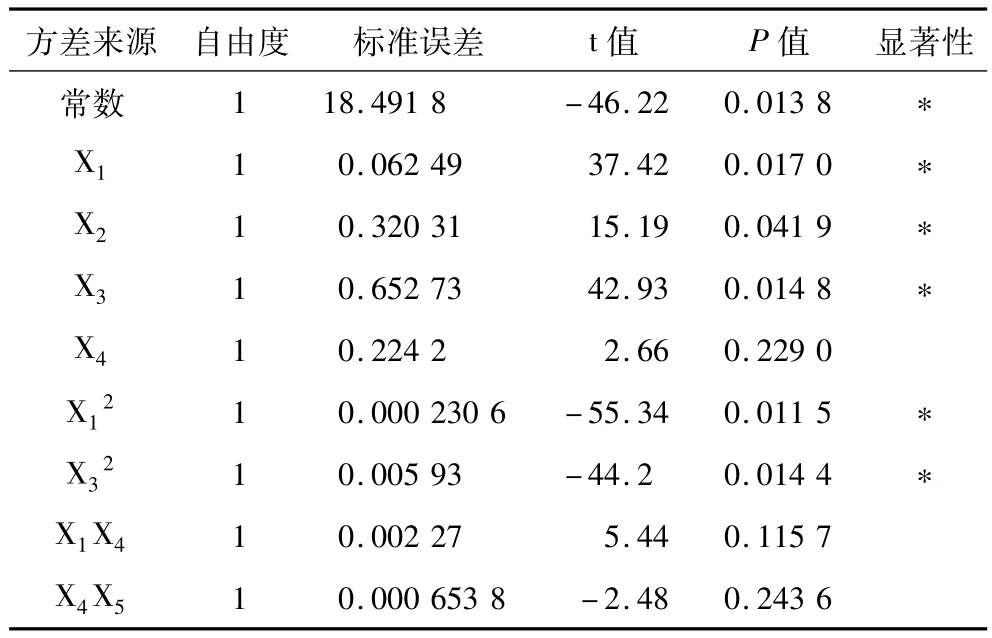
表6 对常数项及偏回归系数的t检验
用规划求解参数法[13]在试验空间内找到极值点X1=100.358,X2=10.5,X3=53.493,X4=18,X5=60,即加酶量 100.358 U/g,pH 10.5,温度 53.49℃,液料比18∶1,时间60 min,在此条件下,理论提取率为83.31%。验证试验得燕麦蛋白的提取率为84.09%,与理论提取率仅差0.78%。进一步用凯氏定氮法测得燕麦蛋白纯度达89.16%,说明在此条件下提取的燕麦蛋白提取率和纯度都较高。
2.4 燕麦蛋白等电点的确定
等电点沉淀是为了确保提取液中的蛋白质能最大程度的沉淀下来。图6所示为不同pH条件下提取液中的蛋白质的沉淀效果。从图6中可以看出,在pH 4.4时,燕麦蛋白的分离率最大,达93.33%,故燕麦蛋白的等电点为4.4。

图6 燕麦蛋白等电点的确定
2.5 燕麦蛋白SDS-PAGE电泳分析
由燕麦蛋白的SDS-PAGE图谱(图7)可以看出,酶法制备的燕麦蛋白在65.2~12.5 ku上都有条带分布,且主要集中在31.3~40.0 ku(条带百分比占39.86%),21.0~21.9 ku(条带百分比占34.45%)2个区间,其中含量超过10%的条带有3条,分别为:21.0 ku(条带百分比占26.88%),38.3 ku(条带百分比占16.32%),40.0 ku(条带百分比占12.60%),与管骁等[18]的研究结果基本一致。此外,与碱法相比,酶法制备燕麦蛋白的 58.6、53.0、42.5、29.3、28.0、25.7 ku条带缺失,可能是因为酶将其水解的缘故。

图7 燕麦蛋白的SDS-PAGE图谱
3 结论
3.1 3种蛋白酶对燕麦蛋白提取率的影响大小依次为碱性蛋白酶>中性蛋白酶>酸性蛋白酶,选定碱性蛋白酶为提取酶类。
3.2 碱性的蛋白酶提取燕麦蛋白的最佳工艺为:加酶量100.358 U/g,pH 10.5,温度53.49℃,液料比18∶1,时间 60 min,在此条件下,提取率为84.09%,纯度达89.16%,得到的燕麦蛋白的等电点为4.4。
3.3 酶法制备燕麦蛋白在65.2~12.5 ku上都有条带分布,其中74.3%的条带集中在31.3~40.0 ku和21.0~21.9 ku2个区间,与碱法相比,有条带缺失。
参考文献
[1]Mohamed A,Biresaw G,Xu Jingyuan,et al.Oats protein isolate:thermal,rheological,surface and functional properties[J].Food Research International,2008,32:43-50
[2]周素梅,申瑞玲.燕麦的营养及其加工利用[M].北京:化学工业出版社,2009:68-97
[3]管骁.燕麦麸蛋白及ACE抑制肽制备工艺与功能特性研究[D].无锡:江南大学,2007
[4]马晓凤,刘森.燕麦品质分析及产业化开发途径的思考[J].农业工程学报,2005,21(z1):242-244
[5]路长喜,周素梅,王岸娜.燕麦的营养与加工[J].粮油加工,2008(1):89-91
[6]PedóI,Sgarbieri V C,Gutkoski L C.Protein evaluation of four oat(Avena sativaL.)cultivars adapted for cultivation in the south of Brazil[J].Plant Foods for Human Nutrition(Formerly Qualitas Plantarum),1999,53(4),297-304
[7]Mirmoghtadaie L,Kadivar M,Shahedi M.Effects of succinylation and deamidation on functional properties of oat protein isolate[J].Food Chemistry,2008,56:67-73
[8]江志炜,沈蓓英,潘秋琴.蛋白质加工技术[M].北京:化学工业出版社,2002:76-84
[9]赵素斌,张晓平,任清.3种方法提取燕麦麸蛋白及其产物的比较[J].食品科学,2010,31(14):71-79
[10]徐向英,王岸娜,林伟静,等.响应面法优化燕麦全粉中蛋白质提取工艺[J].食品与机械,2011,27(5):96-99
[11]金山.燕麦功能成分的提取及燕麦饼干加工工艺研[D].杨凌:西北农林科技大学,2010
[12]王文高,陈正行,姚惠源.不同蛋白酶提取大米蛋白质的研究[J].粮食与饲料工业,2002(2):41-42
[13]王钦德,杨坚.食品试验设计与统计分析(第2版)[M].北京:中国农业大学出版社,2009:349-364
[14]谢笔钧,何慧.食品分析[M].北京:科学出版社,2009:180-181
[15]吴晓红,郑月明,付兆龙,等.酶法提取红松种子蛋白工艺的研究[J].中国粮油学报,2009,24(9):144-148
[16]谈佳玉,王承明.响应面法优化酶法制备花生蛋白的工艺研究[J].中国粮油学报,2011,26(8):100-104
[17]Fennema O R著.食品化学[M].王璋,许时婴,江波,等译.第3版.北京:中国轻工业出版社,2003:295-358
[18]管骁,姚惠源,张鸣镝.燕麦麸分离蛋白的酶解对其功能性质的影响[J].农业工程学报,2007,22(11):217-222.
