酶解十二烷基硫酸钠预处理面筋蛋白工艺优化
2013-03-19钟昔阳张淑芬徐玉红
钟昔阳 张淑芬 徐玉红 吴 欣
(合肥工业大学生物与食品工程学院,合肥 230009)
生物活性肽具有参与机体免疫调节[1]、抗氧化[2]、降血压[3]及抗菌性[4]等多种生物学功能,在食品、医药、饲料工业得到广泛的开发和应用,以小麦面筋蛋白、花生蛋白、大豆蛋白等植物性蛋白为原料酶解制备生物活性肽成为当前粮油深加工领域研究的热点[5-6]。与花生蛋白、大豆蛋白性质不同,小麦面筋蛋白含有大量的非极性氨基酸残基(如脯氨酸、亮氨酸)和极性的不可电离的谷氨酰胺残基,侧链带电荷氨基酸含量低,因此在水溶液体系中溶解性极低[7-8],在酶解过程中,酶分子与蛋白质底物无法充分接触,造成水解度低,酶解进程慢,酶解效率低[9]。因此,寻找一种高效酶解小麦面筋蛋白的新方法成为当前国内外学者研究的重点和难点。
采用物理、化学方法预处理蛋白原料再进行酶解是提高蛋白酶解效率的一种重要手段。在小麦面筋蛋白的酶解加工中,赵海峰等[10]采用挤压预处理后,利用复合蛋白酶酶解小麦面筋蛋白,水解度明显提高。Liao等[11]分别采用 0.082 mol/L乙酸、0.137 mol/L盐酸在室温下与小麦面筋蛋白反应2 h后用胰蛋白酶水解,水解度和氮溶解指数均有所提高。Kanerva等[12]采用脱酰胺处理后再酶解小麦面筋蛋白,溶解性、表面活性均有所增加,且酶解产物降低了抗体反应。Drago等[13]对小麦面筋蛋白进行适当热处理后再酶解,其溶解度和水解度都显著增加。Popineau等[14]、Berot等[15]研究发现在酶解小麦面筋蛋白前加入一定量的半胱氨酸,可有效提高其酶解效率。
十二烷基硫酸钠(SDS)是一类含有亲水亲油基的阴离子表面活性剂,能降低溶质和溶剂间的表面张力,广泛用于牙膏、香波、化妆品、制药、化工等行业。SDS的安全性较高,在我国它作为食品加工助剂、食品用消毒剂用于蛋糕、饮料、食用油生产以及餐具、食品加工设备的消毒[16]。此外,在面筋蛋白的增溶[17]、可食性膜的生产[18]中 SDS也得到了研究应用。在中药材加工行业,已有学者开展了利用SDS提取薯蓣皂苷[19]、姜黄素[20]、黄酮类[21]等中药材活性成分的研究。笔者近年来也开展了SDS的相关应用研究,在前期试验研究中发现,加入SDS预处理小麦面筋蛋白后再酶解可以较好提高其酶解效率。本研究在此基础上,通过单因素、正交试验进一步研究碱性蛋白酶酶解体系下各种工艺参数对SDS预处理小麦面筋蛋白的酶解效率影响,优化确定最佳工艺条件,以期寻找一种提高小麦面筋蛋白酶解效率制备生物活性肽的加工新方法。
1 材料与方法
1.1 材料与试剂
小麦面筋蛋白(粗蛋白79.63%,水分6.17%):山东江口生物科技有限公司;碱性蛋白酶(BR,200 000 U/g):北京奥博星生物技术有限责任公司;SDS(食品级):郑州金利来生物科技有限公司;牛血清白蛋白(BR):上海源聚生物科技有限公司;三氯乙酸(AR):天津市光复精细化工研究所;甲醛溶液(AR):无锡市展望化工试剂有限公司。
1.2 仪器与设备
HH-2数显恒温水浴锅:江苏省金坛市荣华仪器有限公司;SC-3614低速离心机:安徽中科中佳科学仪器有限公司;722E型可见分光光度计:上海光谱仪器有限公司;UDK 152型自动凯氏定氮仪:意大利VELP公司;BL-220H电子天平:上海皖衡电子仪器有限公司;FJ-200高速分散均质机:上海标本模型厂;PHS-3B精密pH计:上海虹益仪器仪表有限公司。
1.3 小麦面筋蛋白酶解工艺流程
小麦面筋蛋白溶于一定浓度的SDS水溶液→均质(8 000 r/min,20 s)→调节 pH→加入一定量的碱性蛋白酶→50℃恒温酶解一定时间→灭酶(95℃,15 min)→离心(2 862×g,15 min)→上清液(即为酶解液)→测DH和多肽得率
1.4 试验方法
1.4.1 水解度的测定
水解度(DH)是衡量蛋白质水解程度的指标,一般指蛋白质分子中断裂的肽键占蛋白质分子中总肽键的比例。由于每裂解一个肽键同时新生成一个氨基和一个羧基,因此,定量测出游离氨基氮含量就可以计算出断裂的肽键。
取5 mL混合水解液,加入60 mL沸腾后又冷却的蒸馏水,调节pH至8.2,加入10 mL中性甲醛,反应片刻,用0.1 mol/L标准NaOH滴定到pH=9.2,记录所耗NaOH的量,同时作空白试验[22]。
游离氨基酸含量(mg/mL)=[N×(V1-V2)×14.008]÷5
DH=[游离氨基氮(mg/mL)×上清液体积(mL)×10-3]/[样品质量(g)×总氮含量)]×100%
式中:N为 NaOH标准溶液浓度/mol/L;V1为样品消耗 NaOH标准溶液体积/mL;V2为空白消耗NaOH标准溶液体积/mL;14.008/1 mL浓度为1.000 mol/L NaOH标准溶液相当于氮的质量/mg。
1.4.2 多肽得率的测定
1.4.2.1 牛血清白蛋白标准曲线回归方程的建立
准确称取1.000 0 g牛血清白蛋白溶于一定量的蒸馏水中,在4℃冰箱中放置使牛血清白蛋白完全溶解,取出,放至室温,定容至 100 mL,配制成10 mg/mL的标准蛋白溶液,再稀释成2~10 mg/mL一系列不同浓度的蛋白溶液,取稀释液1 mL,加入4 mL双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30 min,于540 nm处进行比色测定,每个样品测3次取平均值,以牛血清白蛋白浓度为横坐标,以吸光度值为纵坐标,得标准曲线的回归方程为y=0.055 8x+0.006 4,R2=0.998 2,式中:x为牛血清白蛋白浓度(mg/mL),y为在540 nm处的吸光值。
1.4.2.2 酶解液多肽含量的测定
三氯乙酸沉淀法:参照鲁伟等[23]测多肽的方法,并作一定修改:取2.0 mL酶解液,加入2.0 mL 10%(W/V)三氯乙酸(TCA)水溶液,震荡混合,静置10 min后,在离心力为2 862×g下离心15 min,取1 mL上清液,加入4 mL双缩脲试剂,充分摇匀后,在室温下静置 30 min,以5%TCA溶液作空白,于540 nm下测其吸光度,根据上述标准曲线计算多肽质量。

式中:m1为上清液中多肽质量/g;m为样品中总蛋白质量/g。
1.5 试验设计
碱性蛋白酶是当前酶解小麦面筋蛋白制备多肽效果较好的一种蛋白酶,在各类研究中应用较多,结合资料文献[24],本试验设计中固定酶解温度为其最适温度50℃,以DH和多肽得率为指标,通过单因素试验和正交试验,研究酶解时间、SDS添加量、底物浓度、酶浓度、pH对小麦面筋蛋白酶解的影响,确定酶解小麦面筋蛋白制备多肽的最佳工艺条件。其中,在酶解pH=10的条件下,L9(34)正交试验的因素及水平设计见表1。

表1 正交试验因素水平表
1.6 数据处理
每个试验重复3次,结果采用平均值±标准差的形式表示,试验数据采用Excel 2003和正交设计助手V3.1软件进行处理。
2 结果与分析
2.1 小麦面筋蛋白酶解单因素试验
2.1.1 酶解时间对酶解效果的影响
SDS添加量4 mg/mL,底物浓度10 g/100 mL,酶浓度7 mg/mL,pH 9,50℃恒温酶解,时间分别为1、2、3、4、5、6 h,酶解时间对水解度和多肽得率的影响如图1。
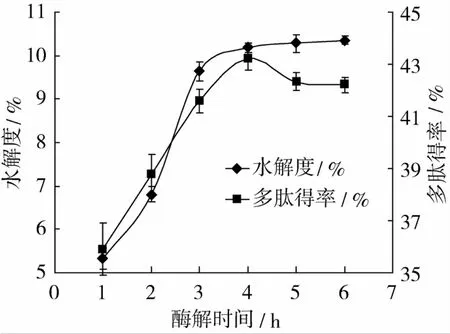
图1 酶解时间对水解度和多肽得率的影响
由图1可知,在一定时间内,随着时间的延长,小麦面筋蛋白逐渐地被水解,DH和多肽得率都显著增加(P<0.01),水解4 h时,DH和多肽得率均达到最大值,水解时间超过4 h时,DH几乎不增加,多肽得率稍有下降,原因可能是4 h以前,碱性蛋白酶把小麦面筋蛋白大分子水解成小分子的肽段,DH和多肽得率都增加,水解时间大于4 h时,分子质量较小的肽段被进一步水解成氨基酸,使多肽的检测结果偏低,因此,酶解时间为4 h比较合适。
2.1.2 SDS添加量对酶解效果的影响
底物浓度 10 g/100 mL,酶浓度 7 mg/mL,pH 9,50℃恒温酶解4 h,研究SDS不同添加量对酶解效果的影响,结果如图2。
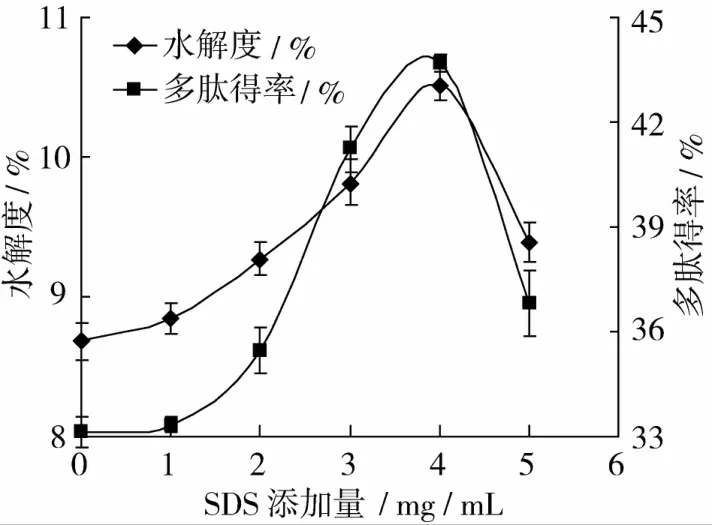
图2 SDS添加量对水解度和多肽得率的影响
SDS添加量不同时,DH和多肽得率大小不同。SDS添加量较低时,DH和多肽得率增幅不大,随着SDS浓度的增加,DH和多肽得率先增加后降低且趋势基本一致。当SDS添加量为4 mg/mL时,DH和多肽得率都达到最大值。这可能是因为,SDS是一种离子型乳化剂,主要通过离子键与高分子质量谷蛋白相互作用释放出更多的低分子质量谷蛋白,通过分子中疏水长链与蛋白质分子内部的非极性基团相互作用,使谷蛋白分子间作用力减弱,可溶性肽段增加[25]。它还能使分子内和分子间氢键断裂,这使得小麦面筋蛋白与碱性蛋白酶接触面积增大,因此,DH和多肽得率都增加。SDS添加量增大时,可能使小麦面筋蛋白分子构象发生进一步转变,不利于碱性蛋白酶定向靠近,DH和多肽得率下降,因此,SDS添加量为4 mg/mL。
2.1.3 底物浓度对酶解效果的影响
SDS添加量为4 mg/mL,酶浓度7 mg/mL,pH 9,50℃恒温酶解4 h,底物浓度对DH和多肽得率的影响如图3。

图3 底物浓度对水解度和多肽得率的影响
由图3知,其他条件不变时,随着底物浓度的增加,DH和多肽得率先增加后减小,变化显著(P<0.01),这是因为底物浓度较低时,酶相对充足,绝大部分蛋白质参与反应;随着底物浓度的增加,溶液中易于流动的水减少,阻碍了蛋白酶和底物在溶液中的扩散运动,根据酶促反应原理,高浓度的底物会对酶产生抑制作用,生成的多肽也可能会反馈抑制酶的水解反应[26]。在蛋白水解反应中,对同一种底物,酶活性也会发生不可逆抑制性[27],所以DH和多肽得率相对降低。因此底物浓度为10 g/100 mL较合适。
2.1.4 酶浓度对酶解效果的影响
SDS添加量4 mg/mL,底物浓度10 g/100 mL,酶浓度分别为 3、5、7、9、11、13 mg/mL时,50℃酶解4 h,结果如图4。
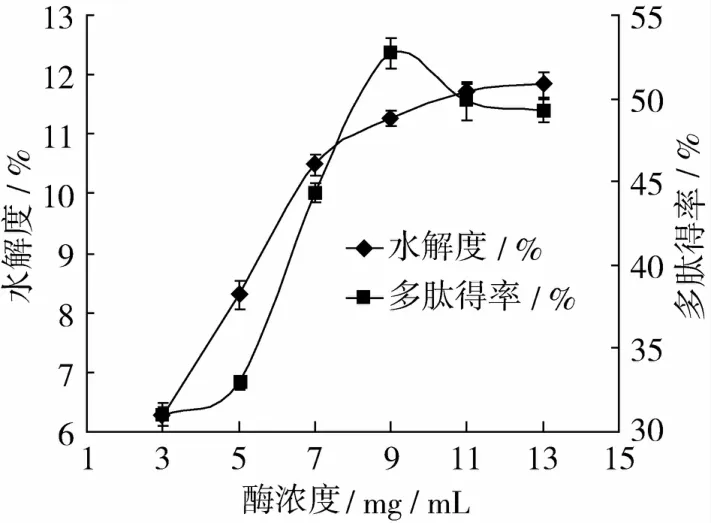
图4 酶浓度对水解度和多肽得率的影响
由图4可知,底物浓度一定时,随着酶浓度的增加,DH和多肽得率显著增加(P<0.01),且在9 mg/mL时多肽得率达到最大值;超过9 mg/mL时,DH增加缓慢,多肽得率反而下降。这是由于酶具有显著的对映性和区域选择性,在底物浓度远大于酶浓度时,随着酶量的增加,更多的小麦面筋蛋白被酶解,产生较多的肽段,DH和多肽得率显著增加;但在酶解过程中总会产生底物或产物抑制性,所以当酶量继续增加时,大量的小麦面筋蛋白分子被水解,产生较多相对分子质量小的多肽物质,抑制了酶解反应的进行[28-29],DH增加缓慢,而多肽进一步水解成氨基酸,多肽得率稍有下降,因此,选择酶浓度为 9 mg/mL。
2.1.5 pH值对酶解效果的影响
SDS添加量为4 mg/mL,底物浓度10 g/100 mL,酶浓度9 mg/mL,酶解时间 4 h,pH值分别是 8、9、10、11、12时,结果如图5。
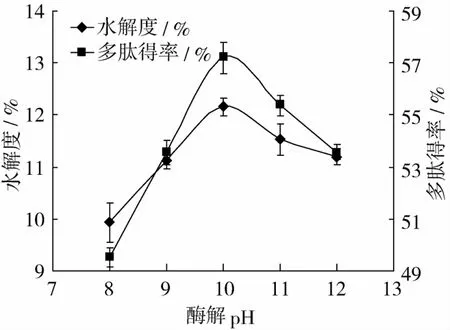
图5 酶解pH值对水解度和多肽得率的影响
由图5可知,pH值不同,DH和多肽得率显著不同(P<0.01)。pH值在8~12范围内,随着pH值的增加,DH和多肽得率先增加后减小,这是由于每一种酶都有一个最适pH,此时,酶活性最大,pH值过高或过低,都影响酶分子中弱酸碱基团的解离,酶活性中心与底物的契合,酶活性中心催化基团的催化效率[30],从而使酶解效率降低。由试验结果可知,碱性蛋白酶作用于小麦面筋蛋白的最适pH为10。
2.2 正交试验结果与分析
全面分析上述单因素试验结果,酶解时间、SDS添加量、底物浓度、酶浓度对DH和多肽得率的影响最为显著,在固定pH=10的条件下,根据正交试验设计原理,共进行9组试验,试验设计与结果见表2,方差分析见表3。
由表2可以看出,第8号试验组合条件A2B3C1D3的水解度和多肽得率最大,效果最好。由直观分析及方差分析可知,各因素对DH影响的主次顺序为BDAC,最佳组合条件是A3B3C1D3,SDS添加量和酶浓度对DH影响显著;对多肽得率影响的主次顺序为BADC,最佳组合条件是A2B3C1D3,酶解时间、SDS添加量对多肽得率影响高度显著,酶浓度影响显著,底物浓度对两指标均不显著。DH和多肽得率的最优组合稍有差别,但酶解时间对DH不显著,对多肽得率显著,因此,酶解时间为2水平是最优的选择,则正交试验最优组合条件为A2B3C1D3,与8号试验一致,即:酶解时间4 h,SDS添加量4 mg/mL,底物浓度8 g/100 mL,酶浓度 9 mg/mL,此时,DH为 12.36%,多肽得率为57.24%。
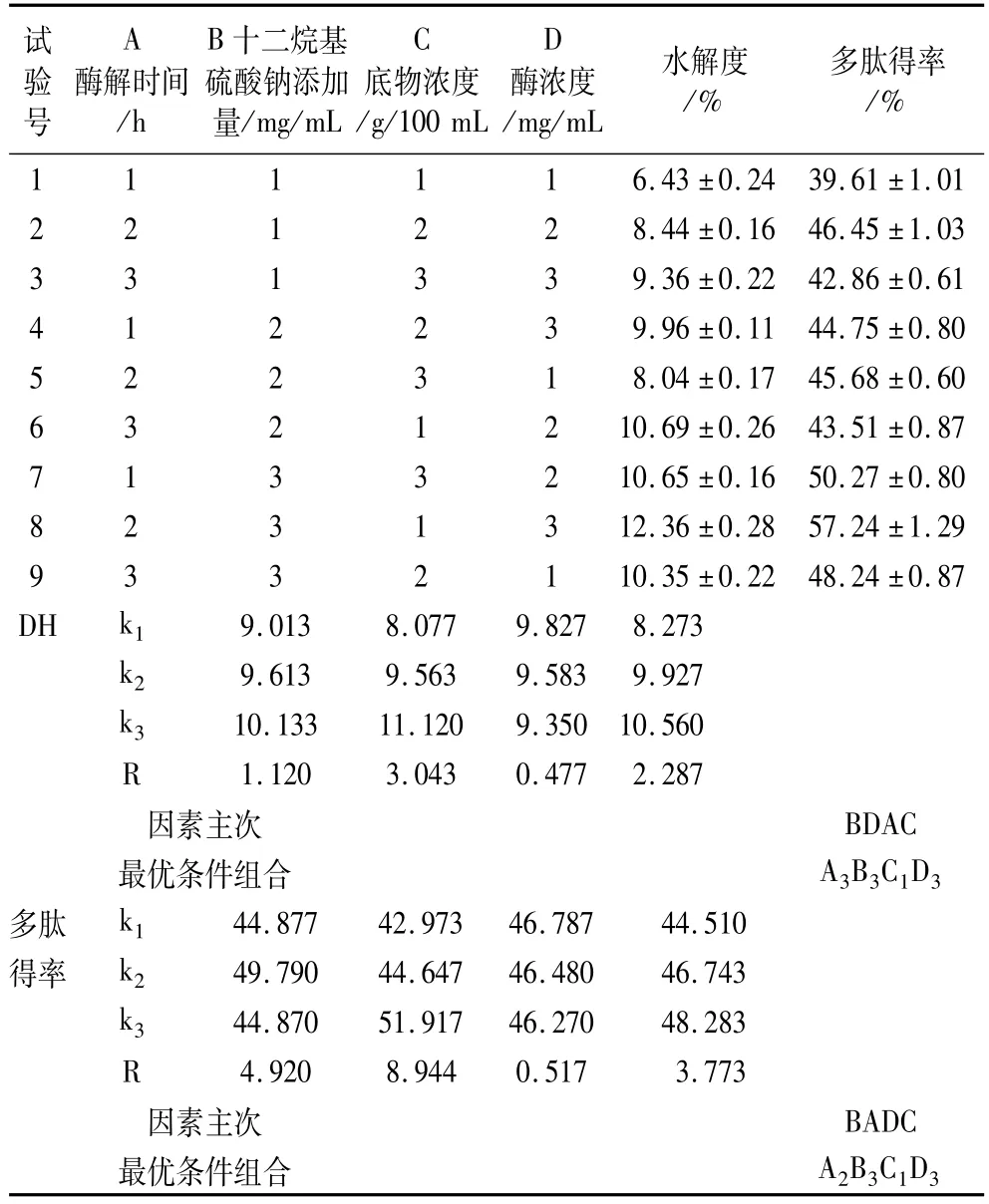
表2 正交试验结果及直观分析
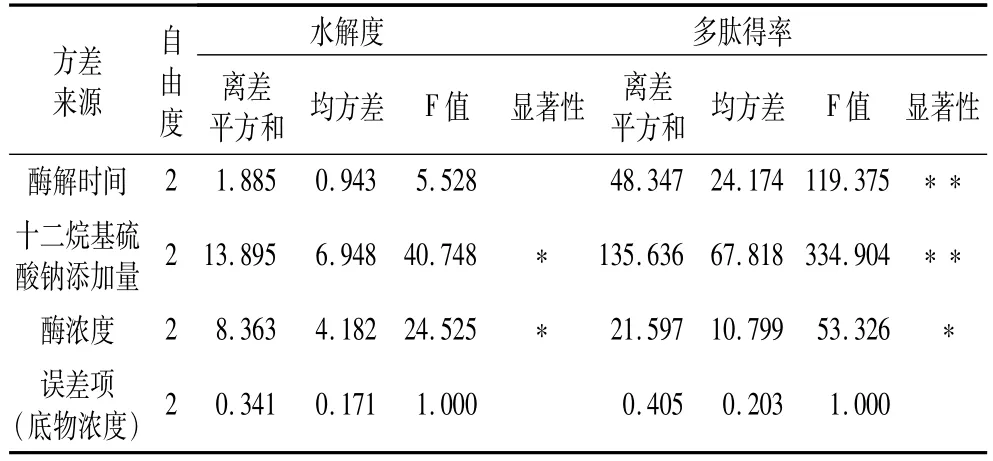
表3 正交试验方差分析
3 结论
论文通过对单因素试验进行全面分析,酶解时间、SDS添加量、底物浓度、酶浓度4个因素对DH和多肽得率最显著,在固定pH 10的条件下,对酶解时间、SDS添加量、底物浓度、酶浓度进行L9(34)正交试验,最终确定酶解小麦面筋蛋白的最佳工艺条件为:酶解时间 4 h,SDS添加量 4 mg/mL,底物浓度8 g/100 mL,酶浓度 9 mg/mL,此时,DH为 12.36%,多肽得率为57.24%。
本试验利用SDS预处理小麦面筋蛋白后再用碱性蛋白酶酶解处理,显著提高了小麦面筋蛋白的水解度和多肽得率,这为提高小麦面筋蛋白酶解效率提供了一个新方法。在后续研究中,将对酶解混合物进一步分离纯化制备不同分子质量区间段的多肽产品,并对其安全性、生物活性开展系统研究,以期实现酶解面筋蛋白多肽产品在食品、饲料、医药、化工等工业的实际应用。
参考文献
[1]Gauthier SF,Pouliot Y,Saint-Sauveur D.Immunomodulatory peptides obtained by the enzymatic hydrolysis of whey proteins[J].International Dairy Journal,2006,16(11):1315-1323
[2]Wang J S,Zhao M M,Zhao Q Z,et al.Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J].Food Chemistry,2007,101(4):1658-1663
[3]Thewissen B G,Pauly A,Celus I,et al.Inhibition of angiotensin I-converting enzyme by wheat gliadin hydrolysates[J].Food Chemistry,2011,127(4):1653-1658
[4]Del Castillo M D,Ferrigno A,Acampa I,et al.In vitro release of angiotensin-converting enzyme inhibitors,peroxyl-radical scavengers and antibacterial compounds by enzymatic hydrolysis of glycated gluten[J].Journal of Cereal Science,2007,45(3):327-334
[5]马涛,刘德明.酶法制备花生多肽工艺条件优化的研究[J].中国粮油学报,2011,26(7):89-94
[6]吴非,于胜男,葛锡娟,等.木瓜蛋白酶制备大豆抗癌活性肽的研究[J].中国粮油学报,2011,26(11):94-97
[7]Agyare K K,Xiong Y L,Addo K.Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J].Food Chemistry,2008,107(3):1131-1137
[8]王文俊,包海蓉,许慧.超声波处理提高谷朊粉溶解度的工艺条件[J].食品科学,2009,30(20):72-75
[9]刘菲琳,安志丛,朱科学,等.增溶预处理对面筋蛋白功能性质的酶解效率的影响[J].中国粮油学报,2010,25(4):1-8
[10]赵海峰,柴华,赵谋明,等.挤压预处理后小麦面筋蛋白酶解特性的变化[J].食品工业科技,2010,31(2):93-97
[11]Liao L,Qiu C Y,Liu T X,et al.Susceptibility of wheat gluten to enzymatic hydrolysis following deamidation with acetic acid and sensory characteristics of the resultant hydrolysates[J].Journal of Cereal Science,2010,52(3):395-403
[12]Kanerva P,Brinck O,Sontag-Strohm T,et al.Deamidation of gluten proteins and peptides decreases the antibody affinity in gluten analysis assays[J].Journal of Cereal Science,2011,53(3):335-339
[13]Drago SR,González R J.Foaming properties of enzymatically hydrolysed wheat gluten[J].Innovative Food Science and Emerging Technologies,2001,1(4):269-273
[14]Popineau Y,Huchet B,LarréC,et al.Foaming and emulsifying properties of fractions of gluten peptides obtained by limited enzymatic hydrolysis and ultrafiltration[J].Journal of Cereal Science,2002,35(3):327-335
[15]Berot S,Popineau Y,Compoint J P,et al.Ultrafiltration to fractionate wheat polypeptides[J].Journal of Chromatography B:Biomedical Sciences and Applications,2001,753(1):29-35
[16]朱庆英,裘爱泳.油脂中阴离子表面活性剂残余含量的测定[J].无锡轻工大学学报,2002,21(3):310-311
[17]金华丽,何健,张龙.面筋蛋白増溶作用研究进展[J].郑州工程学院学报,2002,23(2):95-99
[18]牟春娅,朱伟,汪学荣.可食性海藻酸钠膜的制备工艺条件[J].食品与发酵工业,2009,35(1):106-110.
[19]李祥,兀浩,文星,等.表面活性剂及其复配体系对盾叶薯蓣皂苷提取率影响的研究[J].中成药,2013,35(2):407-411
[20]韩刚,万红,李秋影,等.十二烷基硫酸钠提取姜黄素的工艺优化[J].时珍国医国药,2007,18(2):450-451
[21]杨欢,闫志农,卢晓黎.表面活性剂协同超声提取花生壳中黄酮的工艺研究[J].中国油脂,2012,37(12):57-60
[22]王岁楼,祝红蕾,张栋.小麦蛋白酶解制备活性多肽的研究[J].食品科学,2008,29(9):388-392
[23]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171
[24]Nordqvist P,Lawther M,Malmström E,et al.Adhesive properties of wheat gluten after enzymatic hyrolysis or heat treatment-A comparative study[J].Industrial Crops and Products,2012,38:139-145
[25]Gómez A V,Ferrer E,Añón M C,et al.Analysis of soluble proteins/aggregates derived from gluten-emulsifiers systems[J].Food Research International,2012,46(1):62-68
[26]周世成,刘国琴,李琳,等.Protamex蛋白酶水解小麦面筋蛋白的工艺及产物抑菌作用的研究[J].河南工业大学学报:自然科学版,2010,31(5):13-17
[27]Kammoun R,Bejar S,Ellouz R.Protein size distribution and inhibitory effect of wheat hydrolysates on Neutrase[J].Bioresource Technology,2003,90(3):249-254
[28]王金水,赵谋明,杨晓泉.酶解产物对小麦面筋蛋白酶水解过程抑制作用的研究[J].河南工业大学学报:自然科学版,2005,26(4):5-9
[29]Staniszewski M.Theoretical analysis of inhibition effect on steady states of enzymatic membrane reactor with substrate and product retention for reaction producing weak acid[J].Desalination,2009,249(3):1190-1198
[30]曹健,师俊玲.食品酶学[M].郑州:郑州大学出版社,2011.
