不同反胶束体系后萃取花生蛋白质的比较
2013-03-19高艳秀陈复生杨颖莹李润洁
高艳秀 陈复生 郭 珍 杨颖莹 李润洁
(河南工业大学粮油食品学院,郑州 450001)
花生是世界上主要的优质食用植物油料品种之一,花生籽仁的主要成分是蛋白质、脂肪和碳水化合物,其含量分别为24%~36%、50%左右和10%~23%[1]。花生蛋白不仅所含氨基酸种类比较齐全,而且所含人体必须氨基酸的比例较高[1]。目前,国内外花生加工普遍基于油脂为中心,因此花生中蛋白的利用率较低。传统的碱溶酸沉法生产的花生蛋白纯度不高,且蛋白质萃取率较低[2]。Luisi等[3]首次提出用反胶束萃取蛋白质的概念;Leser[4]等利用AOT/异辛烷体系萃取分离大豆和向日葵中的油和蛋白质。在国内,孙秀平等[5]对 AOT、SDS、CTAB和TritonX-100 4种表面活性剂所形成的反胶束体系萃取花生蛋白进行了研究,结果表明:不同的表面活性剂,所形成的反胶束“水池”大小不同,蛋白质萃取率也不同,表面活剂性的浓度对蛋白萃取率有直接的影响。
本试验研究AOT、SDS、DTAC 3种反胶束体系萃取花生蛋白质的最佳后萃工艺条件,通过色差分析,从宏观上比较不同花生蛋白产品色泽的差异,进一步通过对比3种不同花生蛋白质的扫描电镜照片,分析其微观结构的差异,以期找到最适合萃取花生蛋白的反胶束体系,为工业化应用提供数据支撑。
1 材料与方法
1.1 材料与试剂
全脂花生粉(过60目筛):河南帝鑫食品有限公司,将花生仁经过短时翻炒去红衣(保证蛋白未变性的条件下),然后粉碎。
二—(2-乙基己基)琥珀酸酯磺酸酯(AOT):上海海曲化工厂;十二烷基硫酸钠(SDS)、磷酸氢二钠、磷酸二氢钾、氯化钾:天津市科密欧化学试剂有限公司;十二烷基三甲基氯化铵(DTAC):厦门市先端科技有限公司;卡尔费休液:天津市科密欧化学试剂开发中心;异辛烷、正辛醇、正庚烷、正己醇:天津市博迪化工有限公司。
1.2 仪器和设备
GL-20L高速冷冻离心机:上海安亭科学仪器有限公司;ZSD-2J自动水分滴定仪:上海安亭电子仪器厂;pH211酸度计:意大利HANNA;BS210S电子天平:Sartorius,German;THZ-82B气浴恒温振荡器:江苏省金坛市瑞华仪器厂;移液枪:Eppendof公司;UV-1901紫外分光光度计:北京普析通用仪器有限责任公司;KQ-250B超声波清洗器:昆山市超声仪器有限公司;90-2恒温磁力搅拌器:上海亚荣生化仪器厂;LGJ-18冷冻干燥机:北京四环科学仪器厂;CR-400色彩色差计:日本柯尼卡美能达;JSM-5610扫描电镜:日本电子株式会社。
1.3 试验方法
1.3.1 原料的主要成分分析
蛋白质含量测定,GB/T 5009.5—2003;油脂含量测定,GB/T 5009.6—2003;水分含量测定,GB/T 5009.3—2003。
1.3.2 蛋白质标准曲线的制作
以牛血清蛋白为标准,紫外分光光度计测定不同浓度标准蛋白液在280 nm处吸光值,以蛋白质浓度为横坐标,对应吸光值为纵坐标,绘制标准曲线。
1.3.3 反胶束溶液的配制
AOT反胶束体系的配制:称取一定量AOT,置于100 mL锥形瓶中,同时加入有机溶剂异辛烷,在磁力搅拌器上搅拌至AOT完全溶解,待溶液透明后,加入适量(0.02~0.20 mL/mL)含 0.2 mol/L KCl的KH2PO4-Na2HPO4缓冲溶液,摇床振荡,室温下静置12 h,若溶液透明则为反胶束体系(溶液底部有少量水不影响[6]);反之则不是,需要重复上述步骤重新配制,直至溶液透明[7]。
SDS反胶束体系的配制:称取一定量SDS,置于100 mL锥形瓶中,同时加入有机溶剂异辛烷/正辛醇(体积比4∶1)和适量(0.02~0.20 mL/mL)含 0.25 mol/L KCL的 KH2PO4-Na2HPO4缓冲溶液,超声波振荡至SDS完全溶解,溶液透明则为反胶束体系;反之则不是,需要重复上述步骤重新配制,直至溶液透明。
DTAC反胶束体系的配制:称取一定量DTAC,置于100 mL的锥形瓶中,同时加入有机溶剂正庚烷/正己醇(体积比4∶1)和适量(0.02~0.20 mL/mL)含0.05 mol/L KC1的 KH2PO4-Na2HPO4缓冲溶液,超声波振荡至DTAC完全溶解,溶液透明则为反胶束体系;反之则不是,需要重复上述步骤重新配制,直至溶液透明。
1.3.4 Karl-fischer法测定反胶束体系的W0值
利用自动水分滴定仪,在滴定瓶中加入适量的无水甲醇(甲醇液面要超过电极的铂片,约20~30 mL),用卡尔费休氏溶液将甲醇中的水分滴去,然后再用微量进样器准确向甲醇溶液中加入10μL蒸馏水,再用卡尔费休氏溶液滴至终点,以标定卡尔费休氏溶液的滴定度,重复标定3次以上。用微量注射器吸取待测反胶束溶液50μL,迅速加入到滴定瓶中,用卡尔费休氏溶液滴定至终点,读取反胶束溶液中所含水分的体积[8]。W0值为反胶束中的水分含量的摩尔数与表面活性剂的摩尔数之比。

式中:W0为反胶束溶液中增溶水和表面活性剂的摩尔比率。
1.3.5 前萃试验
取按1.3.3节配制好的反胶束溶液置于锥型瓶中,按照表1中的前萃条件,加入一定量花生粉(精确到0.000 1 g),在一定的超声温度、超声功率条件下,超声一定时间,然后以约3 000 r/min的转速离心分离10 min。萃取体系分为2层,上层为萃入蛋白质的反胶束层,下层为残渣,除去残渣,所得上清液用UV-1901紫外分光光度计在280 nm波长下测定吸光度(以萃取前的反胶束溶液作为空白样),然后与蛋白质标准曲线比对,得出蛋白质的浓度,计算出不同条件下的蛋白前萃率[8],蛋白前萃率按式(2)计算。

3种反胶束体系的前萃最优工艺条件见表1。
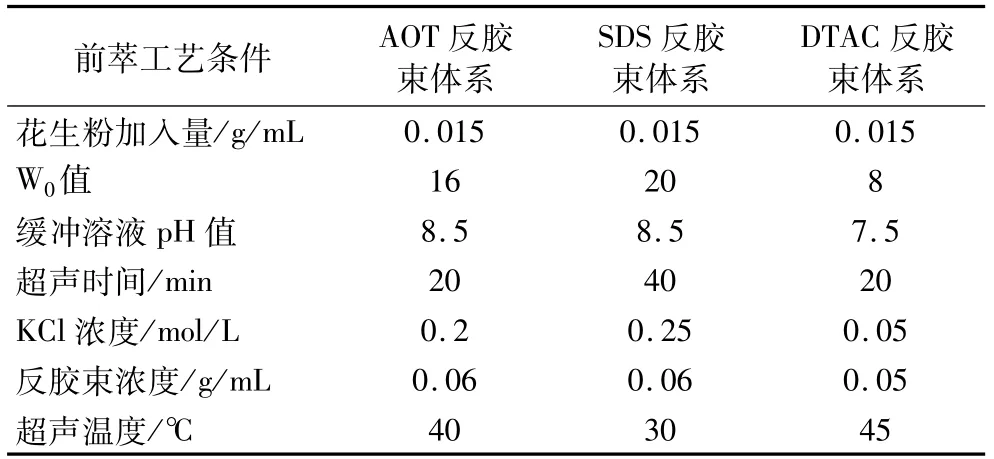
表1 3种反胶束体系的最优前萃工艺条件
1.3.6 后萃试验
取一定体积前萃试验制备的前萃液,加入等体积、一定KCl浓度、pH值的 KH2PO4-Na2HPO4缓冲溶液。在一定的温度、功率条件下,超声一定时间,然后在5 000 r/min条件下离心10 min,用梨形分液漏斗分液,下层水相即为后萃液。用UV-1901紫外分光光度计在280 nm波长下测定吸光度(以缓冲溶液作为空白样)。然后与蛋白质标准曲线比对,得出蛋白质的浓度。从而可计算出蛋白后萃率[8]。蛋白后萃率按式(3)计算。

1.3.7 花生蛋白样品的制备
AOT反胶束体系制备花生蛋白:按照1.3.5和1.3.6的方法计算不同反胶束体系萃取花生蛋白的前萃率和后萃率,然后用1.3.6制得的后萃液,用透析袋在4℃的条件下,透析48 h以上,其间换水6~8次,然后将透析好的蛋白质水溶液在冷冻干燥机上面冷冻干燥得到花生蛋白的产品。
SDS反胶束体系制备花生蛋白的步骤同AOT反胶束体系制备花生蛋白。
DTAC反胶束体系制备花生蛋白的步骤同AOT反胶束体系制备花生蛋白。
1.3.8 不同花生蛋白的色差分析
使用美能达色彩色差计CR-400测定蛋白样品的色泽,以L*a*b*法表示蛋白的色泽。L*范围为0~100(从黑到白,表示明度),a*(从绿到红,-a~+a),b* (从蓝到黄,-b~+b)。3个方向三维立体分别评价。每个样品测定3次,测定L、a、b值,3次结果取平均值,并用SAS软件进行显著性分析。
1.3.9 不同花生蛋白的扫描电镜显微结构研究
采用扫描电子显微镜(SEM)方法观察花生分离蛋白的微观结构,并对不同方法制备的花生分离蛋白进行比较。直接取适量样品,用双面胶固定在载玻片上,在150Ao下喷金,通过JSM-5610扫描电镜在20 KV观察、照相。
2 结果与讨论
2.1 原料主要成分测定结果
原料中主要成分及其含量见表2。
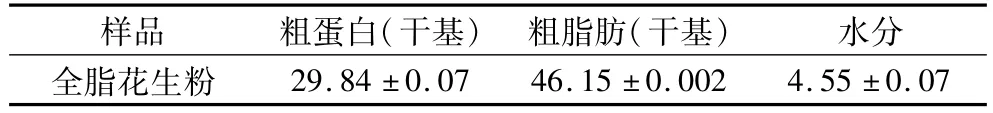
表2 原料主要成分及质量分数(%)
2.2 蛋白质定量分析标准曲线
绘制蛋白质标准曲线是为了得出蛋白质的浓度,从而可计算出不同条件下的蛋白前萃率。蛋白质定量分析标准曲线如图1所示。
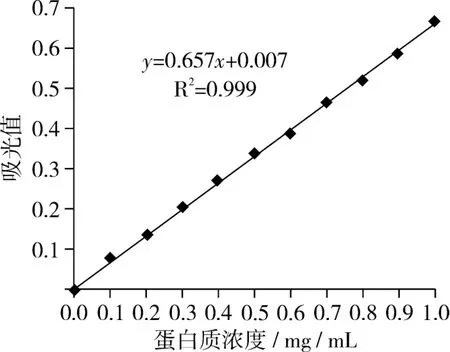
图1 蛋白质定量分析标准曲线
2.3 缓冲溶液pH值对花生蛋白后萃率的影响规律研究
分别配制 pH为7、7.5、8、8.5、9、9.5的KH2PO4-Na2HPO4缓冲溶液,按照1.3.6进行操作。其中,AOT反胶束体系的后萃工艺条件设定为:超声时间为40 min、超声温度40℃、超声功率240 W、KCl浓度1.5 mol/L;SDS反胶束体系的后萃工艺条件设定为:超声时间40 min、超声温度45℃、超声功率270 W、KCl浓度1.5 mol/L;DTAC反胶束体系的后萃工艺条件设定为:超声时间20 min、超声温度30℃、超声功率270 W、KCl浓度1.5 mol/L。试验结果如图2所示。
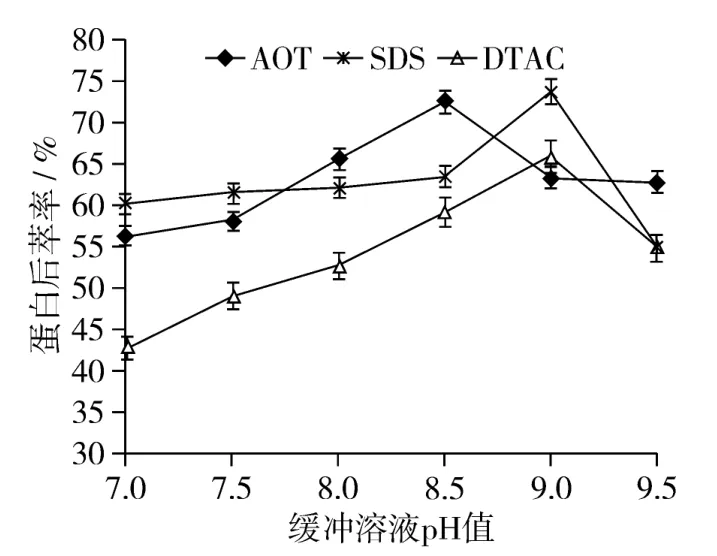
图2 缓冲溶液pH值对花生蛋白后萃率的影响
由图2可以看出,随着缓冲溶液pH值的增大,花生蛋白后萃率先逐渐增大,然后减小。AOT反胶束体系的最佳pH值为8.5,SDS和DTAC反胶束体系的最佳pH值都为9,此时蛋白后萃率达到最大。后萃取过程中,水相的pH值高于蛋白质的等电点(pI),蛋白质所带的电荷与反胶束内壁所带的电荷性质相同,由于静电斥力,使溶入反胶束的蛋白质反向萃取出来。且pH值越高蛋白质分子表面所带电荷的密度越大,斥力越强,蛋白质从反胶束内释放的速率越快,因此后萃率就越高。但是当pH值过高时,蛋白质易变性,会使蛋白质的萃取率降低。
2.4 超声时间对花生蛋白后萃率的影响规律研究
将超声时间分别设定为 10、20、30、40、50、60 min,按照1.3.6进行操作。其中,AOT反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为8.5、超声温度40℃、超声功率240 W、KCl浓度1.5 mol/L;SDS反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声温度45℃、超声功率270 W、KCl浓度1.5 mol/L;DTAC反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声温度30℃、超声功率270 W、KCl浓度1.5 mol/L。试验结果如图3所示。
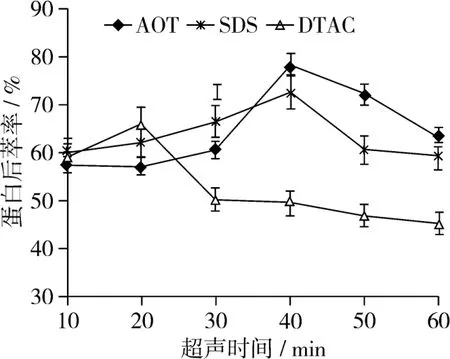
图3 超声时间对花生蛋白后萃率的影响
由图3可以看出,随着超声时间的延长,蛋白后萃率先逐渐增大,再迅速减小。两种阴离子表面活性剂AOT和SDS形成的反胶束体系,最佳萃取时间为40 min,而阳离子表面活性剂DTAC形成的反胶束体系,最佳萃取时间为20 min,此时,蛋白后萃率达到最大值。很明显,阳离子表面活性剂形成的反胶束最佳萃取时间低于阴离子的。这可能与表面活性剂本身的结构差异有关。
2.5 超声温度对花生蛋白后萃率的影响规律研究
将超声温度分别设定为25、30、35、40、45、50℃,按照1.3.6进行操作。其中,AOT反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为8.5、超声时间40 min、超声功率240 W、KCl浓度1.5 mol/L;SDS反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声时间40 min、超声功率270 W、KCl浓度1.5 mol/L;DTAC反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声时间20 min、超声功率270 W、KCl浓度1.5 mol/L。试验结果如图4所示。

图4 超声温度对花生蛋白后萃率的影响
由图4可以看出,随着萃取温度的升高,蛋白后萃率先逐渐增大,达到某个特定温度后,蛋白后萃率达到最大值,再继续升高温度,后萃率有所减小。其原因是温度升高时,分子运动速率加快,反胶束与水相之间的分子运动也加快,传质推动力增大,加快了蛋白质的萃取,因此萃取率升高。当温度继续升高,萃取率变化不大,此时萃取已经达到平衡,另外,温度过高会导致蛋白变性。
2.6 超声功率对花生蛋白后萃率的影响
将超声功率分别设定为 150、180、210、240、270、300 W,按照1.3.6进行操作。其中,AOT反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为8.5、超声时间40 min、超声温度40℃、KCl浓度1.5 mol/L;SDS反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声时间40 min、超声温度45℃、KCl浓度1.5 mol/L;DTAC反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声时间20 min、超声温度30℃、KCl浓度1.5 mol/L。试验结果如图5所示。

图5 超声功率对花生蛋白后萃率的影响
由图5可以看出,随着超声功率的增大,蛋白后萃率先逐渐增大然后减小。原因是在后萃过程中存在较大的界面阻力,使用超声波可以起到强化作用,超声波功率越大,空化作用和机械作用越强烈,分子扩散速度也就越大[9],同时空化所产生的微射流会促进蛋白质向反胶束的表面扩散,降低了蛋白从反胶束中向水相中扩散的阻力,因此可以促进蛋白质的浸出和传质,提高蛋白质的萃取率。但是,当超声功率足够大时,增加了全脂花生粉中油脂的运动,从而阻碍了蛋白质的渗出。
2.7 KCl浓度对花生蛋白后萃率的影响
分别配制 KCl浓度为 0.5、1.0、1.5、2.0、2.5、3.0 mol/L的 KH2PO4-Na2HPO4缓冲溶液,按照1.3.6进行操作。其中,AOT反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为8.5、超声时间40 min、超声温度40℃、超声功率240 W;SDS反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声时间40 min、超声温度45℃、超声功率270 W;DTAC反胶束体系的后萃工艺条件设定为:缓冲溶液pH值为9、超声时间20 min、超声温度30℃、超声功率270 W。试验结果如图6所示。

图6 KCl浓度对花生蛋白后萃率的影响
由图6可以看出,当KCl浓度逐渐增大的过程中,蛋白后萃率迅速增大,随着KCl浓度继续增大,蛋白后萃率逐渐减小,并趋于平稳。3种体系的最佳离子浓度均为1.5mol/L。这是由于随着离子浓度的增大,反胶束内表面的双电层变薄,静电引力也就减弱;另一方面,减小了表面活性剂极性头之间的排斥作用,导致反胶束变小[9]。这两方面的效应都会使蛋白质在反胶束中的溶解性下降,更容易从反胶束中反萃出来,从而后萃率得到提高。但是KCl离子浓度越大,反胶束的W0值则会越小,使得反胶束极性核所包含的蛋白质随着减少的水分而被带出,故后萃率开始减小;另外,盐浓度过高时,对蛋白质会产生盐析作用,也会导致蛋白质后萃率降低[10]。
2.8 验证试验
根据以上的研究可得到3种不同反胶束体系的后萃工艺条件,根据单因素试验研究,并根据实际情况做适当调整,做重复验证试验。得到了3种反胶束体系萃取花生蛋白的最佳后萃工艺条件及后萃率,如表3所示。

表3 3种反胶束体系萃取花生蛋白的最佳后萃工艺条件
2.9 不同反胶束体系制备的花生蛋白样品色差分析结果
如表4所示,不同花生蛋白的色差分析中,AOT反胶束体系制备的花生蛋白L值最大,a值最小,可见PPI2的色泽是最好的。不同反胶束体系制备的花生蛋白与碱溶酸沉法制备的相比,其L、a、b值都存在显著性差异。通过表4中的数据可以看出,AOT反胶束制备的花生蛋白的色泽最好,而碱溶酸沉法制备的花生蛋白的色泽最差。

表4 不同花生蛋白的色差分析结果
2.10 不同反胶束体系制备的花生蛋白的扫描电镜照片(SEM)结果
不同反胶束体系制备的花生蛋白样品的扫描电境照片如图7所示。通过扫描电镜照片可以看出,4种花生蛋白从微观结构上有些差异。碱溶酸沉法提取的花生蛋白主要呈片状,也有球状结构,而不同反胶束体系、不同萃取工艺所制备的花生蛋白结构均不相同,这可能与反胶束溶液的pH值,W0,离子强度以及表面活性剂所带的电荷种类有关。如在反胶束溶液的pH值条件下,反胶束与蛋白质之间产生亲水、疏水作用,而使部分蛋白结构发生变化,导致蛋白质粒度减小;W0的大小也影响这反胶束萃取蛋白质分子质量的大小,蛋白质分子质量大,蛋白质的体积就大,在传递增溶过程中产生的障碍也越大,因此反胶束所萃取的蛋白质粒度也较小。总之,研究说明了反胶束特殊的微环境条件下,表面活性剂所带的电荷与蛋白质分子所带的电荷产生静电作用,蛋白质分子所带的电荷产生静电作用,离子强度与蛋白质之间产生静电作用,表面活性剂在有机相中所形成的反胶束数目及大小等都会使蛋白质结构发生改变,如有序结构α-螺旋,β-折叠及β-转角结构的减少,无序结构的增加,以及氨基酸的分解等变化,从而导致反胶束相制备的蛋白粒度较碱溶酸沉法制备的蛋白小,从而溶解度就较好。进一步说明了反胶束制备的花生蛋白较碱溶酸沉制备的好。

图7 不同PPI样品的扫描电镜显微照片
3 结论
3.1 在单因素试验的基础上进行了验证试验,得到了3种反胶束体系后萃花生蛋白的最佳工艺条件。AOT反胶束体系后萃取花生蛋白的最佳工艺条件为:缓冲溶液pH值8.5、萃取时间40 min、萃取温度40℃、超声功率240 W、KCl浓度1.5 mol/L,此时蛋白后萃率为83.17%;SDS反胶束体系后萃取花生蛋白的最佳工艺条件为:缓冲溶液pH值9、萃取时间40 min、萃取温度45℃、超声功率270 W、KCl浓度1.5 mol/L,此时蛋白后萃率为82.62%;DTAC反胶束体系后萃取花生蛋白的最佳工艺条件为:缓冲溶液pH值9、萃取时间20 min、萃取温度30℃、超声功率270 W、KCl浓度 1.5 mol/L,此时蛋白后萃率为73.18%。结果表明,AOT反胶束体系后萃取花生蛋白的萃取率最大。
3.2 通过对不同反胶束体系制备的花生蛋白的色差进行分析,并与碱溶酸沉法制备的花生蛋白相比较,发现不同花生蛋白样品的L、a、b值都存在显著性差异。得出AOT反胶束体系制备的花生蛋白色泽是最好的,而碱溶酸沉法制备的花生蛋白的色泽较差。
3.3 扫描电镜照片的结果显示,碱溶酸沉法制备的花生蛋白的微观结构主要呈片状,部分呈球状,而反胶束体系制备的花生蛋白,粒度都明显减小。
3.4 最适合萃取花生蛋白的反胶束体系是AOT反胶束体系。
参考文献
[1]周瑞宝主编.花生加工技术[M].北京:化学工业出版社,2003
[2]王章存,康艳玲.花生蛋白研究进展[J].粮食与油脂,2007(7):12-13
[3]Luisi P L,Henninger F,Joppich M,et al.Micelle solubilization of proteins in aprotic solvents and their spectroscopic characterization[J].Biochemical and Biophysical Research Communications,1977,74(1):384
[4]Leser M E,Kristina.R,Luide.P.The use of reverse micelles for the simultaneous extraction of oil and protein from vegetable meal[J].Biotechnolgy Bioengineering,1989,34(11)
[5]孙秀平,陈军,陈锋亮,等.不同反胶束体系对萃取花生蛋白的影响[J].食品科技,2012,37(1):164-168
[6]高亚辉.反胶束后萃大豆蛋白动力学及其体系性能研究[D].河南工业大学,2007:2-3
[7]赵俊廷.利用反胶束溶液同时萃取油料中油和蛋白的研究[D].无锡:无锡轻工大学,2000
[8]黄伟坤.食品检验与分析[M].北京:轻工业出版社,1989
[9]杨青珍,王锋,李康.超声波辅助提取榛子油的工艺条件优化[J].中国粮油学报,2011,26(8):58-61
[10]程小丽,陈复生,李里特,等.超声波技术在AOT反胶束萃取中的应用研究[J].食品科技,2009,34(10):95-98
[11]赵晓燕,陈复生,薛文通.不同反胶束体系提取大豆蛋白质的研究[J].食品科学,2007,28(4):109-122.
