围封与放牧对土壤微生物和酶活性的影响
2013-03-14牛得草江世高张宝林曹格图
牛得草,江世高,秦 燕,2,张宝林,曹格图,傅 华
(1.草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020;2.齐齐哈尔大学,黑龙江 齐齐哈尔 161006; 3.内蒙古阿拉善盟草原总站,内蒙古 巴彦浩特 750306)
土壤作为生态系统的重要组分,其质量的好坏对构建稳定的生态系统具有举足轻重的作用。长期以来,土壤有机质含量的高低被作为表征土壤质量的综合指标而广泛应用[1],然而,有机质的变化比较缓慢,难以及时反映土壤遭受干扰时的各种变化,且一旦土壤有机碳发生衰减,草地的退化程度就已经比较严重[2]。通常,有机物进入土壤后在微生物酶的作用下发生氧化反应,被彻底分解为小分子物质和矿质元素,完成整个矿化过程。土壤酶类作为有机质分解过程的生物催化剂[3],对外界环境因素引起的变化较为敏感,能够在短期内发生变化,可以作为衡量生态系统土壤质量变化的预警和敏感指标[4-6]。土壤中酶活性的降低,可能是由土壤微生物数量的降低,导致分泌的酶的绝对量减少引起;也可能是微生物分泌的酶绝对量没变,但其活性基团的构象发生明显变化,最终导致测定的单位土壤的酶活性降低引起的;还可能是由以上两方面的原因共同作用引起。另外,土壤微生物量本身也是土壤有机质的活性部分[7],在土壤质量的演变过程中,具有相对较高的转化能力[8],是土壤有效养分的贮存库[9]。因此,研究不同干扰下土壤酶活性和土壤微生物量的特征,明确两者之间的关系,对于及时判断土壤质量状况,揭示土壤酶活性的变化机理,保证生态系统结构的稳定及其功能的正常发挥具有重要意义[8,10-11]。
草地是我国分布面积最广的陆地生态系统[12]。到目前为止,相比于森林和农田生态系统,国内关于草地微生物生态学方面的研究起步较晚,报道较少[13-14],对干旱荒漠区土壤酶活性和土壤微生物量的研究尤其少[15-16]。阿拉善高原地处我国西北内陆干旱区,其面积占我国国土总面积的3%。该区主要景观有沙漠、戈壁和草地等类型,著名的巴丹吉林沙漠、腾格里沙漠以及乌兰布和沙漠就位于阿拉善高原境内[17]。微温干旱温带半荒漠类草地是阿拉善高原重要的植被类型之一。作为草原向荒漠的过渡带,该类型草地是阻止沙漠扩张的天然屏障,同时也是防止草地沙漠化的重要缓冲区域[18]。该区自然环境差、气候干旱且土壤瘠薄,生态环境极其脆弱。在自然和人为干扰下,其生态系统的结构与功能波动剧烈,甚至发生严重草地退化及沙化现象,使其成为受损生态系统,进而引起“生态报复”,直接威胁着草地畜牧业的健康发展和人类的生存[19]。以往人们对该区微温干旱温带半荒漠类草地生态系统的退化和恢复过程的研究主要集中于地上植物群落和土壤理化性质方面[20-22],而对于其地下微生物生态学的研究还较少。因此,本研究选择阿拉善高原微温干旱温带半荒漠类草地为对象,在比较放牧和围封5年草地土壤酶活性与土壤微生物量的基础上,探讨各处理下土壤酶活性和微生物量碳氮的关系,旨在为阿拉善高原草地的合理利用以及退化草地的恢复治理提供理论参考。
1 材料与方法
1.1研究区概况 试验区位于内蒙古阿拉善左旗巴彦浩特西南约30 km (105°36′25″ E,39°08′32″ N)处,海拔 1 370 m,年平均温度8 ℃左右,≥10 ℃积温为3 000~3 400 ℃·d。年平均降水量80~150 mm,主要集中在7-9月,占全年降水量的59%~75%。年均蒸发量3 000~4 000 mm,年均风速3.1 m·s-1。土壤为淡棕钙土,优势植物为红砂(Reaumuriasoongorica)和无芒隐子草(Cleistogenessquarosa),并以此形成草原化荒漠植被特征[21]。
1.2研究方法
1.2.1样地设置及样品采集 于2001年5月,在研究区内选择地势平坦开阔,植被均匀的地段,设置4条10 m×50 m的封育样带,同时,在围栏外自由放牧样地设置4条10 m×50 m的对照样带,围栏封育时草地因过度放牧,严重退化。于2005年(封育5年)7月,在每个围栏和放牧样带内,布置1条50 m长的样线,每条样线,每隔5 m,用土钻(6 cm直径)分别采集0~10和10~20 cm 土样,按样线将同一土层的样品混合为1个样本,每处理4个重复。新鲜土样用生物冰袋冷藏,带回室内去掉植物残体,充分混合后,用四分法,将每份土样分成两部分。一部分放入4 ℃冰箱保存,用于土壤微生物量的测定,另一部分在室内风干,然后过2 mm筛,用于土壤酶活性的测定。
1.2.2土壤样品分析 用氯仿熏蒸浸提法[23]测定土壤微生物生物量碳、氮(MBC、MBN);土壤脲酶活性用靛酚蓝比色法测定,其活性用3 h后1 g土壤中NH3-N的mg数表示;蔗糖酶活性用3,5-二硝基水杨酸比色法测定,其活性以24 h后1 g土壤中葡萄糖的 mg 数表示;碱性磷酸酶活性用磷酸苯二钠比色法测定,其活性用12 h后1 g土壤中酚的mg数表示[24]。
1.3数据分析 用Microsoft Excel作图,用SPSS v. 13.0 (Chicago,USA)软件进行数据统计分析。各指标围封与放牧处理间的比较及同一处理不同土层间的比较均采用独立样本t测验进行统计分析,相关性分析采用Pearson’s相关分析方法。
2 结果
2.1退化草地围封5年后的土壤微生物量碳氮特征 退化草地围封5年后,0~10和10~20 cm土层土壤微生物量碳含量与自由放牧地(对照)的同一土层土壤相比无显著差异(P>0.05)(图1a),但土壤微生物量氮含量,在0~10和10~20 cm土层分别较自由放牧地显著提高了30.50%和44.14%(P<0.05)(图1b),而0~10和10~20 cm土层土壤微生物量碳氮比(MBC/MBN)的结果则表现为自由放牧地显著高于围封5年后的草地(P<0.05)(图1c)。另外,围封与放牧处理下,不同土层间土壤微生物量碳、氮含量的比较显示,围封5年后的草地与自由放牧地0~10 cm土层土壤微生物量碳、氮含量均显著高于10~20 cm土层(P<0.05)(图1a,b),但退化草地围封5年后,其0~10和10~20 cm土层的土壤微生物量碳氮比无显著差异,而对于自由放牧地,10~20 cm土层的土壤微生物量碳、氮要显著高于0~10 cm土层(图1c)。
2.2退化草地围封5年后土壤酶活性特征 本研究中,3类土壤酶的活性对围封与放牧的响应不相一致(图2)。退化草地围封5年后的0~10 cm土层,土壤脲酶和碱性磷酸酶的活性较自由放牧地显著提高(P<0.05),分别提高了42.63%和21.62%,而围封样地与自由放牧地的土壤蔗糖酶活性无显著差异(P>0.05)。在10~20 cm土层,围封样地土壤脲酶的活性显著低于自由放牧地,而土壤蔗糖酶和碱性磷酸酶活性均显著高于自由放牧地(图2)。另外,不同土层土壤酶活性的比较显示(图2),退化草地围封5年后的0~10 cm土层土壤脲酶的活性显著高于10~20 cm土层土壤,而自由放牧地对应的两个土层间土壤脲酶活性无显著差异。与土壤脲酶的表现规律不同的是,土壤蔗糖酶和碱性磷酸酶活性在围封样地内两个土层间无显著差异,但自由放牧地则是0~10 cm土层显著高于10~20 cm土层。
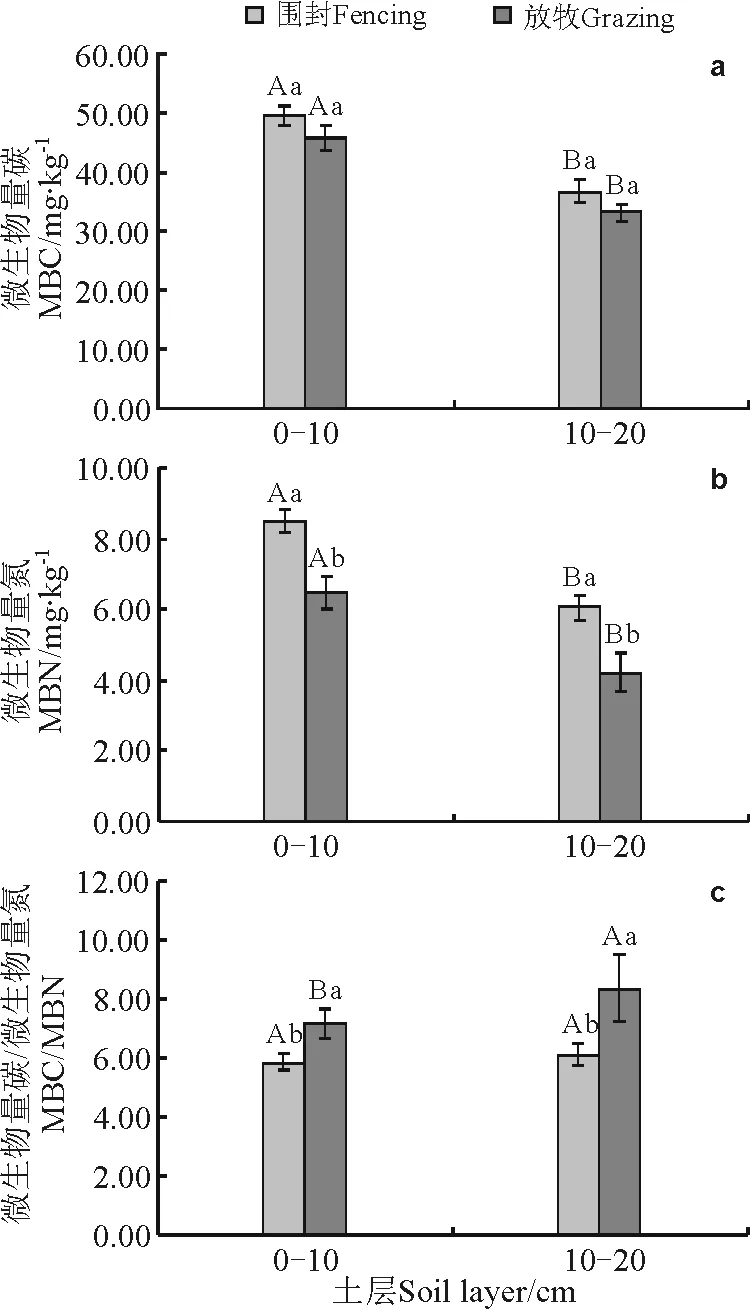
图1 退化草地围封5年后的土壤微生物量碳、氮特征Fig.1 Characteristics of soil microbial biomass C and N (MBC,MBN) in degraded grassland after 5 year’s restoration
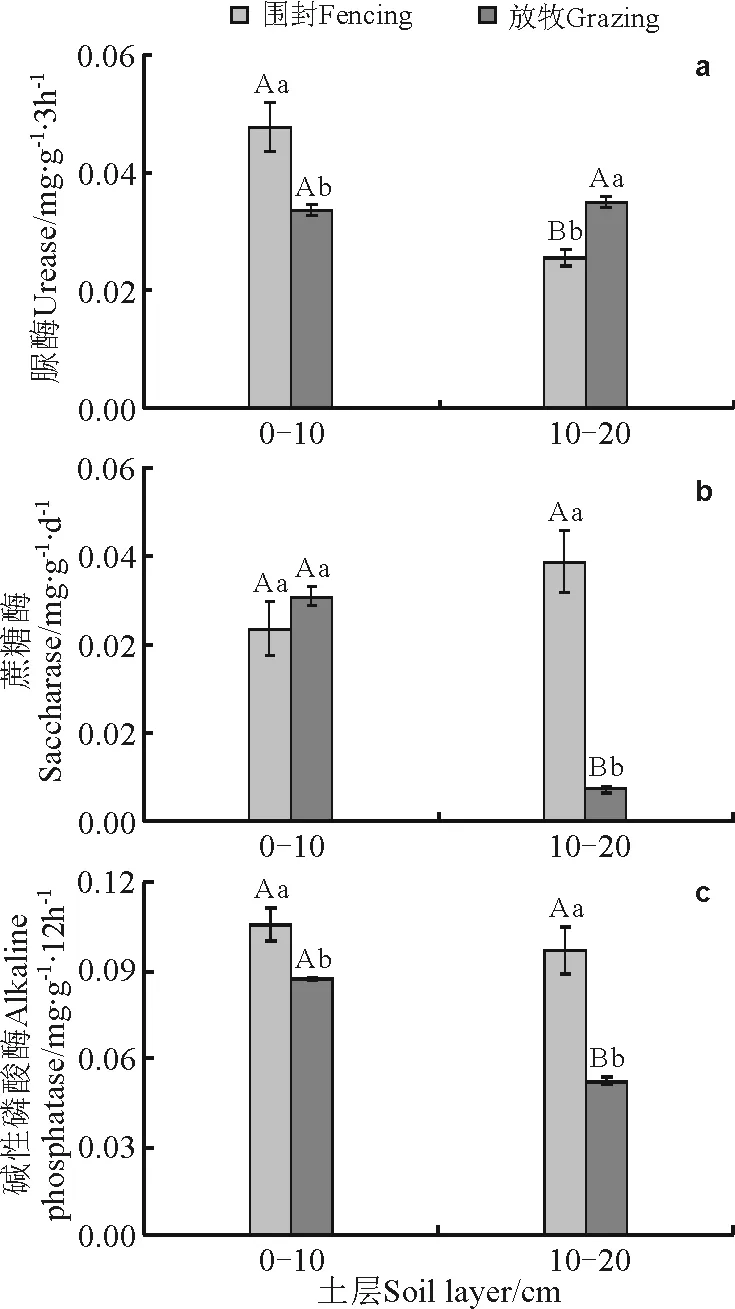
图2 退化草地围封5年后的土壤酶活性特征Fig.2 Characteristics of soil enzyme activities in degraded grassland after 5 year’s restoration
2.3土壤微生物生物量与土壤酶活性的关系 长期围封和自由放牧影响了土壤微生物生物量与土壤酶活性间的关系(表1)。退化草地围封5年后,其土壤微生物量碳与土壤脲酶活性呈显著正相关(P<0.05),与土壤蔗糖酶活性呈显著负相关(P<0.05);土壤微生物量氮与3种酶活性无显著相关性(P>0.05);微生物量碳/微生物量氮与不同酶活性之间也均无显著相关性。而对于长期自由放牧样地,其土壤微生物量碳、氮含量与土壤蔗糖酶活性和碱性磷酸酶活性均呈显著正相关(P<0.05),与土壤脲酶活性呈显著负相关(P<0.05),微生物量碳/微生物量氮除与土壤脲酶活性呈显著正相关外(P<0.05),与其他酶活性均无显著相关性。

表1 长期围封和放牧对土壤微生物量与土壤酶活性间相关性的影响Table 1 Correlation coefficients between soll microbial biomass and soil enzyme activities
3 讨论
3.1围封与放牧对土壤微生物生物量碳、氮的影响 微生物作为土壤有机质与土壤养分转化和循环的调节者以及系统中能量流动的推动者,是草地生态系统的重要组成部分,其活动能力的强弱受土壤状况、全球气候变化及放牧开垦等人类活动的影响[10,14,25-26]。土壤微生物量碳、氮能够表征土壤的生物状态、能量流动和养分循环的有效性,因此,这两个指标被作为土壤微生物研究的重要参数广泛应用[9-10,26-27]。以往的研究表明[14],放牧与围封对土壤微生物量的影响因研究区域、草地类型以及利用程度等的不同,结果也不尽一致,即放牧对草地土壤微生物量有促进、抑制和无影响3种结果都有报道。本研究中,放牧与围封对两个土层(0~10和10~20 cm)土壤微生物量碳无显著影响,可能是由于退化草地围封年限较短的缘故。不过,持续放牧使得其土壤微生物量氮含量较围封样地显著减小,其原因可能是持续放牧使得土壤系统全氮和速效氮的总量减少,从而对土壤微生物的氮素吸收与利用起到限制作用。Pei等[22]对霸王(Zygophyllumxanthoxylum)植物建群的草地土壤的研究发现,持续放牧可以导致土壤全氮和速效氮含量显著减少。该研究区的放牧方式为半舍饲放牧,晚上家畜被赶回牧户家过夜,所以,伴随家畜粪尿在圈舍内的积累,草地中的营养元素会被带出系统。另外,土壤系统的营养元素也会随畜产品的产出而被带出生态系统,最终,使得草地系统的养分总量越来越少。本研究中,土壤微生物量碳氮比表现为自由放牧地大于围封样地,主要是由围封样地的土壤微生物量氮含量显著高于自由放牧地引起的。此外,本研究还表明,对于退化微温干旱温带半荒漠类草地生态系统,其土壤微生物量氮含量受围封或放牧措施的影响要大于微生物量碳含量的变化,即土壤微生物量氮含量对围封或放牧的响应较土壤微生物量碳含量变化更加敏感。宋俊峰等[28]在研究不同放牧强度下草地土壤微生物量碳、氮的变化时也发现,随放牧强度的增加土壤微生物量氮含量的减少先于土壤微生物量碳。围封与放牧条件下,不同土层的土壤微生物量碳、氮含量变化规律均为表层土壤高于下层土壤,此结果与很多报道[29-32]一致,原因可能是土壤微生物多分布于表层,且表层土壤有机质丰富,通气状况良好,有利于微生物的生存与繁殖。
3.2围封与放牧对土壤酶活性的影响 土壤酶是土壤中生物活动的产物,主要来自于土壤微生物和植物根系[33],其活性强弱可表征土壤生化反应的强度。土壤酶直接控制着土壤营养元素的有效化过程,对维持土壤生态系统的稳定起着重要作用[32]。土壤脲酶直接参与土壤含氮有机化合物的转化,土壤碱性磷酸酶促进有机磷化合物的分解,两者的活性分别表征土壤的氮素和磷素供应状况,与土壤肥力有关[30,33-34]。本研究中,围封样地表层土壤脲酶和碱性磷酸酶的活性均高于放牧样地,其原因可能是草地围封后,表层枯落物增多,使土壤的肥力得到改善[32]。但下层土壤的脲酶活性则是围封样地显著低于放牧样地,其原因还不清楚,需要进一步的研究。土壤蔗糖酶催化蔗糖分解为果糖和葡萄糖的过程,其酶活性和土壤中有机质的积累和腐殖化程度有关[33-34]。本研究中,对于土壤蔗糖酶活性,仅下层土壤中围封样地显著高于放牧样地,表层土壤无差异,可能是由于草地围封年限较短,表层土壤有机质的积累较少,而下层土壤中植物根系大部分集中在这个层次,草地围封后此部分根系积累相对放牧地较多的缘故。围封和放牧条件下3种酶的活性在不同土层间表现不一,围封条件下土壤脲酶活性在土壤表层显著高于10~20 cm土层(P<0.05),而放牧条件下土壤蔗糖酶和碱性磷酸酶活性在土壤表层显著高于10~20 cm土层(P<0.05),主要原因在于土壤表层累积了较多的枯枝落叶和腐殖质,有机质含量高,使表层土壤酶活性较高。另外,围封与放牧措施可能使得土壤微生物群落结构不同,最终导致不同酶在土壤剖面上的活性表现不一致。
3.3土壤微生物生物量与土壤酶活性的关系 关于土壤微生物量和土壤酶关系的报道结果也不相一致[15-16,32,35],这可能和研究区域及土地利用方式的不同有关。吕桂芬等[15]在研究不同退化草地土壤微生物量碳和氮含量与土壤酶活性的关系时发现,土壤微生物量碳含量与土壤蔗糖酶活性呈显著正相关,与脲酶活性无相关关系。同样,闫瑞瑞等[32]在呼伦贝尔草原研究不同放牧强度下土壤微生物量碳和氮含量与土壤酶活性的关系时,也发现,土壤微生物量碳含量与土壤蔗糖酶活性呈显著正相关,与脲酶活性无相关,但土壤微生物量氮含量与土壤蔗糖酶活性呈显著负相关,与土壤脲酶活性无相关关系。而靳正忠等[16]对荒漠区不同防护林土壤微生物量碳和氮含量与土壤酶活性关系的研究发现,土壤微生物量碳和氮均与土壤脲酶、蔗糖酶、磷酸酶活性无相关关系。蔡晓布等[36]对藏北退化高寒草地的研究发现,土壤微生物量碳和氮均与土壤脲酶、蔗糖酶、磷酸酶活性呈显著正相关。本研究发现,微温干旱温带半荒漠类草地在围封与放牧条件下土壤微生物量碳和氮含量与土壤酶活性的关系有明显差异,围封条件下,仅土壤微生物量碳含量与土壤脲酶活性呈显著正相关,与土壤蔗糖酶活性呈显著负相关。而放牧条件下,土壤微生物量碳和氮均与土壤脲酶活性呈显著负相关,而与蔗糖酶和碱性磷酸酶活性呈显著正相关。另外,土壤微生物量碳氮比与脲酶活性在放牧条件下也表现出显著的正相关关系。造成上述结果可能主要与两种处理下土壤微生物的群落结构有关。微生物量碳氮比通常能够反映土壤微生物群落的结构[26],真菌生物量的碳氮比一般为7~12,细菌真菌生物量的碳氮比一般为3~6[37-38]。本研究中,放牧地土壤微生物量碳氮比显著高于放牧样地,说明放牧地土壤微生物群落中真菌占优势,土壤真菌数量的增多往往与脲酶活性的提高有密切关系[33]。综合上述分析,可见土壤微生物总量与土壤酶活性存在复杂的关系,不能笼统地说土壤微生物量的增多有助于土壤酶活性的提高,这一问题的研究,需要将具体的一种土壤酶与分泌这些酶的微生物类群或种群对应起来分析,才能从根本上回答土壤酶活性的降低是由分泌此种酶的微生物数量减少引起的还是由酶的活性基团减少引起的。
[1] 刘晓冰,刑宝山,Herbert S J.土壤质量及其评价指标[J].农业系统科学与综合研究,2002,18(2):109-112.
[2] Sparling G P.Ratio of microbial biomass carbon to soil organic matter carbon as a sensitive indicator of changes in soil organic matter[J].Australian Journal of Soil Research,1992,30(2):195-207.
[3] 向泽宇,王长庭,宋文彪,等.草地生态系统土壤酶活性研究进展[J].草业科学,2011,28(10):1801-1806.
[4] Dick R P.Soil enzyme activities as indicators of soil quality[A].In:Doran J W.Defining Soil Quality for a Sustainable Environment[M].Madison:Soil Science Society of America,1994:107-124.
[5] 陈利军,武志杰.与氮转化有关的土壤酶活性对抑制剂施用的响应[J].应用生态学报,2002,13(9):1099-1103.
[6] 赵帅,张静妮,赖欣,等.放牧与围封对呼伦贝尔针茅草原土壤酶活性及理化性质的影响[J].中国草地学报,2011,33(1):71-76.
[7] Jenkinson J S,Ladd J N.Microbial biomass in soil:Measurement and turnover[A].In:Paul V E A,Ladd J N.Soil Biochemistry[M].NewYork:Marcel Dekker Inc.,1981:415-471.
[8] Powlson D S,Brooks P C,Christensen B T.Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation[J].Soil Biology and Biochemistry,1987,19:159-164.
[9] 薛青芳,高艳梅,汪景宽,等.土壤微生物量碳氮作为土壤肥力指标的探讨[J].土壤通报,2007,38(2):247-250.
[10] 何振立.土壤微生物量及其在养分循环和环境质量评价中的意义[J].土壤,1997,29(2):61-69.
[11] 姜培坤,徐秋芳,俞益武.土壤微生物量碳作为林地土壤肥力指标[J].浙江林学院学报,2002,19(1):17-19.
[12] 齐玉春,董云社,耿元波,等.我国草地生态系统碳循环研究进展[J].地理科学进展,2003,22(4):342-352.
[13] 姚拓,马丽萍,张德罡,等.我国草地土壤微生物生态研究进展及浅评[J].草业科学,2005,22(11):1-7.
[14] 何亚婷,董云社,齐玉春,等.草地生态系统土壤微生物量及其影响因子研究进展[J].地理科学进展,2010,29(11):1350-1359.
[15] 吕桂芬,吴永胜,李浩,等.荒漠草原不同退化阶段土壤微生物、土壤养分及酶活性的研究[J].中国沙漠,2010,30(1):104-109.
[16] 靳正忠,雷加强,徐新文,等.塔里木沙漠公路防护林土壤微生物生物量与土壤环境因子的关系[J].应用生态学报,2009,20(1):51-57.
[17] 朱震达.中国土地沙质荒漠化[M].北京:科学出版社,1994.
[18] 龚家栋.阿拉善地区生态环境综合治理意见[J].中国沙漠,2005,25(1):98-105.
[19] 包丽琳,刘春祥,潘存军.阿拉善盟荒漠草地畜牧业生产存在的问题及发展前途[J].畜牧与饲料科学,2004(4):54-55.
[20] 王彦荣,曾彦军,傅华,等.过牧及封育对红砂荒漠植被演替的影响[J].中国沙漠,2002,22(4):321-327.
[21] 傅华,陈亚明,周志宇,等.阿拉善荒漠草地恢复初期植被与土壤环境的变化[J].中国沙漠,2003,23(6):661-664.
[22] Pei S F,Fu H,Wan C G.Changes in soil properties and vegetation following exclosure and grazing in degraded Alxa desert steppe of Inner Mongolia,China[J].Agriculture,Ecosystems and Environment,2008,124:33-39.
[23] Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuring soil microbial biomass[J].Soil Biology and Biochemistry,1987,19(6):703-707.
[24] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:296-339.
[25] 赵吉.不同放牧率对冷蒿小禾草草原土壤微生物数量和生物量的影响[J].草地学报,1999,7(3):223-227.
[26] 陈懂懂,孙大帅,张世虎,等.放牧对青藏高原东缘高寒草甸土壤微生物特征的影响[J].兰州大学学报(自然科学版),2011,47(1):73-81.
[27] 王尚,蒋宏枕,黄柳琴,等.中国东部农耕区土壤微生物碳的分布及影响因素[J].地学前缘,2011,18(6):134-142.
[28] 宋俊峰,韩国栋,张功,等.放牧强度对草甸草原土壤微生物数量和微生物生物量的影响[J].内蒙古师范大学学报(自然科学汉文版),2008,37(2):237-240.
[29] 盛海彦,李松龄,曹广民.放牧对祁连山高寒金露梅灌丛草甸土壤微生物的影响[J].生态环境,2008,17(6):2319-2324.
[30] 单贵莲,初晓辉,罗富成,等.围封年限对典型草原土壤微生物及酶活性的影响[J].草原与草坪,2012(1):1-6.
[31] 赵吉,郭婷,邵玉琴.内蒙古典型草原土壤微生物生物量及其周转与流通量的初步研究[J].内蒙古大学学报(自然科学版),2004,35(6):673-676.
[32] 闫瑞瑞,闫玉春,辛晓平.不同放牧梯度下草甸草原土壤微生物和酶活性研究[J].生态环境学报,2011,20(2):259-265.
[33] 文都日乐,张静妮,李刚,等.放牧干扰对贝加尔针茅草原土壤微生物与土壤酶活性的影响[J].草地学报,2010,18(4):517-522.
[34] 焦婷,常根柱,周学辉,等.温性荒漠化草原不同放牧强度下土壤酶与肥力的[J].草地学报,2009,17(5):581-587.
[35] 郭继勋,林海俊.不同草原植被碱化草甸土的酶活性[J].应用生态学报,1997,20(4):412-416.
[36] 蔡晓布,钱成,张永清.退化高寒草原土壤生物学性质的变化[J].应用生态学报,2007,18(8):1733-1738.
[37] Jenkinson D S.Determination of microbial biomass carbon and nitrogen in soil[A].Wilson J R.Advances in Nitrogen Cycling in Agricultural Ecosystems[M].Wallingford:Commonwealth Agricultural Bureau International,1988:368-386.
[38] Harris D,Voroney R P,Paul E A.Measurement of microbial biomass N:C by chloroform fumigation incubation[J].Canadian Journal of Soil Science,1997,77(5):507-514.
