同型半胱氨酸对BMVECs 凋亡相关基因BCL-2/BAX 表达的影响
2013-03-11孙文萍谢春香赵节绪
孙文萍,谢春香,赵节绪
高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)引起动脉粥样硬化(Atherosclerosis,AS)的机制还不完全清楚,但是研究发现,同型半胱氨酸可以破坏血管内皮细胞,促进其凋亡,造成内皮功能障碍[1,2],这是其中一项重要的机制。本实验通过培养大鼠的脑微血管内皮细胞(brain microvascular endothelial cells,BMVECs),研究同型半胱氨酸促使BMVECs 产生凋亡的可能途径。
1 材料和方法
1.1 材料
RPMI-1640 培养基、优质胎牛血清(Gibco,美国);胶原酶Ⅱ型(sigma,美国)、促内皮细胞生长因子(Roche,美国)、D,L-homocysteine(Hcy)(Sigama美国)、生物素化山羊抗兔IgG(北京中山试剂公司)、兔抗NF-κB p65 多克隆抗体(Santa Cruz,美国),总RNA 提取试剂盒、反转录试剂盒购自Sigama,逆转录-聚合酶链反应试剂盒、引物购自上海生工。
1.2 方法
1.2.1 BMVECs 细胞培养及鉴定
本实验室已经培养成功并通过Ⅷ因子抗原免疫染色鉴定的大鼠BMVECs,取第三代细胞用于实验。
1.2.2 MTT 实验
按1×103~1×104/ml 密度接种细胞于96 孔培养板中,分成两大组,待细胞贴壁后一组加不同浓度药物(Hcy 50μmol/L、Hcy 200μmol/L、Hcy 1000μmol/L、Hcy 2000μmol/L)和CuSO4(4μmol/L)共同培养18h;另一组只加不同浓度的Hcy 进行培养,每种浓度平行8 孔;另设对照组。干预18h 后每孔加入MTT 溶液20ml,37℃,继续孵育4h,终止培养,小心吸弃孔内培养上清液,然后每孔加入150ml DMSO,振荡10min,使结晶物充分溶解;选择570nm波长,以空白培养液调零点,在酶联免疫检测仪上测定各孔光吸收值A,记录结果。实验重复3 次,绘制时间、剂量效应曲线。
1.2.3 细胞免疫化学法(ABC 法)检测NF-κB p65 的表达
细胞爬片后固定、封闭,分别加入一抗和二抗后显色,于Luzex-F 图像分析仪(加拿大)下计数每张片子5 个视野的NF-κB p65 阳性细胞率。
1.2.4 蛋白质免疫印记分析(Western-bolt 法)NF-κB p65 的表达
取1×107细胞提取胞核蛋白,电转膜法将蛋白转移至硝酸纤维素膜上,用含5%脱脂奶粉的PBS液浸泡硝酸纤维膜,以封闭非特异抗体结合。加入一抗兔抗NF-κB p65 多克隆抗体(1∶1000),常温下摇振4h,加二抗HRP 羊抗兔IgG(1∶5000)常温下摇振2h。ECL 检测试剂盒显影,X 线压片曝光,HPIAS-1000 型图像分析系统分析结果。
1.2.5 RT-PCR 法检测Bax 及Bcl-2 的表达
BMVECs 分为4 组,分别加入1mmol/L 的Hcy及4μmol/L CuSO4,各培养0、6、12 和18h 后,分别收集细胞,提取总RNA,以2μg 总RNA 进行反转录。扩增Bcl-2(正义引物:5 ’-CACCC2CTGGCATCTTCT-CCTT-3’,反义引物:5’-CACAATCCTCCCCCAGTTCACC-3’,),扩增产物长度为304bp;Bax(正义引物:5’-ATGGCTGGGGAGACACCTGAG-3 ’,反义引物:5 ’-CTAGCAAAGTAGAAGAGGGCAAC-3’);,扩增产物长度为240 bp;内参照β-actin(正义引物:5’-TTGTAACCAACTGGGACGATATGG-3’,反义引物:5 ’-GATCTTGATCTTCATGGTGCTAGG-3’),扩增产物长度为764 bp。扩增条件:94 ℃变性1min,55 ℃退火1min,72 ℃延伸2min,循环35 次。扩增完毕后取PCR 产物10μl 于1.5%的琼脂糖凝胶电泳上检测,凝胶图像分析仪(法国VL 公司,Bio-ID)分析。
1.3 统计学方法
2 结果
2.1 MTT 结果
细胞培养18h 后,我们发现,单独添加Cu-SO(4μmol/L)组的细胞存活率没有受到影响;培养液中不含CuSO4(4μmol/L)时,各Hcy 浓度组细胞OD570 值无显著区别(P>0.05);当培养液中添加CuSO4(4μmol/L)时,Hcy 浓度为1mmol/L 及2 mmol/L 的两组细胞OD570 值明显降低(P 分别为0.034 和0.006),而 Hcy 浓度为50μmol/L、200μmol/L 的两组细胞OD570 值较对照组差异不显著(P>0.05))。因此以后的试验中,我们选用的Hcy 干预浓度为1 mmol/L(含CuSO44μmol/L)。
2.2 NF-κB p65 表达的免疫细胞化学检测
正常情况下,即血管内皮细胞未受到外界刺激时,由于NF-κB 和IκB-α 蛋白质结合成三聚体形式存在于细胞质,NF-κB 处于未活化状态。故1mmol/L 的Hcy+4 μmol/L CuSO4干预细胞后,0h 组细胞染色后NF-κB p65 只在细胞浆表达,胞浆染色淡;6h后,NF-κB 不仅在细胞浆内表达增强,而且转入细胞核内表达,发生核转移,谓之阳性细胞(P<0.05),在12h 时达高峰,细胞核着色明显,阳性细胞百分数显著增多(P<0.01);而到18h 时,NF-κB 核转位的现象开始减弱(P>0.05)。
2.3 NF-κB 表达的Western-blot 法检测
Western 印迹杂交结果与免疫细胞化学结果基本一致。在对照组细胞的核蛋白提取液中,基本没有NF-κB 的表达;1.0mmol/L Hcy+4 μmol/L Cu-SO4刺激细胞6h 出现核蛋白提取液中NF-κB 的表达,12h 时达高峰,到18h 时表达减少。
2.4 Bax 及Bcl-2 mRNA 的表达
Hcy 作用后0~18h,细胞Bcl-2 mRNA 水平逐步降低,而Bax mRNA 水平逐步升高。二者的比值呈下降趋势(见图1~图4)。
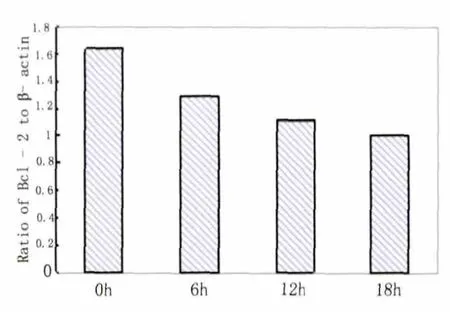
图1 不同时间点Bcl-2 与β-actin 的mRNA 比值
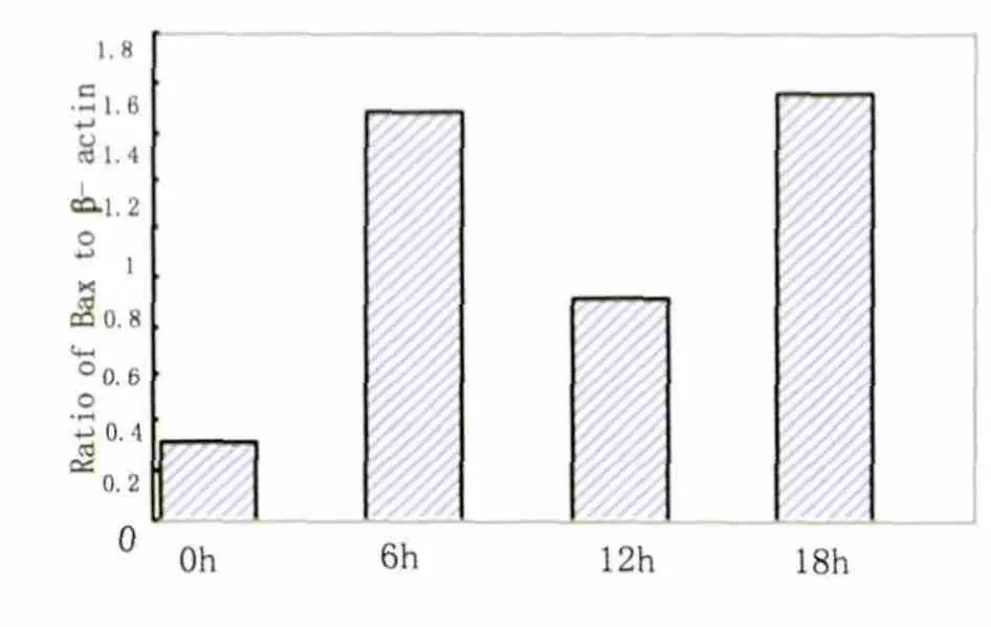
图3 不同时间点Bax 与β-actin 的mRNA 比值

图4 不同时间点Bax 的mRNA 表达
3 讨论
细胞凋亡是一个极其复杂、精密的过程,涉及到许多事件的发生,包括凋亡相关基因表达的升高或下调等。已证实,细胞凋亡的发生主要通过两条途径产生:即线粒体凋亡途径和死亡受体(Fas-FasL)介导的途径[3]。在病理条件下,Hcy 攻击的主要靶细胞是血管内皮细胞,它可以造成血管内皮细胞凋亡,是发生动脉硬化的始动部位。有研究认为,Hcy可以通过多方面的作用引起内皮细胞凋亡。Austin认为Hcy 诱导的内皮细胞凋亡主要有两个途径[4]:其一为未折叠蛋白反应(unfolded protein response,UPR)介导的细胞凋亡;此外,胱冬酶-3(caspase-3)的激活是Hcy 引起细胞凋亡的另一机制。Hcy 能造成细胞内ROS 增加,使线粒体失去正常的跨膜电位,导致细胞色素C(cytochrome-c)的释放,进而激活caspase9、6、3,最后出现核蛋白降解,DNA 断裂,细胞死亡[5]。Kerkeni 发现,Hcy 的衍生物同型半胱氨酸硫内酯(homocysteine thiolactone),通过激活caspase-3 使人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)细胞DNA 断裂,细胞死亡[6]。在这一病理过程中,caspase-3 和线粒体细胞色素C 的活性和释放均明显增加[7]。在caspase-3 和线粒体细胞色素C 介导的线粒体凋亡途径中,线粒体膜通透性转变孔(permeablity transition pore,PTP)的开放和关闭是决定细胞是否发生凋亡的关键[8]。而Bcl-2 家族成员对细胞凋亡的调控主要是通过调控线粒体的PTP 的开放和关闭来实现的。其中Bcl-2 和Bax 是一对正负凋亡调节基因,Bcl-2可抑制PTP 的开放从而抑制凋亡因子的释放和阻止凋亡的发生,而Bax,Bad,Bak 等作用恰恰相反,它们促进PTP 开放,从而促进凋亡因子释放。细胞中的Bax 蛋白可自身形成同源二聚体,并易与Bcl-2蛋白形成异源二聚体复合物,从而使Bax 失活。Bcl-2 表达相对增多时,Bcl-2/Bax 二聚体增多,消除Bax 的促凋亡效应,而Bax 表达相对增多时Bax/Bax同源二聚体增加,促凋亡作用上调。Duan[9]用不同浓度的Hcy 干预HUVEC 24h,发现Hcy 可以上调Bax 的表达,下调Bcl-2 的表达;Tyagi[5]培养鼠心微血管内皮细胞,通过cDNA 芯片检测发现,Hcy 使mRNA 水平的Bcl-2/Bax 比值下降,激活caspase9、3,进而引起细胞凋亡。
我们的研究发现,Hcy 对BMVECs 的生长有明显的抑制作用,可以造成细胞死亡。并且干预组BMVECs 的Bcl-2 mRNA 于处理后0~18h 呈持续降低趋势,而Bax mRNA 基本呈增高趋势,Bcl-2/Bax比值降低。此结果提示,Hcy 可能通过抑制Bcl-2 基因表达,促进Bax 基因表达,使Bcl-2/Bax 比值降低,致使细胞凋亡和存活信息平衡失调,从而最终诱导细胞调亡。可见Bcl-2 和Bax 基因在Hcy 诱导BMVECs 细胞凋亡过程中同样起着重要的作用。
Bcl-2 和Bax 基因的表达受核转录因子NF-κB及JNK 等途径的调控。有人[4,10,11]在观察Hcy 对平滑肌细胞及内皮细胞的影响时发现,Hcy 可以激活NF-κB,促进NF-κB 的核转位。用超氧负离子清除剂或I-κB 抑制剂可抑制Hcy 诱导的IKK 激活和NF-κB 激活[12]。我们在蛋白质水平上检测到,Hcy干预后不同时间点脑微血管内皮细胞的NF-κB 的的表达,结果证实有NF-κB 核转位的变化:6h,NFκB 已经出现胞核内表达;12h 时达高峰,细胞核着色明显;18h 时,这一现象开始减弱。已知NF-κB 是能调节多种炎症和免疫基因表达的一种重要的转录调控因子,它在相当广泛的病理生理过程中起调控作用,其中包括细胞凋亡现象。现有的部分实验研究表明,NF-κB 激活能保护细胞免于凋亡,而另一些研究中则发现,NF-κB 能促进凋亡基因的表达。可见NF-κB 的激活在细胞凋亡中的调控作用是多层次多方面的,这可能与研究细胞的种类及所处应激环境不同有关。本研究中观察到,随着NF-κB 的激活,Bcl-2 mRNA 于处理后0-18 h 呈持续降低趋势,而Bax mRNA 转录水平呈增高趋势,提示在Hcy 致内皮细胞损伤的过程中,NF-κB 有可能参与了Bc1-2 和Bax 基因介导的细胞凋亡途径。
[1]Alkhoury K,Parkin SM,Homer-Vanniasinkam S,et al.Chronic homocysteine exposure upregulates endothelial adhesion molecules andmediates leukocyte:endothelial cell interactions under flow conditions[J].Eur J Vasc Endovasc Surg,2011,41(3):429-435.
[2]Dionisio N,Jardín I,Salido GM,et al.Homocysteine,intracellular signaling and thrombotic disorders[J].Curr Med Chem,2010,17(27):3109-3119.
[3]Zakeri Z,Lockshin RA.Cell death:history and future[J].Adv Exp Med Biol,2008,615:1-11.
[4]Austin RC,Lentz SR,Werstuck GH.Role of hyperhomocysteinemia in endothelial dysfunction and atherothrombotic disease[J].Cell Death and Differentiation,2004,11:56-64
[5]Tyagi N,Ovechkin AV,Lominadze D,et al.Mitochondrial mechanism of microvascular endothelial cells apoptosis in hyperhomocysteinemia[J].J Cell Biochem,2006,98(5):1150-1162.
[6]Kerkeni M,Tnani M,Chuniaud L,et al.Comparative study on in vitro effects of homocysteine thiolactone and homocysteine on HUVEC cells:evidence for a stronger proapoptotic and proinflammative homocysteine thiolactone[J].Mol Cell Biochem,2006,291(1-2):119-126.
[7]Li L,Hu BC,Gong SJ,et al.Homocysteine-induced caspase-3 activation by endoplasmic reticulum stress in endothelial progenitor cells from patients with coronary heart disease and healthy donors[J].Biosci Biotechnol Biochem,2011,75(7):1300-1305.
[8]Rasola A,Bernardi P.Mitochondrial permeability transition in Ca2+-depen-dent apoptosis and necrosis[J].Cell Calcium,2011,50(3):222-233.
[9]Duan J,Dai S,Fang CX,et al.Phytoestrogen alpha-zearalanol antagonizes umbilical vein homocysteine-induced imbalance of nitric oxide/endothelin-1 and apoptosis in human endothelial cells[J].Cell Biochem Biophys,2006,45(2):137-145.
[10]Au-Yeung KK,Woo CW,Sung FL,et al.Hyperhomocysteinemia Activates Nuclear Factor-kB in Endothelial Cells via Oxidative Stress[J].Circ Res,2004,94:28-36.
[11]Lin CP,Chen YH,Chen JW,et al.Cholestin(Monascus purpureus rice)inhibits homocysteine-induced reactive oxygen species generation,nuclear factor-kappaB activation,and vascular cell adhesion molecule-1 expression in human aortic endothelial cells[J].J Biomed Sci,2008,15(2):183-196.
[12]Au-Yeung KKW,Woo CWH,Sung FL,et al.Hyperhomocysteinemia Activates Nuclear Factor-κB in Endothelial Cells via Oxidative Stress[J].Circ Res,2004,94:28-36
