钙敏感受体在癫痫大鼠发作中的表达和凋亡通路的变化
2013-03-11李晓捷姜志梅张丽华吕智海王鲁川张明达
郭 津,李晓捷,姜志梅,张丽华,庞 伟,吕智海,王鲁川,张明达
钙敏感受体(calcium-sensing receptor,CaSR)属G 蛋白偶联受体C 家族成员,具有氨基胞外域(ECD)、7 个跨膜结构组成的中心区(TMD s)和胞内羧基末端(COOH)[1,2]。1993 年,CaSR 首先发现于牛甲状旁腺,CaSR 不仅在维持机体Ca2+和其它金属离子稳态发挥关键作用,而且参与调节细胞分化、增殖、凋亡、基因表达、离子通道开放等[3~6]。本实验观察戊四氮诱导的大鼠癫痫发作模型中的CaSR 表达规律,及氧化应激和细胞凋亡在癫痫发作中的作用。
1 材料和方法
1.1 主要试剂和仪器 戊四氮(pentetrazole PTZ 美国sigma 公司);髓过氧化物酶(MPO)试剂盒和黄嘌呤氧化酶(XOD)试剂盒(南京建成生物工程研究所);TUNEL 检测试剂盒(罗氏公司)Beckman DU640 紫外分光光度计H-600 型;紫外凝胶检测和成像系统(Bio-Rad)。
1.2 大鼠癫痫发作模型的复制 Wistar 大鼠,雌雄各半,体重200±20g,由佳木斯大学动物实验中心提供。采用大鼠腹腔注射PTZ[35mg/(kg·d)],连续28d,制备大鼠癫痫模型。
1.3 实验分组 动物随机分为2 组(每组n=12):对照组(control group),癫痫组(epilepsy group)。
1.4 观察指标
1.4.1 XOD、MPO 的含量测定 大鼠麻醉后,眼球取血2ml,待血液凝固后,3000r/min 4℃离心10min,取上层血清,严格按试剂盒说明操作,分别测定XOD、MPO 的含量。
1.4.2 海马组织尼氏染色的光镜观察 实验结束后,从大鼠海马部切取的1mm×1mm×1mm 脑组织,用4%多聚甲醛磷酸缓冲溶液固定24~48h。常规脱水、浸蜡、包埋、染色、透明和封片,制成尼氏普通的染色切片,进行光学显微镜观察。
1.4.3 CaSR、Bax、Bcl-2 和caspase-3 蛋白表达的检测 海马组织放入研钵中,低温研磨后,加入蛋白裂解液及苯甲基磺酰氟(Phenyl methane sulfonyl fluoride PMSF),冰上放置40min,4℃下12000r/min离心40min,取上清。以BSA 为标准,用Bradford 法对上清进行蛋白定量。取20μg 蛋白样品,10%SDS-PAGE 电泳,100V 转移1h 至硝酸纤维素薄膜,放入封闭液中37℃封闭1h;抗分别为anti-CaSR(1∶3000)、anti-Bax(1∶500)、anti-Bcl-2(1∶500)、anti-caspase-3(1∶500),4℃过夜。同时,另1 张用不含抗体TBS-T 液孵育,作为阴性对照。反复洗膜后,将膜与碱性磷酸酶(AP)标记的抗IgG 抗体(1∶1000)孵育,室温轻摇1h,洗膜后,用Western blotting印迹观察,用图像分析测定各带吸光度(A)值做定量分析。
1.4.4 TUNEL 染色 切片常规脱蜡脱水,20μl 蛋白酶K 室温孵育15~30min,消化组织蛋白3% H2O2溶液浸泡10min,灭活内源性酶,滴加50μl TUNEL 反应混合液,37℃孵育60min,50μl POD 标记的抗荧光素抗体滴于玻片,37℃孵育30min,DAB显色20min 苏木素复染,PBS 冲洗,脱水、透明、封片。光镜下正常海马神经元核染成蓝色(TUNEL 阴性),凋亡细胞核呈棕褐色(TUNEL 阳性)。每张切片随机取5 个以上高倍视野,计数不少于500 个海马神经元,计算凋亡率。公式如下:凋亡率=(凋亡细胞数/500)×100%。
2 结果
2.1 XOD 和MPO 的含量变化 实验结束时测定大鼠XOD 和MPO 的含量,检测结果癫痫组明显高于正常组(P<0.01 vs contro l)(见表1)。
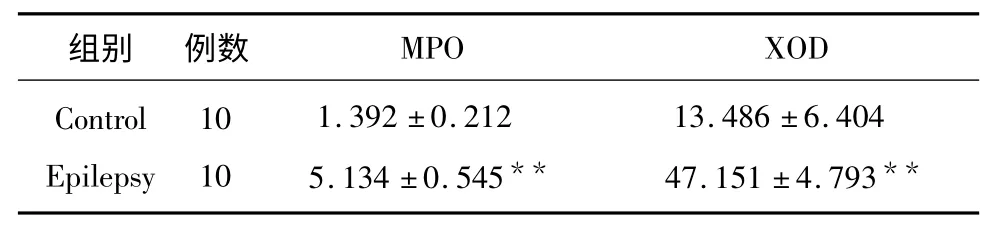
表1 XOD 和MPO 的含量变化
2.2 海马组织的形态学变化 对照组皮质区神经细胞排列整齐,边缘清晰,胞浆淡染,胞浆内尼氏小体丰富。癫痫组细胞形态不完整,细胞肿胀、破裂、轮廓模糊、排列紊乱、细胞间距加大,胞浆内尼氏小体减少。对照组神经元数目为102.56±11.37,癫痫组神经元数目为36.62±4.09,对照组与癫痫组相比差异有统计学意义(P<0.01)(见图1)。
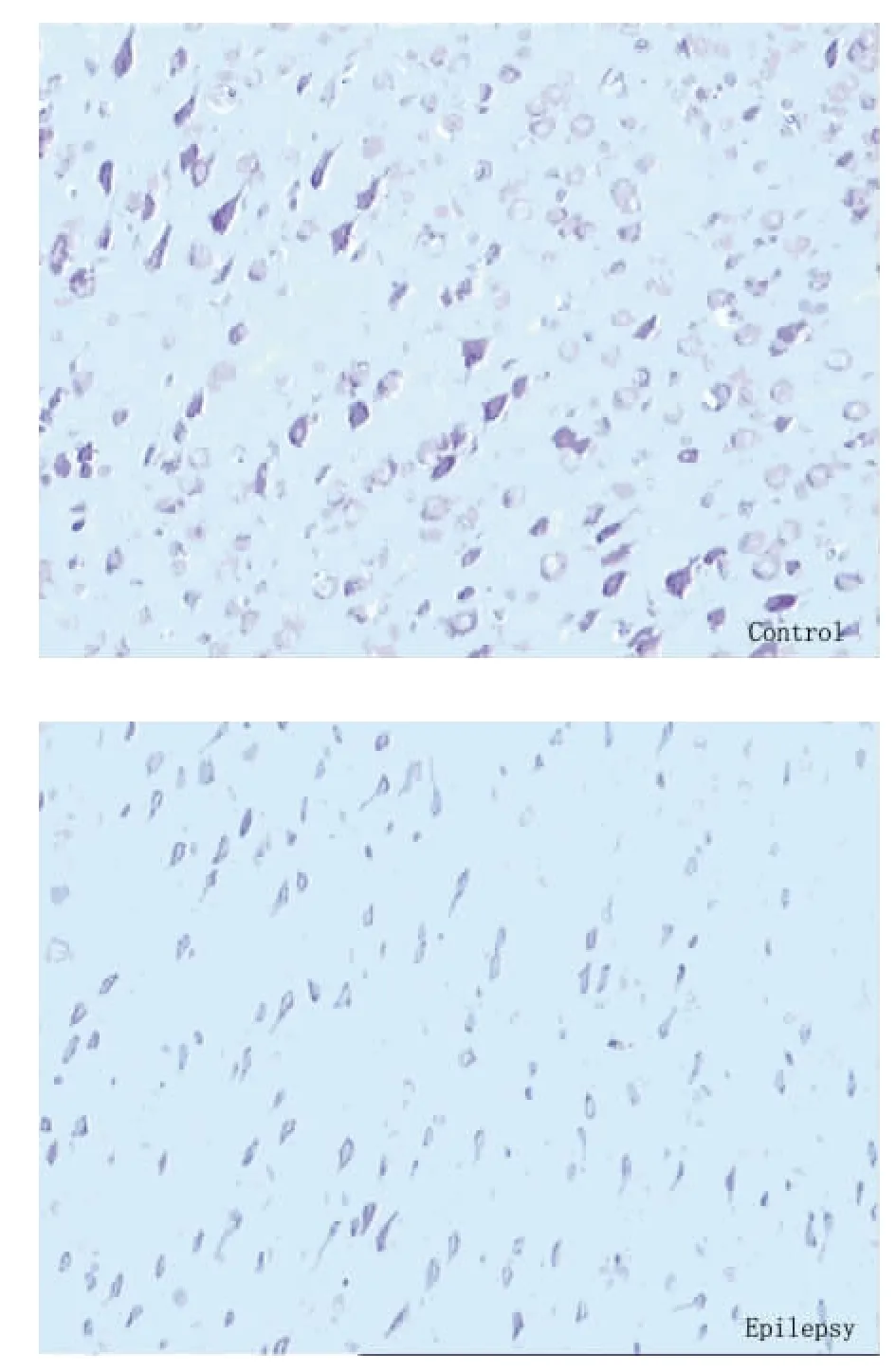
图1 光镜下海马组织尼氏染色的观察(×40 倍)
2.3 大鼠海马组织CaSR 蛋白表达情况 大鼠CaSR 的蛋白表达,癫痫组明显高于正常组(P<0.05 vs control)(见图2)。
2.4 大鼠海马组织Bax、Bcl-2、caspase-3 蛋白表达情况 大鼠Bax 的蛋白表达,癫痫组明显高于正常组(P<0.05)(见图3)。大鼠Bcl-2 的蛋白表达,癫痫组明显低于正常组(P<0.05)(见图4)。大鼠caspase-3 的蛋白表达,癫痫组明显高于正常组(P<0.05)(见图5)。
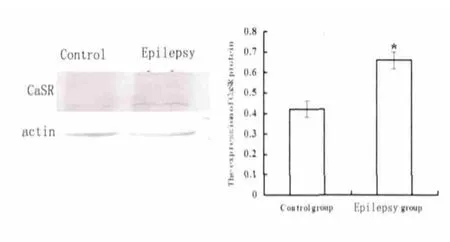
图2 不同组别海马组织中CaSR 蛋白的表达(* P<0.05 vs control)
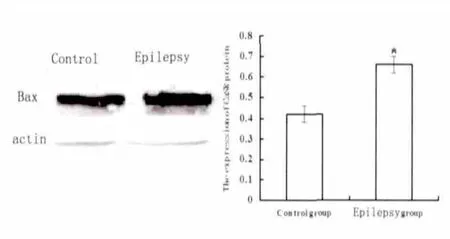
图3 不同组别海马组织中Bax 蛋白的表达(* P<0.05 vs control)

图4 不同组别海马组织中Bcl-2 蛋白的表达(* P<0.05 vs control)
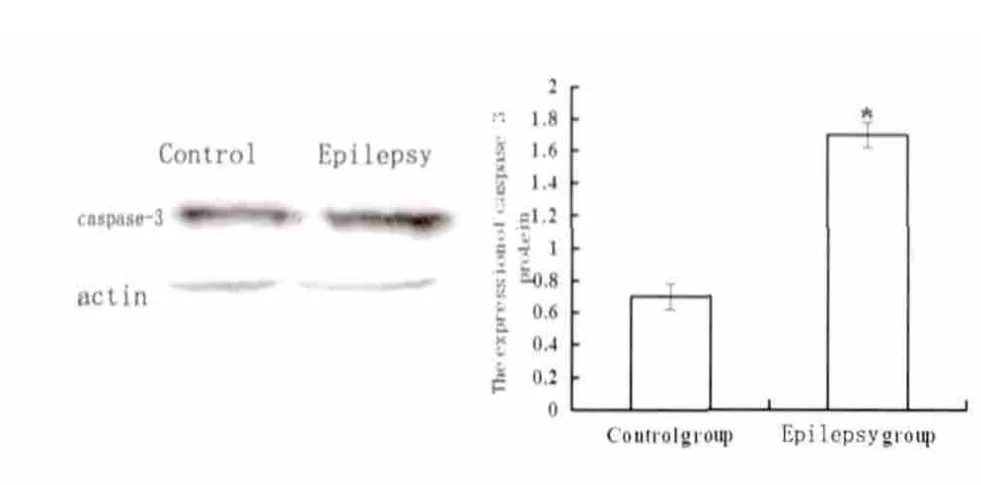
图5 不同组别海马组织中caspase3 蛋白的表达(* P<0.05 vs control)
2.5 大鼠海马组织细胞凋亡变化 在大鼠神经细胞TUNEL 染色中,细胞核呈棕色为凋亡阳性细胞,细胞核呈蓝色则为非凋亡的阴性细胞。结果表明:与对照组相比,癫痫组凋亡细胞数明显增多(见图6)。

图6 大鼠海马组织TUNEL 染色结果(* P<0.05 vs control)
3 讨论
癫痫是一种常见的以反复突然发作的意识丧失伴抽搐为主要症状的慢性神经系统疾病,全世界有超过五千万的癫痫患者[7,8]。但由于对癫痫认识的局限性,癫痫的病因和发病机制尚不完全清楚[9~11]。点燃模型为目前应用最广泛的癫痫模型,特别是其发病机制被认为与人类癫痫的发病机制相似。PTZ 点燃不仅可进行性提高发作易感性,还可引起脑功能改变,现被公认为难治性癫痫的理想模型。鉴此,本实验采用连续腹腔注射PTZ 的方法复制癫痫模型。结果显示:模型组有连续多次的Ⅲ~Ⅴ级癫痫发作,根据文献报道的标准可以认为实验动物均达到点燃标准,癫痫模型制备成功。
采用Western blotting 技术,本文观察到模型组脑组织CaSR 蛋白表达明显增多,它提示脑组织CaSR 的表达增加参与了癫痫的发生。我们在癫痫的海马神经元模型中,运用CaSR 激动剂和阻断剂,进一步证实CaSR 的表达增加通过激活凋亡信号通路促进海马神经元凋亡的发生(另文发表)。本文还观察到模型组血清中XOD 和MPO 含量升高,这表明氧化应激是癫痫所致脑损伤的内在机制之一。我们前期研究已证明,细胞外钙增加及其它CaSR激动剂(Gd3+、精胺等)可通过G 蛋白PLC-IP3 信号转导途径,引起肌浆网内钙释放增加,导致细胞内游离钙增多,发生细胞内钙超载。
众多实验表明,Bcl-2 家族促凋亡成员(如Bax、Bak 和tB id 等)在凋亡因素刺激下可转位到线粒体外膜形成孔道,而抑凋亡成员(如Bcl-2、Bcl-xl)则可阻止之。因此,抑凋亡与促凋亡成员之间的平衡将决定细胞生存或凋亡。一般认为,过度的Ca2+内流在癫痫的发生上起着重要的作用,尤其是引起细胞凋亡和坏死。在我们的实验中,HE 染色、TUNEL 染色观察均证明,PTZ 所致大鼠癫痫模型发生了明显的海马神经元凋亡或坏死。本实验还观察到:模型组caspase-3 活化后形成的17×103的多肽片段及Bax 的表达明显高于对照组,Bcl-2 的表达明显低于对照组。可见,模型组细胞凋亡的发生,显然与抑凋亡成员与促凋亡成员之间的失衡有关[12]。
综上,PTZ 复制癫痫发作模型可引起大鼠脑组织CaSR 表达增加和细胞凋亡,其机制与氧化应激和细胞凋亡可能也参与了癫痫的发作。
[1]Bai M,Quinn S,Trived i S,et al.Expression and characterization of in ac tivating and activating muta tions in the human Ca2+-sensing receptor[J].J Biol Chem,1996,271(32):19537-19545.
[2]Bai M,Trivedi S,Kifor O,et al.Structure and function of the extracellular[J].Int J Mol Med,1999,4(6):115-125.
[3]Brown EM,Gamba G,Riccardi D,et al.Cloning and characterization of an ex tracellular Ca2+-sensing receptor from bovine parathyroid[J].Nature,1993,366(6455):575-580.
[4]Hebert SC,Brown EM,Harris HW.Role of the Ca2+-sensing receptor in diva lentmineral ion homeostasis[J].J Exp Biol,1997,200(Pt 2):295-302.
[5]Hebert SC,Cheng S,Geibe lJ.Functions and roles of the extracellular Ca2+-sensing receptor in the gastro intestinaltract[J].Cell Calcium,2004,35(3):239-247.
[6]van den Hurk MJ,Jenks BG,Roubos EW,et al.The extracellular calcium-sensing receptor increases the number of calcium steps and action currents in pituitary melanotrope cells[J].Neuro sc i Lett,2005,377(2):125-129.
[7]de Boer HM,Mula M,Sander JW.The global burden and stigma of epilepsy[J].Epilepsy Behav,2008,12(4):540-546.
[8]Blume WT,Luders HO,Mizrahi E,et al.Glossary of descriptive terminology for ictal semiology:report of the ILAE task force on classification and terminology[J].Epilepsia,2001,42(9):1212-1218.
[9]Duncan JS,Sander JW,Sisodiya SM,et al.Adult epilepsy[J].Lancet,2006,367(9516):1087-1100.
[10]Mc Cormick DA,Contreras D.On the cellular and network bases of epileptic seizures[J].Annu Rev Physiol,2001,63:815-846.
[11]Badawy RA,Harvey AS,Macdonell RA.Cortical hyperexcitability and epilepto genesis:understanding the mechanisms of epilepsypart1[J].J Clin Neurosci,2009,16(3):355-365.
[12]郭 津,徐长庆,李鸿珠,等.大鼠异丙肾性心肌梗死中钙敏感受体的表达和凋亡通路变化[J].中国病理生理杂志,2009,25(1):48-53.
