肝素连接苯丙氨酸血液净化材料去除内毒素的研究
2013-03-10靳欣欣毛金春唐福州熊延连
靳欣欣 王 翔 毛金春 唐福州 熊延连
(重庆大学生物流变学重点实验室,重庆 400044)
引言
内 毒 素 (endotoxin, ET ) 即 脂 多 糖(lipopolysaccharides,LPS)。人体在严重创伤、感染时易引发内毒素血症(Endotoxemia,ETM),进而引起全身炎症反应综合征、脓毒症、多器官功能障碍综合征等。
利用血液净化方法[1]去除体内内毒素是现在临床研究重点,其根本是寻找一种高效安全的净化吸附材料。
内毒素的吸附原理是利用了内毒素分子的负电性、疏水亲水性及含有大量可形成氢键的-OH,吸附作用包括了静电作用、氢键作用、疏水作用[2]:静电作用去除内毒素主要是利用了内毒素在pH 值大于1.3 时带负电的特性。正电性分子如-NH2可吸附内毒素。在3 种吸附作用中,静电吸附相对而言是吸附率最高的。但缺点是因血液中的蛋白多为负电性,所以共吸附现象严重,选择性不高。
氢键吸附利用了材料分子上所带的可以与内毒素形成氢键作用的官能团,如-COOH、-OH等。氢键吸附是三种吸附中作用力最弱的,但如果在-NH2的β 位上存在-OH,此时的氢键作用可大大强化-NH2的静电吸附作用,这是因为β 位形成的氢键在分子构型中可与内毒素分子形成稳定的八元环[3]。
疏水吸附利用的是材料分子上有疏水作用的官能团,基于了内毒素分子具有亲水、疏水的双相性。疏水作用在三种吸附作用中的作用力居中,但其吸附选择性要优于静电作用。
血液净化吸附内毒素材料通常都是通过大分子树脂等直接连接配基或者引入间隔臂连接配基。配基材料的选用是决定吸附材料性质最关键的因素,Mitzner 等将聚乙烯亚胺(PEI)固定于纤维素球载体,吸附内毒素效果明显[4];将纯化的血清白蛋白共价交联在聚甲基丙烯酸酯上,实验发现可通过静电作用吸附内毒素、TNF、IL-6 等[5];多粘菌素B是唯一有抗内毒素作用的抗生素[6],特异性强、吸附效率高,但其具有肾毒性和神经毒性,使用受到限制[7-8]。
应用氨基酸作为内毒素吸附材料的研究,方晖[9]等人曾采用球形纤维素连接多种氨基酸,从而研究了其不同的吸附效率,徐堃[10]、韦俊华[11]则研究了以PVDF 基膜连接不同氨基酸的内毒素吸附材料。
近年来用血液净化法治疗内毒素血症取得了一定的进展,在水溶液中很多吸附材料都可以达到相当高的吸附率(约为90%)[9-11],但是血浆中的吸附率以及材料的血液相容性、安全无毒性等都有待提高。
综合考虑以上因素,本课题选择了对人体安全无害的肝素连接苯丙氨酸制成吸附材料。该材料兼具了安全无毒性和良好的血液相容性,同时依据肝素的氢键吸附和苯丙氨酸的疏水吸附来保持较高的血浆中的内毒素吸附率。
1 实验设计思路
本课题研究的内毒素吸附材料,是采用氨基化后的氯球作为基底材料,之后连接肝素作为连接臂,再连接苯丙氨酸,利用了肝素上-NH2的β 位羟基可形成分子内氢键以及苯丙氨酸的疏水性来进行内毒素吸附。
1.1 基底材料的选择
选用氯甲基树脂,俗称氯球(ps)是吸附剂常用的载体材料,特点是力学性能适宜、化学性质稳定、易吸附疏水性物质,其官能团氯甲基可作为偶联其他连接臂或者直接连接配基的活性基团,有利于进行树脂表面的改性。
1.2 连接臂的选择
肝素(heparin)是一种天然生物活性多糖类的化合物,具有抗凝血性,在体内体外都有抗凝血作用,同时生物相容性良好,这也是本课题采用肝素作为连接臂的主要考量之一。
肝素连接有较多化学活性官能团,利于与不同配基的连接。虽然在人体内生理环境下带负电荷,但具有可以形成氢键的官能团-COOH、-OH,此外正电性基团-NH2具有β 位羟基,会加强其静电吸附的作用,这些特性都增强了吸附内毒素的能力;而作为临床上常用的凝血剂,肝素可以减少材料对血液中蛋白的吸附,同时提高了对内毒素的特异性吸附。图1 为肝素的分子结构图。
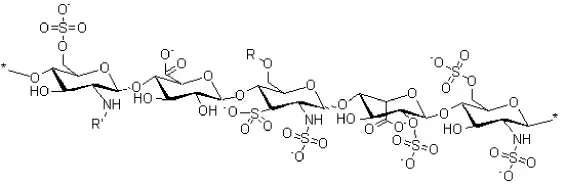
图1 肝素分子结构图Fig.1 The heparin molecular structure diagram
血液净化过程中,为避免凝血,管路都需进行肝素化涂层,而直接利用肝素作为吸附材料的组成之一,这也有利于透析过程中的抗凝血。
1.3 配基的选择
配基的选择,考虑到氨基酸对人体的安全性以及良好的血液相容性,以及此前有很多相关机理的研究,因此认为肝素分子臂连接氨基酸是较为适宜和有发展前景的一种吸附材料。20 种氨基酸中,因为静电吸附选择性不高且连接臂肝素为负电性会互相抵消吸附效果,所以没有选择正电性的碱性氨基酸;氢键吸附作用力弱,未选择含有两个-COOH的酸性氨基酸;从中性氨基酸中选择疏水性比较强的芳香族氨基酸——苯丙氨酸,其特点是非极性氨基酸,等电点为5.48。其他芳香族氨基酸有:酪氨酸属于极性氨基酸(无疏水性)且等电点(5.68)与苯丙氨酸接近;色氨酸虽然同样属于非极性氨基酸,等电点(5.89)也与苯丙氨酸接近,但是从立体构象上而言,对称性不强。图2 为苯丙氨酸和色氨酸的球棍模型图。
图3 为肝素分子连接苯丙氨酸的预想结构模型图。本研究希望达到的效果是:肝素含有大量重复基团氨基和羧基,苯丙氨酸通过羧氨缩合反应与肝素大分子链相连,其苯环垂直于肝素分子链,构成如右图所示的类似树干(图中涂黑底色外较深色分子,即肝素分子链)与树杈的结构。同时这种树型结构通过肝素与载体树脂的共价缩合而包裹在树脂球表面,吸附过程中在血浆中扰动进而通过疏水和氢键的双重作用吸附内毒素分子。这也是没有选择其他非芳香族疏水性氨基酸的原因。
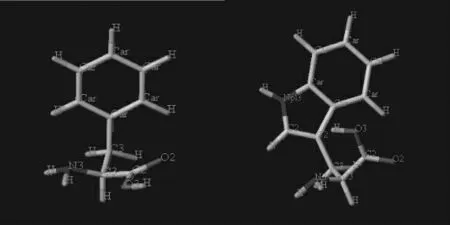
图2 苯丙氨酸(左)、色氨酸(右)球棍模型Fig. 2 Phenylalanine (left ),Tryptophan (right)stick model diagram
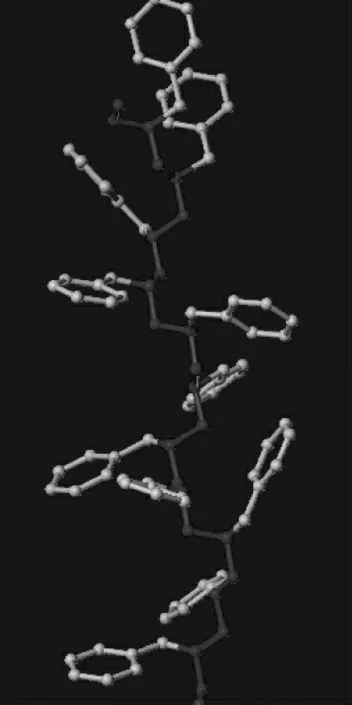
图3 肝素分子链连接苯丙氨酸预想模型Fig. 3 The expected model of heparin molecular chain connection phenylalanine
2 材料和方法
2.1 试剂和仪器
氯甲基树脂(天津南开合成科技有限公司,中国)、肝素钠(重庆百萃生物科技有限公司,中国)、L-苯丙氨酸(成都市科龙化工试剂厂,中国)、甲苯胺蓝(国药集团化学试剂有限公司,中国)、EDC(Sigma 公司,美国)、NHS(Sigma 公司,美国)、内毒素/显色基质鲎试剂盒(厦门鲎试剂实验厂有限公司,中国),所有试剂均为分析纯。傅里叶变换红外光谱仪(Spectrum GX,Perkin Elmer 公司,美国)、紫外-可见分光光度计(TU-1901,北京普析通用仪器设备有限责任公司,中国)、倒置荧光显微镜(IX71,OLYMPUS 公司,日本)、恒流泵(HL-2,上海青浦沪西仪器厂,中国)、血液细胞分析仪(BC-2000,深圳迈瑞生物医疗电子股份有限公司,中国)、全自动血液生化分析仪(BS-200,深圳迈瑞生物医疗电子股份有限公司,中国)。
2.2 氨基化氯球的制备
5 g 氯球(ps)在1,4-二氧六环溶液中溶胀2 h后转移至250 mL 三口烧瓶中;5.0 g NaOH、0.2 g 四丁基溴化铵溶于40 mL 蒸馏水加入反应体系;向反应体系中加入50 mL 乙二胺,反应混合物于85 ℃搅拌反应6 h,得到氨基化氯球(ps-NH2):
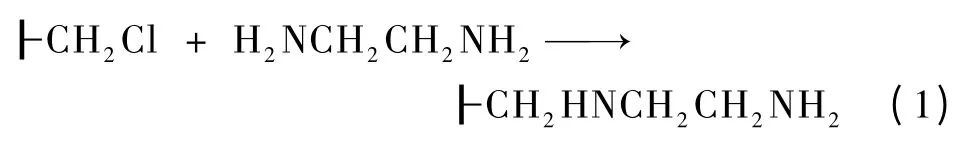
2.3 肝素化氯球的制备
用Na2HPO4和柠檬酸配制柠檬酸缓冲液,用NaOH 调节pH 至4.7(EDC 最佳活性条件),加入催化剂EDC 与NHS(摩尔比值为1∶1);配制一定浓度肝素柠檬酸缓冲液,0.5 g 的ps-NH2浸入肝素溶液中,37 ℃恒温振荡反应数小时,得到肝素化氯球(ps-hep)。
2.4 肝素-苯丙氨酸吸附材料的制备
图4 为EDC/NHS 催化羧氨缩合反应的机理[12]。EDC 通过与-COOH 反应形成O-酰基异硫脲中间体,然而,该中间体在水溶液中很不稳定,易于水解。O-酰基异硫脲中间体在NHS 存在的情况下,可以转变为-NH2反应活性的NHS-活性酯,这种NHS-活性酯中间体非常稳定,可以允许将缩合反应分解成两步进行。
在肝素连接苯丙氨酸的反应中,肝素和苯丙氨酸都存在-NH2与-COOH,-NH2是正电性基团,利用静电作用吸附内毒素,而-COOH是负电性基团,利用氢键吸附内毒素,而这两种吸附作用静电吸附作用力更强,因此希望苯丙氨酸尽量使用-COOH与肝素的-NH2反应,进而保留自身的-NH2。
所以这一步中催化剂的使用有所不同,具体步骤为:用Na2HPO4和柠檬酸配制柠檬酸缓冲液,用NaOH 调节pH,加入催化剂EDC 活化一定质量的苯丙氨酸0.5 h(目的是提高苯丙氨酸中-COOH的活化比例),再加入EDC/NHS(摩尔比值为1∶1)及含有2.5 g ps-hep 的柠檬酸缓冲液,37 ℃恒温振荡反应数小时,得到肝素-苯丙氨酸吸附材料(hep-Phe)。
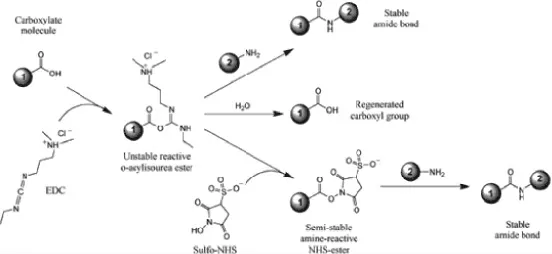
图4 EDC/NHS 催化酰胺反应原理Fig. 4 The mechanism of catalyzing acid amid condensation reaction by EDC/NHS
2.5 红外光谱法检测氨基化氯球
将制备好的ps-NH2真空干燥24 h 后,采用红外光谱法对其进行分析鉴定,观察氯球经乙二胺活化前后所发生的变化。
2.6 甲苯胺蓝法检测肝素固定量
试管中加入10 mg 的ps-NH2,5 mL 0.2% 的NaCl 溶液,1 mL 0.005% 的甲苯胺蓝溶液,混合均匀,于恒温振荡箱37 ℃反应2 h。取样品试管上层液体2 mL,加入分液漏斗中,然后各加入2 mL 正己烷,剧烈振荡,萃取一定时间后在紫外分光光度计631 nm 处测其吸光度,并比照标准曲线计算肝素固定量。通过改变肝素初始浓度和反应时长来寻找最佳反应条件。
2.7 紫外吸收法测定苯丙氨酸固定量
小心收集肝素连接苯丙氨酸反应后的洗脱液,因为肝素分子结构中不含苯环,所以对测定影响不大。故可于254 nm[13]下测定洗脱液的紫外吸收,利用差量法计算苯丙氨酸的固定量。
2.8 荧光显微镜观察材料对荧光内毒素(FITCLPS)的吸附
将0.2 g 的ps-NH2、ps-hep 以 及hep-Phe 在 含有50 μg/mL FITC-LPS 的兔子血浆溶液中分别进行了吸附实验,吸附反应时长为2 h,通过倒置荧光显微镜观察表面荧光强度来定性观察吸附情况。
2.9 鲎试剂盒测定内毒素的吸附
鲎试剂显色基质法用于内毒素的定量检测,基本原理为细菌内毒素与鲎试剂中C 因子进行酶促反应,产生凝固酶,其可将人工合成的显色基质分解为黄色的对硝基苯胺(PNA)和多肽。PNA 可进一步被偶氮试剂染成玫瑰色,在545 nm 下测量反应液中的吸光度值而进行内毒素定量。
吸附实验中,将0.5 g 的吸附材料填充入2 mL的注射器中,两头用脱脂棉塞住,连接恒流泵和烧杯自制成血液灌流装置进行血浆灌流动态实验。
利用鲎试剂盒检测hep-Phe 吸附材料分别与不同内毒素初始浓度的水溶液及兔子血浆溶液反应时长2 h 后的吸附量,确定内毒素初始浓度对吸附的影响。之后利用鲎试剂盒检测相同内毒素初始浓度下经过不同反应时长后兔子血浆溶液中内毒素的吸附量,绘制吸附曲线。
2.10 血液相容性实验
用一次性注射器自制血液灌流器,装入0.5 g hep-Phe 吸附剂,灌流前使用肝素钠生理盐水冲管3次,控制适当流速,进行离体血液灌流实验。吸附2 h 后,分别取20 μL 与2 mL 于血液细胞分析仪和常规全自动生化分析仪测定血细胞及血液生化指标变化。
3 结果
3.1 红外光谱法检测氨基化氯球
图5 为氯甲基树脂氨基化前后的的红外光谱。虚线表示氨基化反应之前,实线表示氨基化反应之后。图中可以看到:氨基化反应之前,苯环上C-H的伸缩振动峰、苯环骨架振动、苯环CH、CH2面内弯曲振动峰,以及氯甲基CH2Cl 的几个特征峰,即CH2面内弯曲振动峰,4 位被CH2Cl 取代1,4-二取代苯=C-H 面内弯曲振动峰(1 265 cm-1),以及C-Cl 伸缩振动峰。
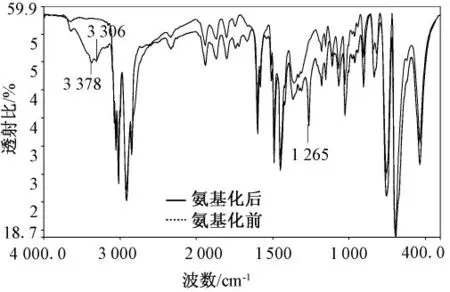
图5 ps 和ps-NH2 的红外检测图Fig.5 The FTIR Spectra of chloromethyl ps
氨基化反应之后,主要特征峰未出现明显变化,但3 300 ~3 377 cm-1之间则出现了氨基-NH2的伸缩振动峰,而1 265 cm-1处的峰则没有了,此峰表征了氯甲基强化的= C-H 的面内弯曲振动峰,说明乙二胺与苯环上的氯甲基发生了反应,将-NH2成功引入到了氯甲基树脂上。
3.2 连接肝素的最佳反应条件
图6 是肝素初始反应浓度对肝素固定量的影响。固定反应时间为24 h,浓度大于5 mg/mL时,其固定量基本达到饱和。
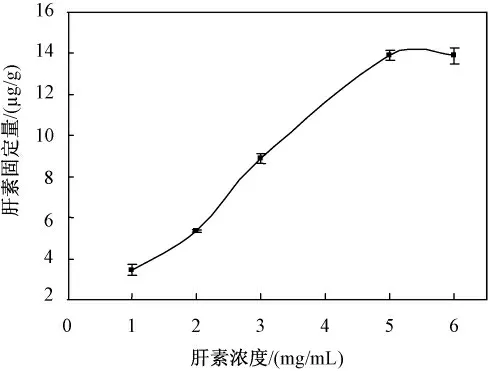
图6 肝素浓度对肝素固定量的影响Fig.6 The influence of the heparin concentration on the fixed amount of heparin
图7 是反应时间对肝素固定量的影响。选用5 mg/mL 的肝素与吸附剂反应不同时间的肝素含量进行测定。反应时间大于24 h 后其固定量基本达到稳定饱和。
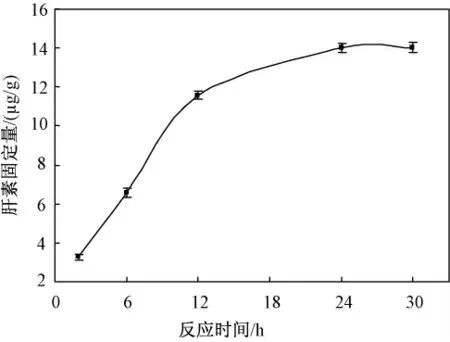
图7 反应时间对肝素固定量的影响Fig.7 The influence of the lasting time on the fixed amount of heparin
3.3 肝素连接苯丙氨酸的最佳反应条件
图8 是苯丙氨酸初始浓度对苯丙氨酸固定量的影响。pH 值保持4.7,反应时间控制在24 h。苯丙氨酸固定量在浓度大于5 mg/mL 时,处于较高且稳定的水平,基本达到饱和。
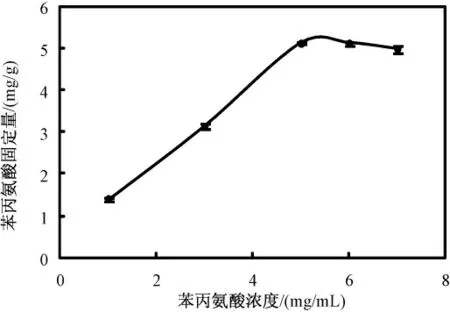
图8 苯丙氨酸初始浓度对固定量的影响Fig.8 The influence of the Phe concentration on the fixed amount of Phe
图9 是反应时间对苯丙氨酸固定量的影响。控制苯丙氨酸初始浓度为5 mg/mL,反应体系pH 值为4.7,当时长大于24 h 后固定量也基本不变,达到饱和。
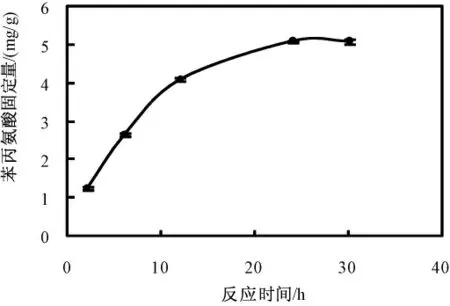
图9 反应时间对固定量的影响Fig.9 The influence of the lasting time on the fixed amount of Phe
图10 是体系pH 值对苯丙氨酸固定量的影响。苯丙氨酸初始浓度为5 mg/mL,反应时间为24 h,则体系最适pH 值应为4.7。
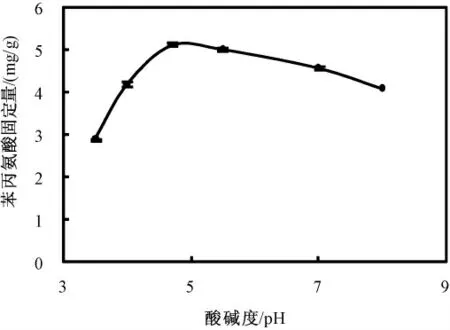
图10 pH 对固定量的影响Fig. 10 The influence of the pH on the fixed amount of Phe
3.4 荧光显微镜观察材料对荧光内毒素(FITCLPS)的吸附
图11 是兔子血浆溶液中吸附荧光标记内毒素的效果图。图中可以明显的看到,荧光内毒素均匀的包裹在吸附材料外层,且连接有苯丙氨酸的吸附材料效果也明显优于肝素化氯球和氨基化氯球的吸附。
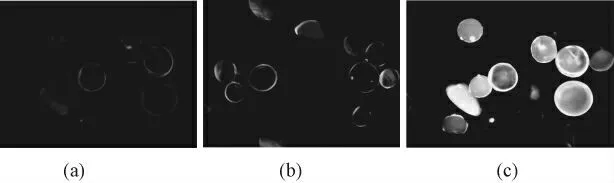
图11 兔子血浆溶液中吸附荧光标记内毒素效果ps-NH2(a),ps-hep(b),hep-Phe(c)Fig. 11 Adsorption FITC-LPS effect diagram in rabbit plasma solution:ps-NH2 (a ),ps-hep (b ),hep-Phe (c )
3.5 吸附性能定量实验-鲎试剂法检测材料去除内毒素效果
图12 和图13 是不同内毒素初始浓度下内毒素的吸附量和吸附率。图12 可以看出,反应2 h 后材料在水中和血浆中的吸附量随着内毒素初始浓度的增加而增加,但是图13 表明吸附率的变化并不大;在水中的吸附率保持在79%左右而在血浆中吸附率约为68%,最高可达到72%。
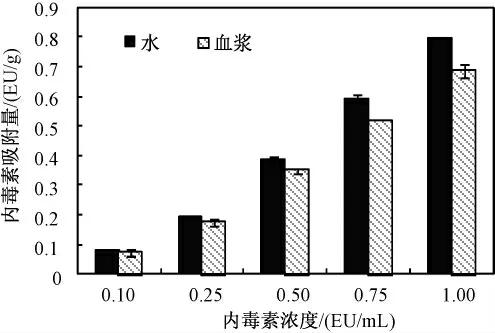
图12 内毒素初始浓度对吸附量的影响Fig.12 The influence of the initial concentration of the LPS adsorption amount
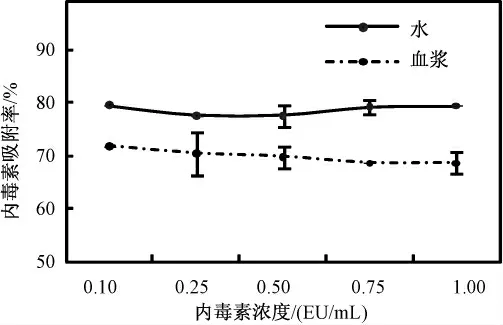
图13 内毒素初始浓度对吸附率的影响Fig.13 The influence of the initial concentration of the LPS adsorption rate
图14 为反应时间与内毒素吸附量的影响。是内毒素初始浓度为0.5 EU/mL,吸附时间2 h 之内的血浆溶液内毒素吸附量曲线图:由图14 中可以看出,吸附材料在0.5 h 处就已达到最大吸附量的90%以上的吸附率,并且在1 h 左右达到了吸附平衡。
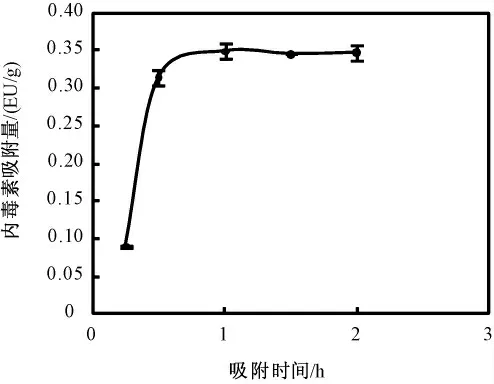
图14 血浆中吸附时间对内毒素吸附量的影响Fig. 14 The influence of the lasting time on LPS adsorption amount
3.6 血液相容性实验
表1 为经体外模拟灌流后血液成分的变化。灌流2 h 后,血液成分变化不大,血细胞相对变化率都在5%以下,血浆蛋白的相对变化率则在10%以下,即血浆蛋白能够有90%以上的回收率,其中血小板前后变化率在5%以下,在临床可接受范围内。
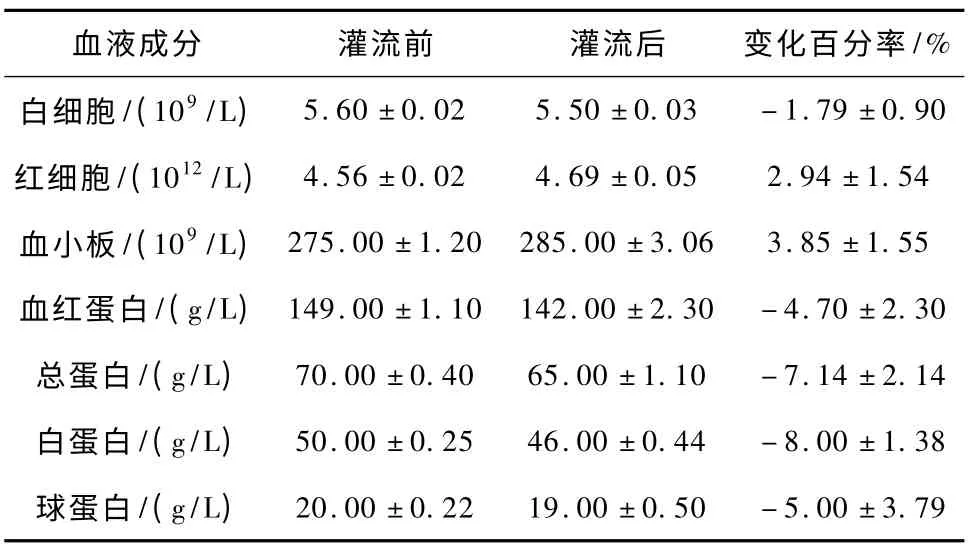
表1 灌流材料对血液成分的影响Tab.1 The material affect on the blood component
4 讨论和结论
材料的合成分为三部分:
第一步将基底材料氯球氨基化,合成氨基化氯球ps-NH2,合成结果利用红外检测;
第二步利用EDC/NHS 作为催化剂进行羧氨缩合反应,将肝素连接到ps-NH2上合成肝素化氯球ps-hep,经甲苯胺蓝法检测结果为:选用5 mg/mL 作为肝素反应初始浓度,并且最适反应时间控制在24 h,可以达到肝素分子在材料表面的最佳固定量,从而使肝素分子尽可能发挥其结构的空间效应及生物活性,从而改善材料的生物相容性,为进一步固定氨基酸减少更多的空间位阻;
第三步仍然利用EDC/NHS 作为催化剂进行羧氨缩合反应,考虑到其催化机理,先用EDC 活化反应过程中提供-COOH 的苯丙氨酸,之后再加入EDC/NHS 与ps-hep,得到肝素连接苯丙氨酸吸附材料hep-Phe。利用紫外吸收法检测结果为:苯丙氨酸连接内毒素的实验条件选择为苯丙氨酸初始浓度5 mg/mL,反应时长24 h,体系pH 值4.7 可以达到最大固定量。推测此pH 值是由于——反应催化剂EDC 的最适反应条件为4.7 ~6.0,而苯丙氨酸等电点为5.48,在低于等电点的pH 溶液中,苯丙氨酸发生碱式解离,其自身-COOH 更易发生羧氨缩合形成酰胺。
通过hep-Phe 对FITC-LPS 的吸附结果可以定性的得出结论:荧光内毒素均匀的包裹在吸附材料外层,且连接有苯丙氨酸的吸附材料效果也明显优于肝素化氯球和氨基化氯球的吸附,说明苯丙氨酸作为配基的引入可以大大提高肝素对内毒素的吸附效果。
通过自制灌流器对兔子血浆的吸附,材料在水中和血浆中的吸附量随着内毒素初始浓度的增加而增加,但是吸附率变化并不大;在水中的吸附率保持在79%左右,而在血浆中吸附率约为68%,最高可达到72%。这是因为血浆中存在的血浆蛋白与内毒素在材料表面存在的吸附竞争关系。对于内毒素的吸附效应,因为血浆蛋白与内毒素都带有大量负电荷,故疏水吸附比静电吸附对于内毒素的选择性要更强一些。相比其他研究中的一些吸附材料[9-11],虽然在水中的吸附率没有达到90%的较高水准,但在血浆中吸附率达到了72%,相比水中吸附率78% 下降较少,对内毒素的吸附选择性更优异。
临床上要求血浆与吸附材料的接触时间介于2~6 h 之内,因而血液净化材料能否在短时间内达到吸附平衡至关重要,而通过不同吸附时间下测得的吸附量实验数据可以看出吸附材料在0.5 h 处就已达到最大吸附量的90%以上的吸附率,并且在1 h 左右达到了吸附平衡,具有一定的临床使用价值。
理想的血液灌流吸附剂除了要有较高的吸附量外,还需要具有吸附特异性及良好的生物相容性,要达到特异选择吸附致病物质,同时对其他血液成分的非特异吸附较少的效果。
本课题所选用的基底材料氯甲基树脂是常用的载体材料,血液相容性比较理想,而连接臂肝素为临床用血液抗凝剂,所用配基氨基酸是存在于人体的组成蛋白质的基本分子。理论上而言相容性良好,为了验证该结论,进行了血液相容性试验,得出结论材料对血液成分的影响较小,在可接受范围之内,在目前研究中的各种内毒素吸附材料中结果比较理想。
本课题选用氯甲基树脂作为基底材料,肝素作为分子壁,苯丙氨酸作为配基,对水和兔子血浆分别进行了体外模拟血液灌流实验吸附内毒素,在水中的吸附率保持在79%左右,在血浆中吸附率约为68%,最高可达到72%。同时对材料的血液相容性进行了测定,血液成分变化不大,血细胞相对变化率都在5%以下,血浆蛋白的相对变化率则在10%以下,即血浆蛋白能够有90% 以上的回收率,其中血小板前后变化率在5% 以下,在临床可接受范围内。
材料的吸附效率和血液相容性都较好,有一定的临床应用前景。
[1] Panaqiotou A,Gaiao S,Ctuz DN. Extracorporeal therapies in sepsis[J]. J Intensive Care Med,2011,10(25):172 -174.
[2] 俞玫,王慧彦,刘涛. 血液灌流用内毒素吸附材料研究[J].高等学校化学学报,2004,25(8):1465 -1467.
[3] 李纪红,俞玫,王慧彦. 计算机模拟内毒素吸附剂吸附机理的研究[J]. 高等学校化学学报,2006,27(6):1066 -1069.
[4] Mitzner S, Schneidewind J, Falhenhagen D, et al.Extracorporeal endotoxin removal by immobilized polyethyleneimine[J]. Artif Organs,1993,17:775 -781.
[5] 刘莎,刘文虎. 血液灌流技术应用与进展[J]. 中国血液净化,2008,11(7):618 -621.
[6] Dinna NC,Mark AP,Rinaldo B, et al. Effectiveness of polymyxin B immobilized fiber column in sepsis:A systematic review[J]. Critical Care,2007,11(2):1 -12.
[7] 田爽,李涛. 用血液灌流治疗内毒素血症的研究进展[J]. 国际生物医学工程学杂志,2009,32(1):50 -54.
[8] Suzuki H,Shoji H. Application of polymyxin B convalently immobilized fiber in patients with septic shock[J]. Acute Blood Purification,2010,166(10):150 -157.
[9] 方晖,魏佼,俞耀庭. 亲和吸附剂对细菌内毒素吸附性能的研究[J].高等学校化学学报,2004,25(6):1056 -1059.
[10] 徐堃. 聚偏氟乙烯接枝氨基酸亲和膜及其内毒素脱除研究[D]. 杭州:浙江大学,2010.
[11] 韦俊华. 内毒素特异性吸附膜的开发及实验性能研究[D].杭州:浙江大学,2008.
[12] Marijn ED. Thermo scientific product manual:NHS and sulfo-NHS [OL]. http://www. qcbio. com/pierce/24510. htm.,2009-09-24/2013-03-28
[13] 国家药典委员会. 中华人民共和国药典[M]. 2010 年版,2部,北京:中国医药科技出版社,2010:附录99 -102.
