以乙肝病毒核衣壳为靶标的二氢嘧啶类化合物及其作用机制研究进展
2013-03-08杨秀岩赵国明
杨秀岩,赵国明 ,李 松
(1. 沈阳药科大学 制药工程学院,辽宁 沈阳110016;2. 军事医学科学院 毒物药物研究所,北京100850)
乙型肝炎是乙肝病毒(hepatitis B virus,HBV)引起的、以肝脏炎性病变为主的一种传染性疾病。据世界卫生组织统计,全球有20 亿人曾感染过HBV,其中约4 亿发展成为慢性乙型肝炎,而中国约占三分之一[1]。目前,治疗慢性乙型肝炎的化学药物主要有核苷类逆转录酶抑制剂如恩替卡韦、替比夫定等,但其长期应用易引起病毒耐药问题,使慢性乙肝的治疗仍面临着巨大的挑战[2]。核衣壳在HBV 的感染复制过程中与前基因组pgRNA 的包装、包膜蛋白的识别密切相关,已逐渐成为开发新型抗HBV 药物的新靶标。二氢嘧啶类化合物(HAPs)是目前发现的唯一一类通过直接作用于核衣壳来达到抑制HBV 复制目的的全新结构类型的化合物[3],研究其结构特点和作用机制将有助于快速寻找高效低毒的抗HBV 药物。
1 核衣壳在HBV 复制感染过程中的重要作用
乙肝病毒是一种双链DNA 病毒,属嗜肝DNA 病毒科(Hepadnavividae),完整的乙肝病毒颗粒包括外膜、核衣壳和病毒DNA 三个部分,其中核衣壳由核心蛋白构成,呈二十面体对称结构。核心蛋白存在A、B、C、D 四个同源亚基,主要包括两个结构域:一个由AA1 ~149 组成的装配结构域和无结构的调节序列结构域[5-6]。
在HBV 复制感染过程中,核心蛋白首先由前基因组pgRNA 在宿主细胞质中独立编码合成,随后在P 区编码的聚合酶作用下,与前基因组pgRNA 相互作用,自发地装配形成未成熟的核衣壳[7-11];在核衣壳内,pgRNA 继续完成子代的部分双链环状DNA 的逆转录合成。核衣壳最后通过脱磷酸化、构象变化等修饰成熟后,与包膜蛋白相互作用形成包膜,成熟的病毒颗粒随之分泌到细胞外继续感染其他宿主细胞[12-15]。由此可见,核衣壳在HBV 复制感染过程中有着重要的作用,参与了RNA 的包装及包膜蛋白的识别过程,并提供了子代DNA 的合成场所。
2 作用于HBV 核衣壳的HAPs 类化合物研究现状
基于核衣壳在病毒复制中起到的作用,近来核衣壳已成为开发全新结构HBV 抑制剂的重要靶标。目前与核衣壳形成相关的活性小分子化合物主要有:King 等报道的芳基丙烯酰胺类化合物如AT-61 和AT-130(图1),其通过阻止前基因组pgRNA 进入核衣壳影响核衣壳的正常形成[16];Asif-Ullah 等报道的三唑并嘧啶类化合物如KSG00011 和KKJ00626(图1),可通过抑制乙肝病毒表面蛋白的PreS 部分和核心蛋白之间的相互作用从而抑制乙肝病毒颗粒的生成和分泌[17]。这两类化合物都是通过阻断与核衣壳形成相关的过程来发挥其抗HBV 作用,但并非直接作用于核衣壳。
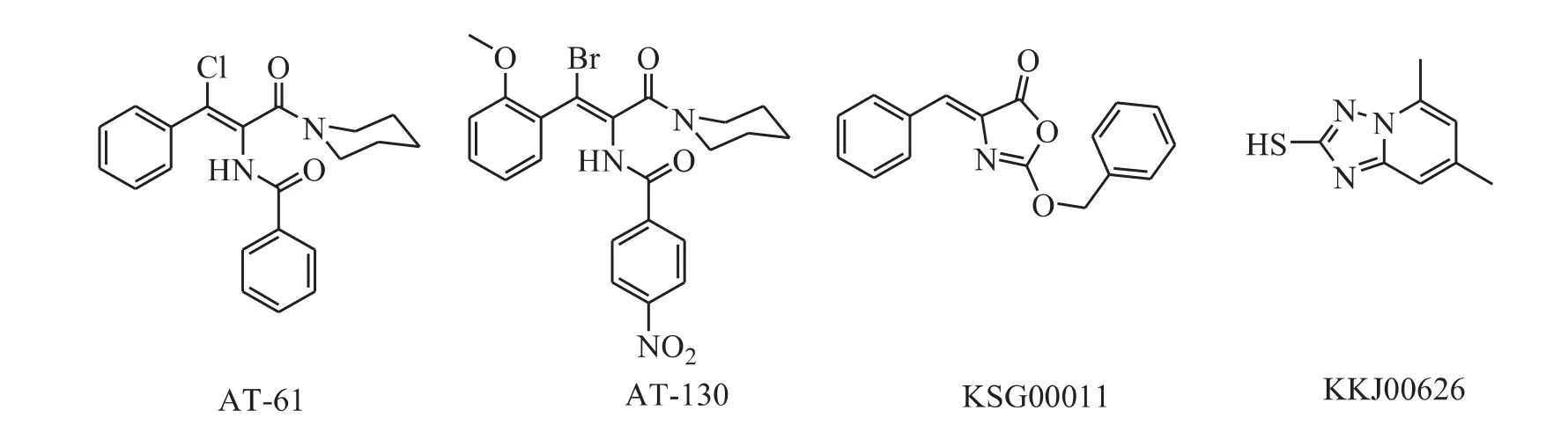
Figure 1 Structures of HBV inhibitors
真正通过直接作用于病毒核衣壳、误导其装配达到抑制HBV 感染目的的化合物是2003 年由Deres 等首次报道的芳杂环取代的二氢嘧啶类(HAPs)化合物[3](图2,1)。该类化合物也是目前唯一一类明确作用于核衣壳的抗HBV 化合物,代表化合物有HAP1、Bay41-4109、Bay39-5493(图2)。其中,Bay41-4109 抑制HBV DNA 复制的半数有效浓度(IC50)为53 nmol·L-1;抑制细胞增殖的半数毒性剂量(TC50)为5.06 μmol·L-1,使细胞发生病变的半数有效浓度(CC50)为7 mmol·L-1;使用1 μmol·L-1Bay41-4109 处理HepG2.2.15 细胞后,胞质中HBcAg 水平下降但胞核中HBcAg 水平上升、cccDNA 水平下降。转基因小鼠肝组织点杂交实验表明,Bay41-4109 比拉米夫定在肝组织上减少HBV DNA 更有效,而且以15 mg·kg-1和30 mg·kg-1两个浓度作用在细胞质和肝器官均有极显著的抗病毒活性,而拉米夫定作用在细胞质上没差异[18]。另外,体外实验还发现,Bay41-4109 能够有效地抑制一些对拉米夫定和阿德福韦耐药的HBV 毒株[19]。在临床前研究中,Bay41-4109 和Bay39-5493 表现出了良好的药代动力学性质。
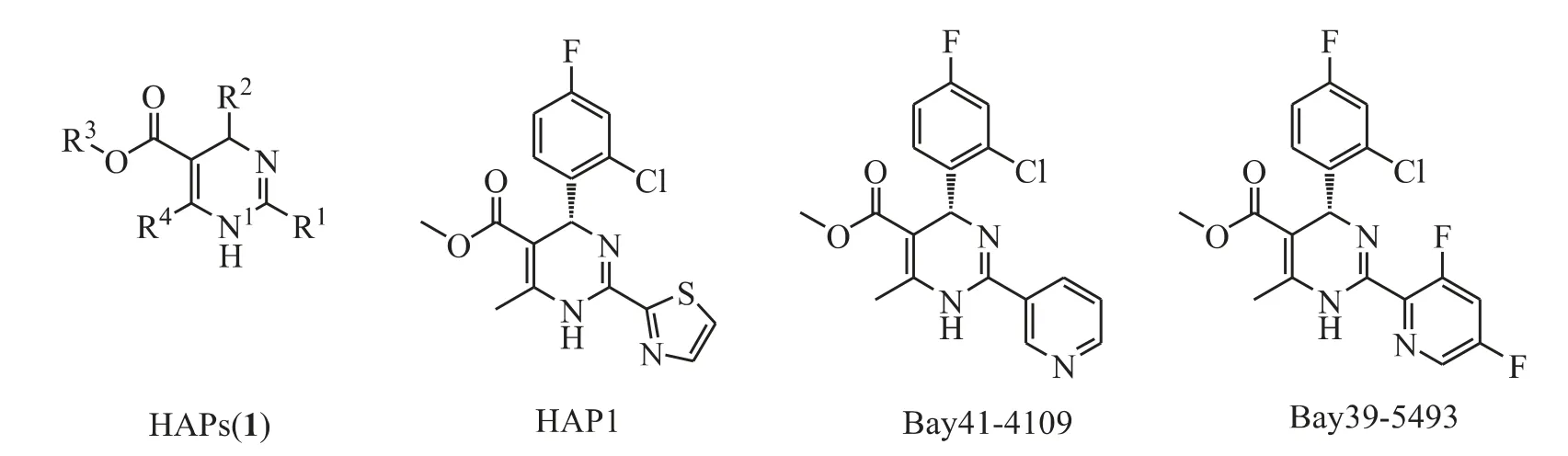
Figure 2 Structures of HAPs
HAPs 类化合物具有以下的构效关系:该类结构存在一个手性中心,仅R型异构体有活性;N1 上的氢原子对于保持化合物的抗病毒活性是必要的;R2为含氮的芳香杂环活性较好,为苯环时则活性完全丧失;当R3为2-氯-4-氟苯基时活性最强,说明苯环的对位可能需要一个强的氢键受体;R4的羧酸甲酯或乙酯结构对该类化合物的活性是必需的;R5通常为甲基,但允许其他基团,这些基团的引入并不能显著提高化合物的抗病毒活性,但有望改变它的物理化学性质进而改善其生物利用度。为进一步寻找新的高效低毒的抗HBV 化合物,本课题组对2-芳杂环取代基进行了结构的修饰和优化,设计合成了一系列新型的二氢嘧啶类化合物(图3,2),并对其体外抗HBV 病毒活性进行评价,获得了多个活性较好的具有自主知识产权的新化合物[20],其中化合物3(图3)的活性最好,其IC50值为0.44 μmol·L-1[21]。鉴于HAPs 类化合物特殊的作用机制,及其体内外活性评价中表现出的高效低毒的性质[22],该类化合物有希望成为新型的乙型肝炎治疗药物。

Figure 3 New derivatives of HAPs
3 HAPs 类化合物的作用机制
3.1 HAPs 类化合物的结合位点假说
在HBV 复制感染过程中,核心蛋白亚基之间通过48、61、107、183 位半胱氨酸以二硫键的方式形成二聚体,二聚体积累到一定浓度之后自我装配成核衣壳。研究发现,HAPs 类化合物可能是通过作用于二聚体连接处抑制核衣壳正常形成的,其具体的作用位点目前存在3 种假说:第一种假说认为HAPs 的结合位点位于二聚体连接内表面的组氨酸位点附近[3];第二种假说认为HAPs的结合位点位于二聚体连接的外表面[23];第三种假说是Zlotnick 等提出的,认为HAPs 的结合位点是在二聚体连接处由Trp10、Phe23、Pro25 和Leu140 等组成的疏水腔内[24],该疏水口袋的形状不是平面的,存在轻微的曲率,可与HAPs 类化合物的结构形状互补,一系列研究证实HBV 衣壳蛋白与溴代的HAPs 类似物的复合物就在相同的位置[25-28]。
3.2 HAPs 类化合物对核衣壳结构及性质的影响
基于第三种假说的研究发现,HAPs 类化合物与核衣壳结合后不影响核心蛋白的翻译与合成,对核心蛋白亚基的结构并不会造成影响,这一点可通过分子模型对子单元结构的重叠评估得以证实[25]。在该模型中,核心蛋白的四个同源亚基(A、B、C、D)中α 螺旋有无HAPs 结合的RMS 差异为1.0 ~1.7 Å,与游离的核心蛋白的各个亚基的RMS 差异范围类似,且二十面体中的不对称单元(AB +CD)中每个核心蛋白亚基的RMS 差异为1 Å,也无明显变化[24]。
HAPs 类化合物与核衣壳结合后真正影响的是AB +CD 二聚体单元(衣壳二十面体的不对称单元)的整体排列(图4,A),由此引起核衣壳总体结构的变化最终导致其整体性质的变化(图4,B)。HAPs 与核衣壳结合后可使AB 二聚体向衣壳蛋白表面外绕轴旋转,使B 链的第132 位氨基酸残基处发生扭曲,使A 链α 螺旋132 氨基酸残基处径向运动3.4 Å,A 链的移动导致五面体顶点(I)处的A 链缺失10%的表面积,从而使衣壳蛋白五面体顶点处结构突出。为了维持整体的相同偏移位置,二十面体结构单元同时以CD 二聚体为中心进行协调移动:D 链的向面内径向运动2 ~2.4 Å、C 链的向面外径向偏移1.6 ~2 Å,导致了六面体顶点处的C 链与D 链交界面25%表面积的掩埋,从而使六面体顶点(II)处结构更为平伏;CD 二聚体以两个长α 螺旋形成的二聚体界面为轴向衣壳蛋白表面旋转,使其交界处三面体失去25%的覆盖表面,导致了三面体顶点(III)更为开放。同时,二十面体结构单元的协调移动使CD 二聚体以两个长α 螺旋形成的二聚体界面为轴向衣壳蛋白表面旋转以维持整体的同时偏移,这使D 链向面内运动2 ~2.4 Å,C 链向面外运动1.6 ~2 Å。综上所述,HAPs 类化合物使核衣壳五面体顶点处结构的突出、六面体顶点处结构的平伏以及三面体顶点的开放,最终导致衣壳表面的平面性发生了变化。研究还发现,HAPs类化合物可通过作用于二聚体交界面以四个螺旋束为中心柔性的C 末端,稳定衣壳中的二聚体结构,提高其装配动力学水平,促进其错误装配。
以上的变化可通过核衣壳平均密度图(图5)子单元结构的重叠评估得以证实[24],HAPs 的存在使衣壳外部由AB 二聚体形成的五面体顶点处结构密度明显增大,且HAPs 使CD 二聚体不再呈现放射状,其六面体顶点处的结构密度较为松散。这不仅能够引起已形成的正常核衣壳构象变化,使其不能稳定存在;而且能够促进形成“膨胀”的不稳定的衣壳结构,并致使新的稳态多聚体的形成[27]。
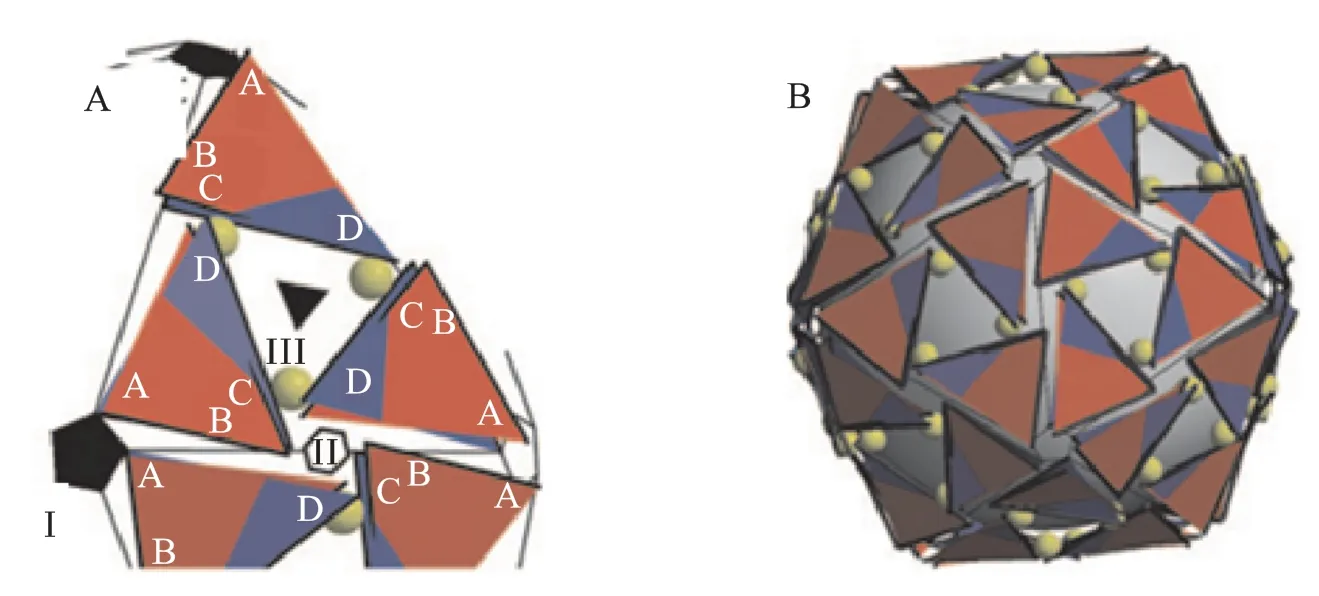
Figure 4 Blue,-HAPs;red,+HAPs;a yellow sphere at each C chain indicates the putative HAPs site
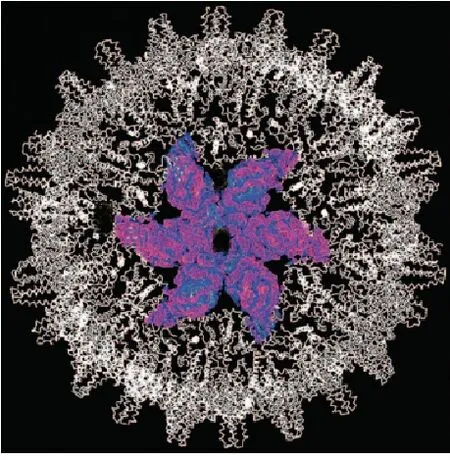
Figure 5 Structural effects of HAPs are visible in the electron denties of the capsid structures
3.3 化合物浓度对核衣壳形成的影响
研究发现,HAPs 类化合物浓度的不同对二聚体的含量和核衣壳的形成产生的影响是不同的。在低浓度下即HAPs 与二聚体的浓度之比小于1∶2 时,二聚体含量减少,正常核衣壳结构减少,错误装配的核衣壳含量增多,大部分表现为扩大、较为松散、甚至不封闭的空心衣壳结构;当HAPs 的量增多即HAPs 与二聚体达到1∶2 时,二聚体消失,核衣壳错误组装成不规则的管状聚集结构;当加入高浓度的化合物,即HAPs 与二聚体达到最大值1∶1 时,衣壳结构基本解聚,只有少数解聚衣壳残体,聚集成团的不规则卷曲结构增多且体积增大[28-31]。由此可见,HAPs 类化合物的存在,无论其浓度大小,都会影响核衣壳的正常形成,这种现象与HAPs 的作用机制是一致的。
核衣壳是HBV 子代DNA 的合成场所,并参与RNA 的包装及包膜蛋白的识别过程,在HBV复制感染中起到了重要作用。以核衣壳为靶点的HAPs 类化合物结构特点及特殊机制的研究,在分子水平上阐述了其变构激活及其误导HBV 衣壳装配的作用机制,开辟了抗HBV 药物研究的新领域、新思路,将有助于快速寻找高效低毒的HBV 药物,为征服慢性乙型肝炎带来新的希望。
[1] LIN K W,KIREHNER J T.Hepatitis B[J].Am Fam Physician,2004,69(1):75 -82.
[2] KIM K H,KIM N D,SEONG B L. Discovery and development of anti-HBV agents and their resistance[J].Molecules,2010,15(9):5878 -5908.
[3] DERES K,SCHRODER C H,PAESSENS A,et al.Inhibition of hepatitis B virus replication by drug-induced depletion of nucleocapsids[J].Science,2003,299(5608):893 -896.
[4] MENG D,HJELM R P,HU J,et al. A theoretical model for the dynamic structure of hepatitis B nucleocapsid[J].Biophys J,2011,101(10):2476 -2484.
[5] SEEGER C,MASOM W S.Hepatitis B virus biology[J].Microbiol Mol Biol Rev,2000,64(1):51 -68.
[6] BELNAP D M,WATTS N R,CONWAY J F.Diversity of core antigen epitopes of hepatitis B virus[J].Proc Natl Acad Sci USA,2003,100(19):10884 -10889.
[7] CHEN H,LIU S P,CHEN L,et al. Expression of HBcAg mutant with long internal deletion inSaccharomyces cerevisiaeand obvervation of its self-assembly particles by atomic force microscopy (AFM)[J].Inter J Bio Macrom,2005,37(5):239 -248.
[8] CHEN H,LU J H,LIANG W Q,et al.Purification of the recombinant hepatitis B virus core antigen(rHBcAg)produced in the yeastSaccharomyces cerevisi-ae and comparative observation of its particles by transmission electron microscopy(TEM)and atomic force microscopy(AFM)[J].Micron,2004,35(5):311 -318.
[9] KOSECHEL M,OED D,GEREL SAIKHAN T,et al.Hepatitis B virus core gene mutations which block nucleocapsid envelopment[J].J Virol,2000,74(1):1 -7.
[10] TAN Z,MAGUIRE M L,LOEB D D,et al.Genetically altering the thermodynamics and kinetics of hepatitis B virus capsid assembly has profound effects on virus replication in cell culture[J]. J Virol,2013,87(6):3208 -3216.
[11] BTTECHER B,VOGEL M,PLOSS M,et al. High plasticity of the hepatitis B virus capsid revealed by conformational stress[J].J Mol Biol,2006,356(3):812 -822.
[12] JALALI M V,ALAVIAN S M. Hepatitis B e antigen-negative chronic hepatitis B [J]. Hepatitis Monthly,2006,6(1):31 -35.
[13] WANG J C,DHASON M S,ZLOTNICK A. Structural organization of pregenomic RNA and the carboxy-terminal domain of the capsid protein of Hepatitis B virus[J/OL].PLoS Pathog,2012,8(9):e1002919.
[14] LOCARNINI S,ZOULIM F. Molecular genetics of HBV infection[J].Antivir Ther,2010,15(3):3-14.
[15] SCHÄDLER S,HILDT E.HBV life cycle:entry and morphogenesis[J].Viruses,2009,1(2):185 -209.
[16] ONG T T,WANG R Q,MUDERAWAN I W,et al.Synthesis and application of mono-6-(3-methylimidazolium)- 6-deoxyperphe-nylcarbamoyl-β-cyclodextrin chloride as chiral stationary phases for high-performance liquid chromatography and supercritical fluid chromatography[J]. J Chromatogr A,2008,1182(1):136 -140.
[17] YU Y G,ASIF-ULLAH M,CHOI K J,et al.Klentification of compounds that inhibit the interaction between core and surface protein of hepatitis B virus[J].Antiviral Res,2006,70(2):85 -90.
[18] 潘孝本,韩进超,魏来. 乙型肝炎病毒核心蛋白在HepG2.2.15 细胞中的亚细胞定位及转移[J]. 中华肝脏病杂志,2008,16(1):29 -32.
[19] BILLIOUD G,PICHOUD C,PUERSTINGER G,et al.The main hepatitis B virus(HBV)mutants resistant to nucleoside analogs are susceptiblein vitroto non-nucleoside inhibitors of HBV replication[J].Antiviral Res,2011,92(2):271 -276.
[20] 军事医学科学院毒物药物研究所. 二氢吡啶类化合物及其用于治疗和/或预防病毒性疾病药物的用途:中国,200910148629.X[P].2009 -11 -11.
[21] ZHU X J,ZHAO G M,ZHOU X P.2,4-Diaryl-4,6,7,8-tetrahyroquinazolin-5 (1H)-one derivatives as anti-HBV agents targeting at capsid assembly[J].Bioorg Med Chem Lett,2010,20(1):299 -301.
[22] BREZILLON N,BRUNELLE M N,MASSINET H.Antiviral activity of Bay 41-4109 on hepatitis B virus in humanized Alb-uPA/SCID mice[J/OL]. PLoS One,2011,6(12):e25096.
[23] HACKER H,DERES K,MILDENBERGER M,et al.Antivirals interacting with hepatitis B virus core protein and core mutations may misdirect capsid assembly in a similar fashion[J].Biochem Pharmacol,2003,66(12):2273 -2279.
[24] BOURNE C R,FINN M G,ZLOTNICK A. Global structural changes in hepatitis B virus capsids induced by the assembly effector HAP[J]. J Virol,2006,80(22):11055 -11061.
[25] LI L,CHIRAPU S R,FINN M G,et al. Phase diagrams map the properties of antiviral agents directed against hepatitis B virus core assembly[J]. Antimicrob Agents Chemother,2013,57(3):1505 -1508.
[26] PACKIANATHAN C,KATEN S P,DANN C E 3rd,et al.Conformational changes in the hepatitis B virus core protein are consistent with a role for allostery in virus assembly[J]. J Virol,2010,84(3):1607 -1615.
[27] STRAY S J,ZLOTNICK A.BAY 41-4109 has multiple effects on hepatitis B virus capsid assembly[J].J Mol Recognit,2006,19(6):542 -548.
[28] ZLOTNICK A,CERES P,SINGH S,et al. A small molecule inhibits and misdirects assembly of hepatitis B virus capsids[J].J Virol,2002,76:4848 -4854.
[29] KATEN S P,CHIRAPU S R,FINN M G,et al. Trapping of hepatitis B virus capsid assembly intermediates by phenylpropenamide assembly accelerators[J]. ACS Chem Biol,2010,5(12):1125-1136.
[30] TAN Z,MAGUIRE M L,LOEB D D,et al.Genetically altering the thermodynamics and kinetics of hepatitis B virus capsid assembly has profound effects on virus replication in cell culture[J]. J Virol,2013,87(6):3208 -3216.
[31] BOURNE C,LEE S,VENKATAIAH B,et al.Smallmolecule effectors of hepatitis B virus capsid assembly give insight into virus life cycle[J]. J Virol,2008,82(20):10262 -10270.