β-榄香烯取代哌嗪酰胺类衍生物的合成及抗肿瘤活性研究
2013-03-08王敬敬张美慧夏明钰徐莉英董金华
王敬敬,张美慧,夏明钰,徐莉英* ,董金华*
(1. 沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室,辽宁 沈阳110016;2. 沈阳药科大学 药学院,辽宁 沈阳110016)
广谱抗肿瘤药物榄香烯乳的主要成分为β-榄香烯。为改善β-榄香烯的水溶性并提高抗癌活性,本课题组设计在β-榄香烯分子骨架上引入含氧、含氮的极性基团,合成了近300 个β-榄香烯衍生物,并从细胞水平、动物整体实验以及分子水平上探索了它们的抗癌作用和免疫增强作用[1-9]。体外抗癌活性试验结果表明,其中β-榄香烯取代哌嗪衍生物DX-1、DX-2 体外对白血病K562、HL60、宫颈癌HeLa、胃癌SGC-7901、前列腺癌PC3、LNCap 等细胞株的IC50值比β-榄香烯的IC50值低1 ~2 个数量级(IC50值约为1 ~10 μmol·L-1)[8];无明显骨髓抑制作用(对正常骨髓细胞的抑制率低于肿瘤细胞5 倍),且对化疗药物耐受的乳腺癌MCF-7/Adr 细胞株具有同样的敏感性。体内抗癌活性试验结果表明DX-1、DX-2 在SPF 级BALB/C 裸鼠、昆明种小鼠、C57BL/6 小鼠及ICR 小鼠体内可显著抑制移植性Lewis 肺癌LL/2、肝癌H22、骨肉瘤S180肿瘤在小鼠体内的原位生长,抑制活性高于或相当于先导化合物β-榄香烯。抗癌机制研究表明:DX-1可以抑制HL-60 和HeLa 细胞生长并诱导细胞凋亡,主要以下调c-FLIP(FLICE-like inhibitory protein)蛋白的水平并且诱导活性氧的产生,进而激活caspase-8 来激活外源性途径诱导HL-60 细胞发生凋亡。此外,β-榄香烯取代哌嗪衍生物还可抑制AKT(下调p-mTOR)和mTOR(下调p-P70S6K)的活性,很可能是一类新的mTOR 抑制剂,但在体内试验中发现它们的毒性相对较大。因此在本文的工作中采用成酰胺的修饰方法,在β-榄香烯取代哌嗪类衍生物DX-1、DX-2 的哌嗪基4 位氮上引入取代苯甲酰基或取代苯丙烯酰基,希望在减小毒性的同时提高抗癌活性。
1 合成路线
按文献[4]的方法以β-榄香烯(1)为起始原料,经烯丙位的氯代反应,合成β-榄香烯氯代物(2,3),再通过亲核取代反应在β-榄香烯母体上引入取代哌嗪基,经柱色谱分离得DX-1、DX-2,然后再与取代苯甲酰氯或苯丙烯酰氯进行酰化反应,制得β-榄香烯取代哌嗪酰胺类衍生物4a ~4o和5a ~5h。合成路线见图1。

Figure 1 The synthetic route to β-elemene derivatives
2 合成实验
核磁共振氢谱用Bruker ARX -300 核磁共振仪测定(TMS 为内标);质谱用美国Waters 公司Alliance QuattromicroTM型液相色谱-串联四极杆质谱联用仪测定(电喷雾离子化源ESI);气相色谱用天美7890 气相色谱仪检测。柱色谱用硅胶(51 ~70 μm)、薄层色谱用硅胶GF254均由青岛海洋化工厂生产。其余试剂均为市售分析纯。
2.1 单氯代β-榄香烯(2、3)的制备
按文献[1]方法制备,得到β-榄香烯和β-榄香烯氯代物的混合物。经气相色谱检测14-氯-β-榄香烯(2)含量为14.8%,13-氯-β-榄香烯(3)含量为33.1%。未经分离用于下一步反应。
2.2 β-榄香烯哌嗪衍生物(DX-1、DX-2)的制备通法
将20 mmol 取代哌嗪溶于10 mL 无水乙醇,搅拌,加热回流条件下于0.5 h 内滴加β-榄香烯和单氯代β-榄香烯的混合物4.2 g(含化合物2、3约8 mmol),滴完后在此条件下继续反应6 h。浓缩,冷却至室温后有取代哌嗪盐酸盐结晶析出。混合物加入10 mL 无水乙醚,滤除取代哌嗪盐酸盐,并用无水乙醚洗涤(3 mL ×3),合并滤液及洗液,浓缩,残余物用硅胶柱色谱分离,先用石油醚洗脱,得β-榄香烯和未反应的单氯代β-榄香烯,再用乙酸乙酯洗脱得β-榄香烯取代哌嗪DX-1 或DX-2。
2.3 β-榄香烯取代哌嗪酰胺类衍生物(4a ~4o,5a ~5h)的制备通法
按文献[10]的方法,将取代苯甲酸或取代苯丙烯酸2 mmol 溶于4 mL 的二氯甲烷中,滴加2滴DMF、0.5 mL(5.2 mmol)草酰氯,待溶液变澄清,反应15 min。蒸出多余的草酰氯,加4 mL 干燥的二氯甲烷配制成0.5 mol·L-1的酰氯溶液。
将2 mmol DX-1 或DX-2 溶于4 mL 二氯甲烷,加三乙胺0.2 g(2 mmol),室温搅拌0.5 h,冷却反应体系至0 ~5 ℃。加0.5 mol·L-1的酰氯4 mL,由于不同酰氯的反应活性不同,反应时间为0.5 ~12 h。反应结束后,加入8 mL 饱和碳酸氢钠溶液,室温搅拌反应0.5 h,分离有机层,水洗有机层,无水硫酸钠干燥,蒸出溶剂,经硅胶柱色谱分离得淡黄色油状物。
共设计合成了23 个未见文献报道的β-榄香烯取代哌嗪酰胺类衍生物,其结构经核磁共振氢谱、质谱确证,理化及波谱数据见表1。
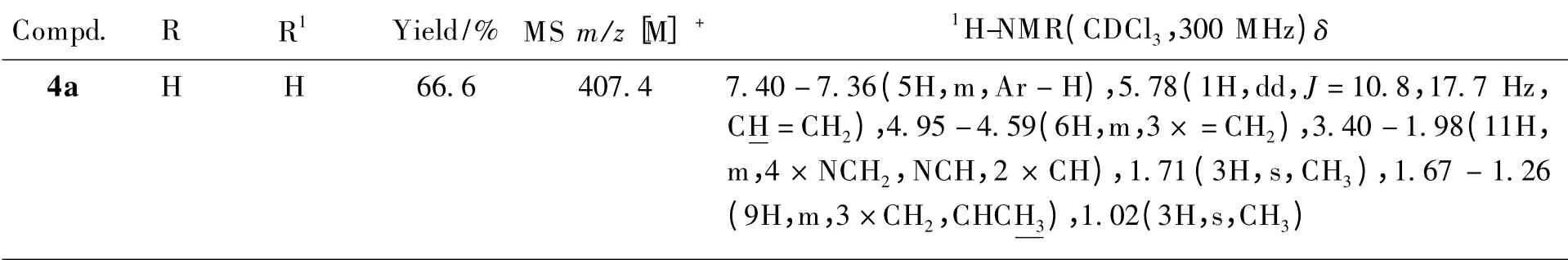
Table 1 The structures,spectral and experimental date of the target compounds
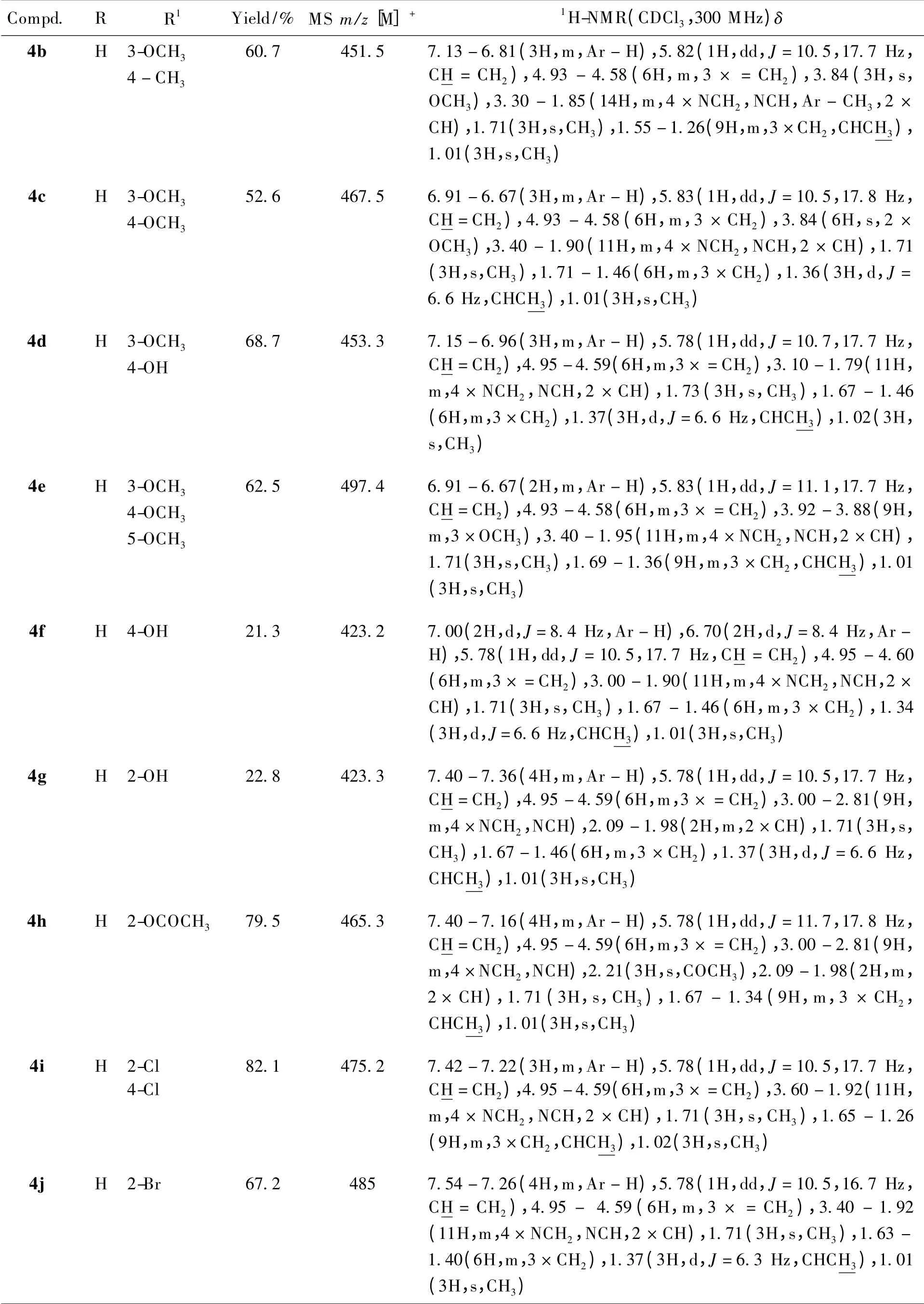
Continued Table 1

Continued Table 1

Continued Table 1
3 药理实验
实验所用肿瘤细胞株:人宫颈癌细胞HeLa、人肝癌细胞HepG2、人纤维肉瘤细胞HT-1080、人结肠癌细胞HCT116、人黑色素瘤细胞A375-S2、人乳腺癌细胞MCF-7、人肺癌细胞A549、人组织细胞淋巴瘤细胞U937、人慢性髓原白血病细胞K562、人原髓细胞白血病细胞HL60。
采用MTT 法测定目标化合物对10 种人癌细胞的增殖抑制作用。将细胞接种在含体积分数10%胎牛血清、体积分数2%谷氨酰胺的RPMI-1640 培养液中,在37 ℃、体积分数5% CO2培养箱中培养。取对数生长期细胞用于抑制率测定实验,接种细胞浓度为每毫升1 ×105个。将处于对数生长期的细胞,按一定密度接种于96 孔板里(贴壁细胞待贴壁后)。实验组分别加入不同浓度的受试药物,空白对照组为190 μL RPMI-1640加10 μL 无药溶剂。每组设3 个平行孔,37 ℃培养48 h。加入5 g·L-1的MTT 溶液,每孔20 μL,继续培养4 h,离心弃去上清液,加入150 μL DMSO,振荡10 min,充分裂解后,用全自动酶标仪于492 nm 处检测吸光度(OD)值。按下式计算药物对肿瘤细胞生长的抑制率,从中求出样品的半数抑制浓度(IC50)。
肿瘤细胞生长抑制率(%) =[A(阴性对照) -A( 加药组) ]/ A( 阴性对照) ×100%。
以HeLa、MCF-7、HepG2、HCT116、A549、A375-S2、HT1080、HL60、U937 及K562 细胞对所合成的化合物(4a ~4o,5a ~5c,5e ~5g)进行体 外抗增殖活性评价,结果见表2。

Table 2 Inhibition effects of compounds on the growth of tumor cells in vitro
结果显示,目标化合物对人黑色素瘤细胞A375-S2 的抑制活性高于DX-1、DX-2;对人乳腺癌细胞MCF-7、人肺癌细胞A549、人纤维肉瘤细胞HT1080、人结肠癌细胞HCT116 的活性与化合物DX-1、DX-2 相当;对人髓性白血病细胞HL60、淋巴瘤细胞U937、人类红白血病细胞K562 的抑制活性明显低于化合物DX-1、DX-2。在DX-1、DX-2 的哌嗪基4 位氮上引入取代苯甲酰基或取代苯丙烯酰基得到的4a ~4o 和5a ~5h 两个系列化合物的活性未表现出特别明显的差异,苯环上各种取代基的影响也无明显规律。与DX-1、DX-2 相比,此类化合物体内毒性是否有所降低尚有待进一步研究。
[1] 徐莉英,陶淑娟,张兴忠,等. β-榄香烯芳杂环衍生物的合成及体外抗癌活性研究[J].中国药物化学杂志,2006,16(5):277 -280.
[2] XU Li-ying,TAO Shu-juan,WANG Xian-ming,et al.The synthesis and anti-proliferative effects of β-elemene derivatives with mTOR inhibition activity[J].Bioorg Med Chem,2006,14(15):5351 -5356.
[3] 张兴忠,徐莉英,陶淑娟,等. β-榄香烯醇酯类化合物的合成及抗癌活性研究[J]. 中国药物化学杂志,2007,17(1):13 -17.
[4] 徐莉英,王宪明,于志瀛,等. β-榄香烯胺类衍生物的合成及抗癌活性研究[J]. 中国药物化学杂志,
2009,19(4):247 -260.
[5] YU Zhi-ying,WANG Rui,XU Li-ying,et al.N-(βelemene-13-yl)tryptophan methyl ester induces apoptosis and synergizes with arsenic trioxide through a hydrogen peroxide dependent pathway in human leukemia cells[J]. Cancer Lett,2008,269(1):165 -173.
[6] 徐莉英,张兴忠,杜惠莲,等. β-榄香烯氨基酸衍生物的合成及抗肿瘤活性[J]. 中国药物化学杂志,
2013,23(3):169 -176.
[7] 陈光,丁晓飞,肖晋芳,等.榄香烯哌嗪对荷瘤小鼠免疫功能的影响[J].沈阳药科大学学报,2007,24
(4):238 -241.
[8] YU Zhi-ying,WANG Rui,XU Li-ying,et al. β-Elemene piperazine derivatives induce apoptosis in human leukemia cells through downregulation of c-FLIP and generation of ROS[J/OL]. PLoS One,2011,6(1):e15843.
[9] 陈光,丁晓飞,肖晋芳.榄香烯衍生物诱导HeLa 细胞凋亡的实验研究[J].中国药理学通报,2007,23(2):246 -250.
[10] 万伯顺,肖远胜,梁鑫淼,等.一种含氮杂环β-榄香烯酰胺类衍生物其制备及应用:中国,200410050278.6[P].2006 -02 -22.