6分钟步行试验与运动心肺功能测定预测肺癌患者术后并发症的价值
2013-03-08王俊义刘毅梅崔元涛王晋祥
王俊义,张 鹏,刘毅梅,崔元涛,王晋祥
(天津医科大学总医院心胸外科,天津300052)
肺癌是最常见的恶性肿瘤,其发生率已居男性各种肿瘤的首位,目前手术仍是早期肺癌有效的治疗方法之一。但是手术为创伤性治疗,可能引起许多术后并发症甚至导致患者死亡,尤其是术前有长期吸烟史及合并慢性阻塞性肺疾病的老年患者,术后并发症发生率明显升高。相关文献报道,行手术治疗肺癌患者,呼吸道并发症占所有术后并发症的21%~40%,在所有围手术期死亡患者约30%~46%死于呼吸道并发症[1]。故预测术后呼吸道并发症对评估其手术适应征极为重要,笔者对肺癌患者行运动心肺功能试验(cardiopulmonary exercise test,CPET)及6分钟步行试验(6minute walk test,6MWT)测定,并分析各项指标与术后呼吸道并发症的关系,以期得到敏感而可靠的预测肺癌术后肺部并发症发生的方法。
1 资料与方法
1.1 研究对象 收集2011年4月-2012年6月入住我科需行肺癌手术的患者。入选患者133例,其中男87例,女46例;吸烟指数大于400支·年的患者73例;全肺切除11例,肺叶切除108例,肺楔形切除14例。患者按手术预后分为术后并发症发生组与无并发症组,其中术后肺部并发症组患者41例,无并发症组92例。两组患者在手术方式、年龄、体质量、性别等方面差异无统计学意义(P>0.05)。
术后肺部并发症入组条件[2-3]:长期氧疗(需要氧疗>2d或重新氧疗);肺炎(诊断需影像学检查有浸润现象加以下条件中任意两条:T>37.7℃,白细胞计数>10500/mm3,应用抗生素治疗);长期机械通气(术后机械通气时间>48h);二次气管插管;肺不张;支气管胸膜瘘;乳糜胸;长期漏气(需胸腔引流管引流超过7d);支气管哮喘;积脓。
1.2 方法
1.2.1 CPET测定 采用德国Jaeger Mastscreen踏车运动肺功能仪,应用运动负荷递增的方案对患者行心肺运动功能测定。向患者详细说明测定过程,以取得最佳配合。起始时,患者于踏车上静坐3min,零负荷运动3min,随后行负荷逐步递增运动,负荷方案由医师根据患者体力制定,以25W/min递增,转速为60r/min左右,运动时间控制在8~12min,运动至患者出现显著的乏力、气促、腿部疲劳等不适症状,不能维持转速,或显著的心电图改变时终止,予5min恢复,同时记录12导联心电图、动态血压、氧饱和度改变。记录各项参数,包括:峰值摄氧量占预计值百分比(VO2%P)、公斤摄氧量(VO2/kg)、无氧阈(AT)、氧脉搏(O2pulse)、呼吸频率(BF)。
入选指标意义:(1)峰值摄氧量占预计值百分比(VO2%P):在运动的最后阶段,即竭尽全力阶段,循环和呼吸系统发挥最大作用时每分钟所能摄取的氧量,其为与预计值的比值;(2)公斤摄氧量(VO2/kg):其为峰值摄氧量/体质量,消除了体质量的影响;(3)无氧阈(AT):指运动时有氧供能尚未需要无氧代谢补充供能时的最大VO2值,是运动时无氧代谢能力的标志;(4)氧脉搏占预计值百分比(O2pulse%P):其为氧脉搏实测值与预计值的比值,摄氧量与心率的比值即氧脉搏,是指每一次心搏时摄取的氧量或氧进入肺血管中的量;(5)呼吸频率(BF):指患者在运动过程中的呼吸次数。
1.2.26 MWT测定 患者第二天同一时间行6MWT。选平坦的地面划1条30m长的直线两端各置1座椅,受试者沿直线尽可能快速行走,直到6min停止,测量步行距离。试验时注意如下事项:行走时沿直线尽可能快速行走,避免快速转身和走环形路线,试验时医师不干扰患者,在6min内如果患者出现疲乏、头晕、心绞痛、呼吸困难、出冷汗、面色苍白则停止试验,试验前后应记录患者的血压、心率及呼吸频率。试验环境安静、通风良好、温度适宜,试验中应备有硝酸甘油、硫酸沙丁胺醇气雾剂等抢救药品。
1.3 统计学方法 采用SPSS 13.0软件进行统计学分析,计量资料结果以±s表示,两组间比较采用t检验,相关分析采用直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 从表1中可见,术后肺部并发症发生组较无并发症组各指标之间均有显著性差异(P<0.01或P<0.05)。
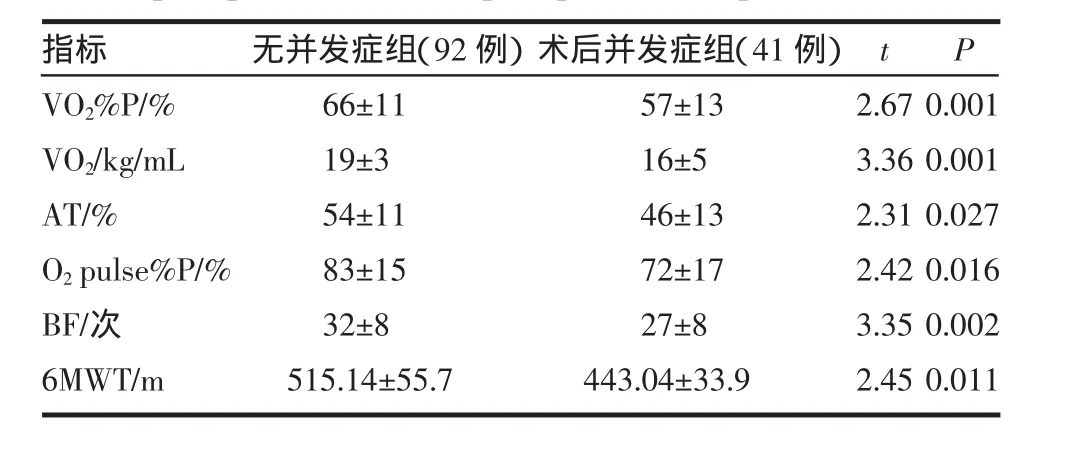
表1 术后肺部并发症组与无并发症组术前心肺运动试验测定及6min步行试验结果Tab 1 Preoperative outcomes of CPET and 6MWT in groups of postoperative and non-postoperative complication
2.2 将肺癌切除术后并发症组与无并发症组间有显著性差异的指标划分不同档次(即VO2%P、O2pulse%P分别分为<80%、<70%、……;VO2/kg<20mL、<15mL、……;AT分为<40%、<35%、<30%、……;BF分为<50次/min、<40次/min、<30次/min、……;6MWT分为≤300m、≤400m、≤500m、……)观察并发症组上述不同程度指标的术后并发症的发生率,并分别行χ2检验和Logistic回归分析,逐步剔出无显著性(P>0.05)的指标。结果见表2。

表2 各项指标的相关性分析Tab 2 The analysis of correlation between indexes and postoperative complications
2.3 选择经χ2检验有显著性的指标,分析其预测术后肺部并发症的敏感度、特异度、预测值,结果见表3。从表中我们可以看出VO2%P<50%及6MWT≤300m预测术后肺部并发症的敏感性与特异性均大于60%,阴性预测值均大于90%。
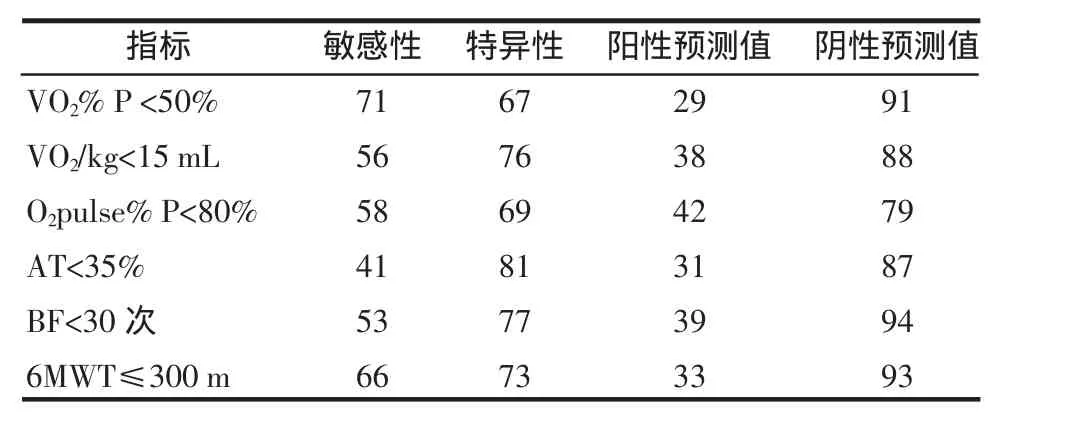
表3 指标的诊断学评价(%)Tab 3 The evaluation of indexes for diagnosis(%)
2.4 从表4中我们可以看出,当将VO2%P<50%与6MWT≤300m联合起来预测术后肺部并发症发生率,其敏感性与特异性均优于其中任何单一指标。

表4 CPET与6MWT两者联合评价术后肺部并发症的价值(%) Tab 4The value of combining CPET with 6MWT for postoperative complications(%)
3 讨论
胸部手术患者,尤其是肺癌患者,术后肺部并发症仍是患者术后死亡的主要原因。而导致患者发生术后肺部并发症的原因很多,其中术前肺功能减退加重肺切除术对患者肺功能的影响是导致术后肺部并发症的重要原因。Femandes等[4]总结了189例肺切除患者术后并发症情况,发现FEV1与FVC的比值<60%的患者术后心肺并发症发生率为51.8%,提示术前肺功能检查是肺切除手术的必要评估手段。
自20世纪40年代至今各国学者在依据肺功能指标选择手术适应征方面做了大量的工作,已逐步形成静息肺功能-肺通气灌注扫描-心肺运动试验的评估模式[5]。Win等[6]在运动心肺功能与肺癌手术预后关系的研究中发现峰值摄氧量占预计值百分比较绝对值更敏感。其指出VO2%P>75%,>90%患者无术后不良事件。然而VO2%P<50%患者因心肺功能原因死亡及术后并发症发生的风险明显增加。因VO2%P是一项反映心肺功能的综合指标,可以全面评价气体运输系统(肺-心-血液)及肌肉细胞有氧代谢,故更适于用来预测术后并发症及评估手术风险性。6MWT是一项安全、方便、简单易行的运动试验,其评价了运动过程中所有系统全面完整的反应,包括肺、心血管系统、体循环、外周循环、血液、神经肌肉单元和肌肉代谢。通过对运动耐力的检测,反映受试者的心肺功能状态,现在已经成为评价慢性心功能不全的客观指标,而且其可用来监测重度及极重度COPD患者的肺功能变化[7]。为了找到一种在临床中简便易行又能较好地评估肺癌手术患者风险及预后的方法,我们在进行CPET的基础上加入了6MWT,本研究结果发现术后并发症发生组CPET中VO2%P、VO2/kg、AT、O2pulse%P及BF等5项指标均低于无并发症组,而且发现当VO2%P<50%时,其预测术后肺部并发症的敏感性与特异性均大于60%,阴性预测值大于90%,优于其他4项指标。6MWT中肺部并发症组6min步行距离[(443.04±33.9)m]明显低于对照组[(515.14±55.7)m],差异具有统计学意义。笔者进一步发现,当把CPET与6MWT中预测术后肺部并发症的敏感指标(VO2%P≤50%和6MWT≤300m)结合起来时,其对术后肺部并发症的预测价值明显优于其中任何一种检验方法,而且敏感性与特异性均>80%。Cote等[8]在用6MWT与VO2%P预测COPD患者死亡率的研究发现两者之间也有很好的相关性,并指出6MWT< 350m与VO2%P<41%在预测患者死亡的特异性与敏感性方面相当。
运动心肺功能试验通过增加运动负荷,使受试者通气量、摄氧量、二氧化碳排出量及血流量等相应增加,动态反映生理负荷下人体呼吸、循环、代谢等方面的反应和功能储备,在某种程度上与肺切除手术对患者施加的负荷相似,因此能准确预测术后肺功能状态。但由于运动心肺功能为一种极量运动试验,对于一些心肺功能均减退老年人而言,难以完成CPET,而使其所测得的指标不准确。6MWT因其为一种次级量运动试验,简单易行,适用于慢性心肺功能不全的老年患者,是对运动心肺功能试验的补充。结果表明,我们把两种方法结合一起评估术后肺部并发症的发生更准确,预测价值更高,优于任何单一方式评估手术适应征及预测其风险性。
[1] Schussler O,Alifano M,Dermine H,et al.Postoperative pneumonia after major lung resection[J].Am J Respir Crit Care Med,2006, 173(10):1161
[2] Lee J Y,Jin S M,Lee C H,et al.Risk factors of postoperative pneumonia after lung cancer surgery[J].Korean Med Sci,2011,26(8): 979
[3] Matsuo M,Hashimoto N,Usami N,et al.Inspiratory capacity as a preoperative assessment of patients undergoing thoracic surgery[J]. Interact Cardiovasc Thorac Surg,2012,14(5):560
[4] Fernandes E O,Teixeira C,Silva L C.Thoracic surgery:risk factors for postoperative complications of lung resection[J].Rev Assoc Med Bras,2011,57(3):292
[5] Geoffreyl C.Clinical exercise testing[J].Clin Chest Med,1994,15(2):38
[6] Win T,Jackson A,Sharples L,et al.Cardiopulmonary exercise tests and lung cancer surgical outcome[J].Chest,2005,127(4):1159
[7] Chen H,Liang B M,Tang Y J,et al.Relationship between 6-minute walk test and pulmonary function test in stable chronic ob structive pulmonary disease with different severities[J].Chin Med J, 2012,125(17):3053
[8] Cote C G,Pinto-Plata V,Kasprzyk K,et al.The 6-min walk distance,peak oxygen uptake,and mortality in COPD[J].Chest,2007, 132(6):1778
