不同种培养基对体外诱导免疫细胞的生物活性及细胞毒作用
2013-03-08王志爽李新灵邵晓枫
王志爽,李新灵,邵晓枫,任 峰
(1.天津斯坦姆再生医学技术研究开发中心,天津300384;2.中国医学科学院血液学研究所,天津300020)
关于肿瘤的治疗传统方法如外科手术、放疗、化疗常常无法完全清除转移的恶性肿瘤细胞。过继细胞免疫治疗是治疗肿瘤的一种重要方法,作用原理主要是取出肿瘤患者体内部分有潜力的免疫细胞,由多种免疫因子刺激诱导,经过体外的干预,扩增其数量,激活和强化其功能,并教会它们如何识别机体内的异常细胞,如恶性肿瘤细胞或者病毒感染细胞,然后再回输到患者自己体内。其杀伤机制表现为直接杀伤作用和免疫效应细胞参与的间接杀伤作用。细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)是将人血单个核细胞在体外用多种细胞因子[如抗CD3单克隆抗体(CD3M cAb)、IL-2、IFN-γ等]共同培养一段时间后获得的一群异质细胞群。其兼具有T淋巴细胞强大的抗肿瘤活性和自然杀伤(NK)细胞的非主要组织相容性复合体(MHC)限制性杀瘤特点[1-2]。培养基作为细胞培养中的主要载体,对诱导杀伤细胞的各种生物活性指标起到至关重要的作用,对于免疫治疗的推广应用有重要作用。在本实验中,笔者通过运用多种培养基,比较培养出的细胞因子诱导杀伤细胞在体外增殖能力、杀伤活性、免疫表型变化及分泌细胞因子水平,旨在为临床应用提供依据。
1 材料与方法
1.1 主要试剂 CD3McAb、IL-2、IFN-γ、MD-CMSTM-N培养基、细胞处理试剂盒均为天津美德太平洋科技有限公司产品,AIM-V培养基为美国Gibco公司产品,RPMI 1640培养基为TaKaRa公司产品,MTT(噻唑盐)为Sigma公司产品,FITC标记的小鼠抗人CD3,PE标记的小鼠抗人CD8、CD56及相应的同型对照购于美国BD公司。检测细胞因子IFN-γ的ELISA试剂盒均购自上海沪宇生物科技有限公司。
1.2 靶细胞来源 BJAB为人B淋巴瘤细胞株,K562为人红白血病细胞,均引自中国医学科学院血液学研究所。
1.3 方法
1.3.1 CIK细胞的培养扩增 采集健康人外周血,将采好血液离心2300r/min 8min,上层血浆吸出转入另一离心管中,此血浆放置水浴锅中56℃,30min灭活,1800r/min离心8min,将处理好的上清转入另一离心管中放置4℃备用。用细胞处理试剂盒分得单个核细胞,分别用RPMI 1640、MD-CM-STM-N和AIM-V在培养瓶内培养,每组细胞数为2×107。每组40mL培养基内含CD3McAb 5μg/mL,IFN-γ 1000U/mL,rhIL-21000U/mL,5%自体血清,置于饱和湿度、37℃、5.0%CO2培养箱中培养,第3天添加新鲜培养液,补充CD3McAb、IFN-γ、rhIL-2用量同前,此后每3d添加新鲜培养基,补加IFN-γ用量相同,IL-2用量减半。
1.3.2 细胞增殖能力测定 在细胞培养的第0、4、7、10、13和15天分别用台盼蓝染色法计数所培养的细胞,并在镜下观察形态。
1.3.3 细胞免疫表型分析 用流式细胞仪检测(Beckman-coulter EPICS-XL)CIK细胞的免疫表型,分别在第0、6、10和15天收集5×106细胞。
1.3.4 细胞毒活性检测 以不同效靶比5∶1、10∶1、20∶1、40∶1的比例放入96孔板,另设单独靶细胞及效应细胞孔,每组设4个复孔,置37℃、5.0%CO2培养箱中培养48h,按文献[3]的MTT法测杀伤活性。
杀伤活性(%)=[靶细胞OD值-(效应细胞OD值-实验组OD值)]/靶细胞OD值×100%
1.3.5 细胞因子的测定 分别取培养第0、4、9、13、 16天的CIK细胞以1×106/mL接种于24孔板中,充分洗涤后收集上清,用ELISA双抗夹心法,按试剂盒说明检测培养上清中的IFN-γ的分泌水平。
2 结果
2.1 增殖能力比较 实验表明,在培养第0天单个核细胞光镜下呈圆形,大小均匀,前3天3组均无明显形态变化,数量无明显变化可能有微量减少。到第4~7天进入生长期,并有集落出现,但RPMI 1640组集落相对较少,3种培养条件下增长趋势无明显区别,第10~13天达到生长高峰,RPMI1640增长趋势明显不如其余两组。最终,由2×107个细胞,RPMI1640组增殖1.6×109;MD-CM-STM-N组增殖至2.2×109;AIM-V组增殖至1.8×109。MD-CMSTM-N扩增倍数为(108.75±9.04)倍,AIM-V扩增倍数为(91±5.96)倍,RPMI 1640扩增倍数(78±3.14)倍,3组差异具有统计学意义(P<0.05,图1)。
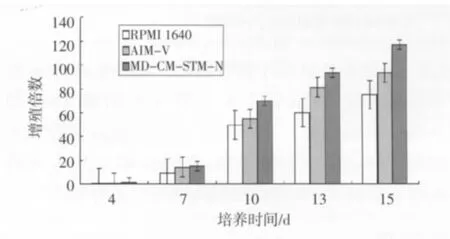
图1 培养时间与增殖倍数关系(%,±s)Fig 1 Relationship between cultured time and proliferation multiple(%,±s)
2.2 细胞免疫表型的分析 比较3种培养条件下检测CD3+、CD8+、CD3+CD56+这3种CIK细胞重要表型指标表达情况,结果表明随着培养时间延长,CD3+CD8+及CD3+CD56+双阳性细胞的比例两种无血清培养基优势明显高于RPMI 1640组(P<0.05,表1~3)。而且AIM-V表现出前期表达效率高的特点,而MD-CM-STM-N则在最终表达效率较高。
表1 3种培养基CD3细胞表型比较(±s,%,n=3)Tab 1 The CD3cell phenotypes in 3different culture mediums (±s,%,n=3)

表1 3种培养基CD3细胞表型比较(±s,%,n=3)Tab 1 The CD3cell phenotypes in 3different culture mediums (±s,%,n=3)
与RPMI 1640组值相比,*P<0.05
时间CD3+ D0D6D15RPMI164055.26±3.2282.70±3.1291.52±4.73MD-CM-STM-N 55.26±3.2289.51±2.10* 98.52±3.56* AIM-V 55.26±3.2293.01±3.22* 96.18±1.67*
表2 3种培养基CD8细胞表型的比较(±s,%,n=3)Tab 2 The CD8cell phenotypes in 3different culture mediums (±s,%,n=3)
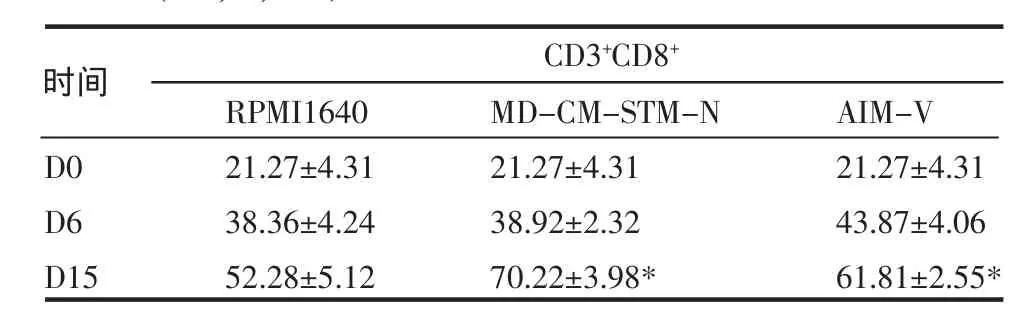
表2 3种培养基CD8细胞表型的比较(±s,%,n=3)Tab 2 The CD8cell phenotypes in 3different culture mediums (±s,%,n=3)
与RPMI 1640组值相比,*P<0.05
时间D0D6D15RPMI164021.27±4.3138.36±4.2452.28±5.12CD3+CD8+ MD-CM-STM-N 21.27±4.3138.92±2.3270.22±3.98* AIM-V 21.27±4.3143.87±4.0661.81±2.55*
2.3 杀伤活性 将3组细胞分别作为效应细胞,对BJAB及K562在不同效靶比下进行杀伤实验,结果表明3组细胞均有杀伤活性,并且随着效靶比的提高杀伤效率也随之增强,但相同效靶比下细胞毒性强度不同,MD-CM-STM-N和AIM-V组直接无显著差距但均高于RPMI1640组,尤其在高效靶比下差距明显(表4)。
表3 3种培养基CD56细胞表型比较(±s,%,n=3)Tab 3 The CD56cell phenotypes in 3different culture mediums (±s,%,n=3)

表3 3种培养基CD56细胞表型比较(±s,%,n=3)Tab 3 The CD56cell phenotypes in 3different culture mediums (±s,%,n=3)
与RPMI 1640组值相比,*P<0.05,**P<0.01
时间D0D6D15RPMI16401.92±1.015.72±1.5511.27±2.01CD3+CD56+ MD-CM-STM-N 1.92±1.019.58±2.3721.52±3.32** AIM-V 1.92±1.0112.81±1.58* 25.60±2.18**
表4 3种培养基对瘤细胞杀伤活性(±s,%,n=3)Tab 4 Killing activities on tumour cells by 3different culture mediums(±s,%,n=3)

表4 3种培养基对瘤细胞杀伤活性(±s,%,n=3)Tab 4 Killing activities on tumour cells by 3different culture mediums(±s,%,n=3)
与RPMI 1640组值相比,*P<0.05
BJAB E/T 5:110∶120∶140∶1RPMI 164013.12±2.1221.3±1.2133.86±2.0352.70±2.18MD-CM-STM-N 19.11±3.1232.76±0.9640.28±2.33* 61.25±5.16* AIM-V 21.12±4.1428.13±2.3139.97±2.7857.96±2.23RPMI 164010.16±1.9515.28±3.6027.61±4.0140.12±2.01K562MD-CM-STM-N 14.17±2.2120.38±3.1334.81±3.14* 53.2±2.78* AIM-V 16.19±3.1523.60±2.6134.92±2.08* 52.56±3.13*
2.4 细胞分泌IFN-γ能力测定 实验发现,3种培养基培养细胞均分泌IFN-γ,第4天RPMI 1640组达到分泌最高峰,其余两组也接近最高值略低于RPMI 1640组,但MD-CM-STM-N和AIM-V培养细胞分泌因子有相对稳定的高强度分泌时期(图2)。
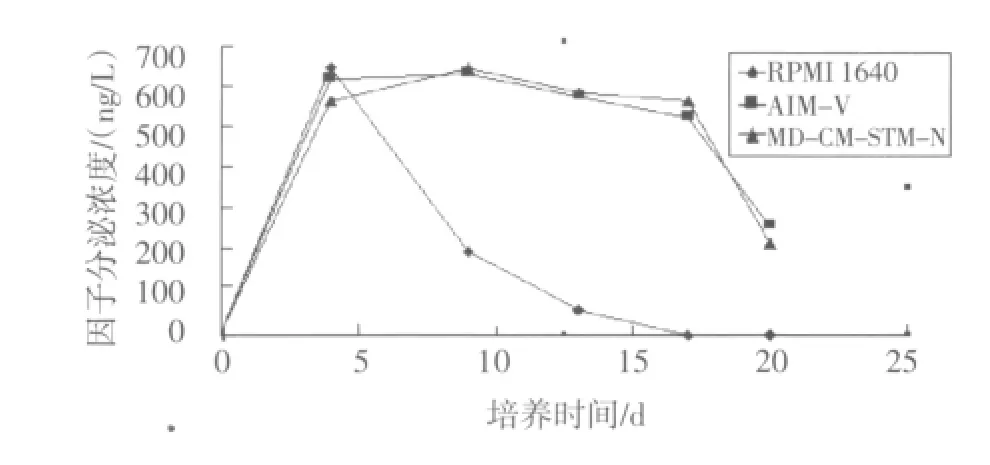
图2 3 种培养基培养细胞IFN-γ分泌比较Fig 2 IFN-γ secretion of cells in 3different culture mediums
3 讨论
CIK细胞过继免疫治疗肿瘤,克服了以往效应细胞增殖数量少,需输注IL-2,低效及副作用大等的不足,现已成为肿瘤生物治疗的重要分支,它对于促进患者免疫系统的重建、骨髓净化、微小残留病灶的清除以及防止肿瘤的复发和转移等均具有重要的意义[4]。而作为免疫细胞体外增殖诱导的重要载体即为培养基,它直接关系着体外诱导结果,包括增殖数量、杀瘤效果等等,因为传统培养基添加大量异体血清存在安全隐患,无血清培养基由于其所需血清大幅降低,在血源性细胞的培养中自身血样中提取的小量血清即可满足,甚至可以无需添加而被广泛应用。现在无血清培养基已用于血源性细胞的培养、真核系统中重组蛋白的表达、病毒及寄生虫的繁殖等各个方面[5-9]。
无血清培养基MD-CM-STM-N和AIM-V是可用于临床试验的体外诱导免疫细胞的产品。本实验中,笔者主要通过几项重要指标测试其对体外增殖诱导免疫细胞的支持能力,是关于免疫治疗的重要基础条件。
CIK细胞是在多种细胞因子诱导条件存在下,从外周血、骨髓或脐血中分离出单个核细胞,经过一定时间培养而获得的一种免疫活性细胞。其兼有T淋巴细胞强大的抗瘤活性与NK细胞的非主要组织相容性复合物(MHC)限制性杀瘤特点[10],CD3、CD56能够共同表达,因此此项免疫表型检测也是探讨依据。本文从细胞增殖能力、细胞免疫表型表达水平,对瘤细胞杀伤效果以及IFN-γ分泌能力等方面比较了无血清培养基对诱导免疫细胞的支持作用,为MD-CM-STM-N培养细胞因子诱导免疫细胞的临床应用提供了依据。
从实验结果中可以看出,MD-CM-STM-N和AIM-V培养细胞的增殖速度高于RPMI 1640培养基,并且增殖高峰期平台得到延长,RPMI 1640组快速增长期在9~11d,而其余两组在9~14d一直处于快速增殖水平,从最终增殖数目看MD-CM-STM-N更为理想,这说明AIM-V增殖能力较强并且稳定,而MD-CM-STM-N增殖能力最强也同样稳定。
免疫表型的结果可以看出在CIK细胞重要表型指标、细胞毒性T细胞的表达,MD-CM-STM-N和AIM-V培养细胞也表现出明显优势,强度和持续时间均好于RPMI 1640对照组,MD-CM-STM-N在此项指标中结果显示最优。由于前面提到CIK是兼具NK细胞特点的淋巴细胞,所以CD3+、CD56+的表达也是重要的指标,在此项检测中MD-CMSTM-N和AIM-V培养细胞也表现出了优于RPMI 1640组的结果,但这一表型结果中AIM-V最好,可见MD-CM-STM-N更趋向T细胞的增殖优势,而AIM-V则较多体现在NK细胞上的繁育特点。
目前CIK细胞的抗肿瘤作用机制还未完全明了,但普遍认为CIK细胞可被淋巴细胞功能相关抗原有关识别结构激活,导致胞浆毒性颗粒释放和BLT酯酶产生而杀伤肿瘤细胞;因表面CD3受体结合而激活,导致胞浆毒性颗粒释放而产生溶瘤作用;可产生大量炎性细胞因子,实现对肿瘤细胞的抑制或杀伤;CIK细胞也可诱导肿瘤细胞凋亡[11]。
本实验所用两种瘤细胞对杀瘤效果做了基础探讨,RPMI 1640杀伤效果不如另外两组,而MDCM-STM-N和AIM-V在不同靶细胞的杀伤实验中表现出差异,具体定向杀伤机制尚未完全明确。3种培养基培养细胞的IFN-γ分泌水平也有差异,这一指标可以代表细胞活化程度,MD-CM-STM-N和AIM-V组无明显差异,但表现出优于RPMI 1640组的分泌稳定性,说明更利于维持细胞长时间活性。
由于无血清培养基增殖诱导活化功能,表现出更强更稳定水平,成分明确安全,对于临床的追溯性更强,因此在免疫细胞治疗中有着长远优势和应用前景,本文实验结果显示国内无血清培养基更适于生物治疗研究。
[1] Schmidt-Wolf I G,Negrin R S,Kiem H P,et al.Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity[J].J Exp Med,1991, 174(1):139
[2] Kim H M,Kang J S,Lim J,et al.Inhibition of human ovarian tumor growth by cytokine-induced killer cells[J].Arch Pharm Res,2007, 30(11):1464
[3] 魏绪仓,邢佩霓,赵文理,等.人脐血CD3AK细胞生物学活性及抗瘤作用的实验研究[J].西安交通大学学报(医学版),2005,26(1):52
[4] 黄建云.健康人和肿瘤患者CIK细胞的生物学特性比较[J].世界肿瘤杂志,2010,9(1):8
[5] Lefebvre P,Winter J N,Kahn L E,et al.Megakaryocyte exvivo expansion potential of three hematopictic sources in serum and serumr free medium[J].J Hematother,2009,8(1):199
[6] Lee G M,Kim E J,Kim N S,et al.Development of a serunr free medium for the production of erythropoicetin by suspension culture of recombinant Chinese hanmster ovary cells using a statistical design[J].J Biotechnol,1999,69(2):85
[7] Bulter M,Burgener A,Patrick M,et al.Application of a serunr free medium for the growth of Vero cells and the production of reovirus [J].Bio-technol Prog,2000,16(1):854
[8] Zweygarth E,van Niekerk C J,de Waal D T.Continuous in vitro cultivation of Babesia caballi in serunr free mudium[J].Parasitol Res,1999,85(2):413
[9] 孙婧,陈红松.无血清培养基与完全培养基对体外诱导免疫细胞支持作用的比较[J].中国肿瘤生物治疗杂志,2001,8(3):208
[10]Linn Y C,Hui K M.Cytokine induced killer cells:NK-like T cells with cytotolytic specificity againstleukemia[J].Leuk Lymphoma, 2003,44(9):1457
[11]Carlens S,Gilljam M,Chambers B J,et al.A new method for in vitro expansion of cytotoxic human CD3-CD56+natural killer cells[J]. Hum Immunol,2001,62(10):1092
